GV HUNH THU TRC Mn HO HC LP




























- Slides: 37

GV: HUỲNH THU TRÚC Môn: HOÁ HỌC LỚP 12 Cơ Bản

Tuần 25 Bài 29: LUYỆN TẬP TÍNH CHẤT CỦA NHÔM VÀ HỢP CHẤT CỦANHÔM (2 Tiết)

TIẾT 49 – BÀI 29: LUYỆN TẬP TÍNH CHẤT CỦA NHÔM VÀ HỢP CHẤT CỦA NHÔM I. KIẾN THỨC CẦN NHỚ


Câu hỏi 1 Câu hỏi 6 Câu hỏi 2 Câu hỏi 7 Câu hỏi 3 Câu hỏi 8 Câu hỏi 4 Câu hỏi 9 Câu hỏi 5 Câu hỏi 10

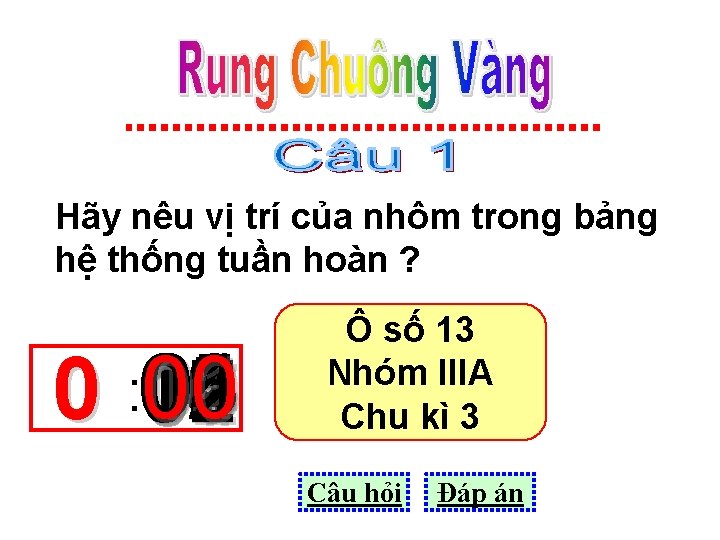
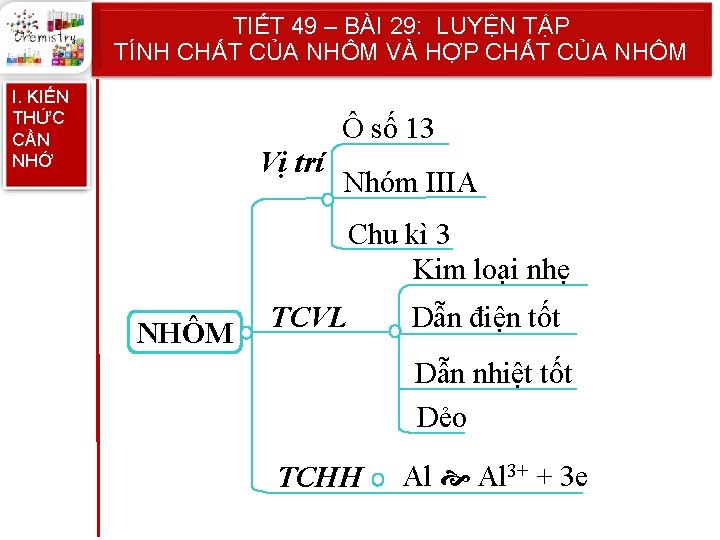
Hãy nêu vị trí của nhôm trong bảng hệ thống tuần hoàn ? 01 05 03 08 10 06 11 00 0 : 15 14 13 12 09 02 07 04 Ô số 13 Nhóm IIIA Chu kì 3 Câu hỏi Đáp án

Vì sao nhôm và hợp kim của nhôm được dùng làm vật liệu chế tạo máy bay ? 01 05 03 08 10 06 11 00 0 : 15 14 13 12 09 02 07 04 Nhôm nhẹ và bền Câu hỏi Đáp án

Trong các phản ứng hóa học, nhôm thể hiện tính chất gì ? 01 05 03 08 10 06 11 00 0 : 15 14 13 12 09 02 07 04 Tính khử mạnh Al 3+ + 3 e Câu hỏi Đáp án

Tại sao vật liệu bằng nhôm bền trong không khí và nước ? 01 05 03 08 10 06 11 00 0 : 15 14 13 12 09 02 07 04 Do có màng Al 2 O 3 bảo vệ Câu hỏi Đáp án

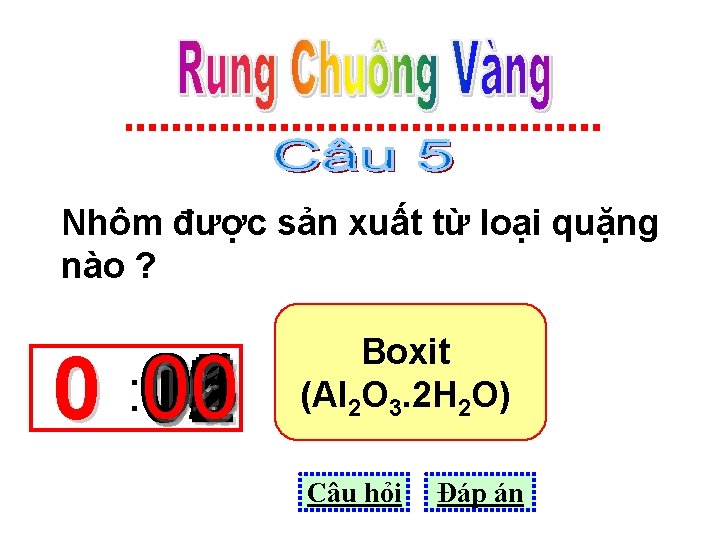
Nhôm được sản xuất từ loại quặng nào ? 01 05 03 08 10 06 11 00 0 : 15 14 13 12 09 02 07 04 Boxit (Al 2 O 3. 2 H 2 O) Câu hỏi Đáp án

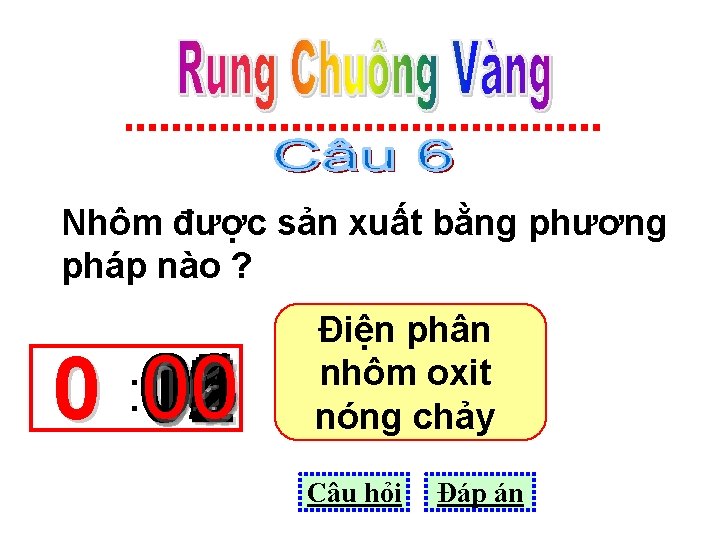
Nhôm được sản xuất bằng phương pháp nào ? 01 05 03 08 10 06 11 00 0 : 15 14 13 12 09 02 07 04 Điện phân nhôm oxit nóng chảy Câu hỏi Đáp án

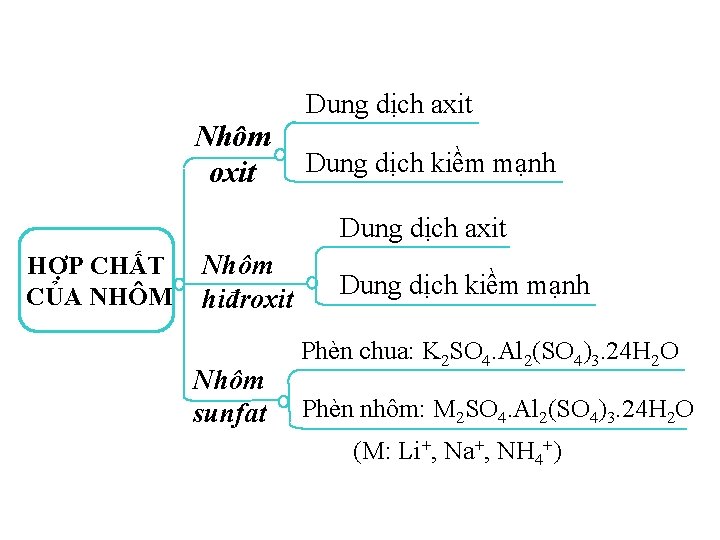
Tính chất hóa học của Al 2 O 3 và Al(OH)3 là gì ? 0 : 15 01 05 03 08 10 06 11 00 14 13 12 09 02 07 04 Lưỡng tính Câu hỏi Đáp án

Phèn chua có công thức hóa học là gì ? 0 : 15 01 05 03 08 10 06 11 00 14 13 12 09 02 07 04 K 2 SO 4. Al 2(SO 4)3. 24 H 2 O Câu hỏi Đáp án

Để nhận biết ion Al 3+ trong dung dịch, ta dùng thuốc thử gì ? 01 05 03 08 10 06 11 00 0 : 15 14 13 12 09 02 07 04 Dung dịch kiềm dư Câu hỏi Đáp án

Cho 0, 1 mol Al tác dụng với dung dịch Na. OH dư thu được bao nhiêu lít khí H 2 ở điều kiện tiêu chuẩn ? 01 05 03 08 10 06 11 00 0 : 15 14 13 12 09 02 07 04 3, 36 lít Câu hỏi Đáp án

TIẾT 49 – BÀI 29: LUYỆN TẬP TÍNH CHẤT CỦA NHÔM VÀ HỢP CHẤT CỦA NHÔM I. KIẾN THỨC CẦN NHỚ Ô số 13 Vị trí Nhóm IIIA Chu kì 3 Kim loại nhẹ NHÔM TCVL Dẫn điện tốt Dẫn nhiệt tốt Dẻo TCHH Al 3+ + 3 e

Dung dịch axit Nhôm oxit Dung dịch kiềm mạnh Dung dịch axit HỢP CHẤT CỦA NHÔM Nhôm hiđroxit Nhôm sunfat Dung dịch kiềm mạnh Phèn chua: K 2 SO 4. Al 2(SO 4)3. 24 H 2 O Phèn nhôm: M 2 SO 4. Al 2(SO 4)3. 24 H 2 O (M: Li+, Na+, NH 4+)

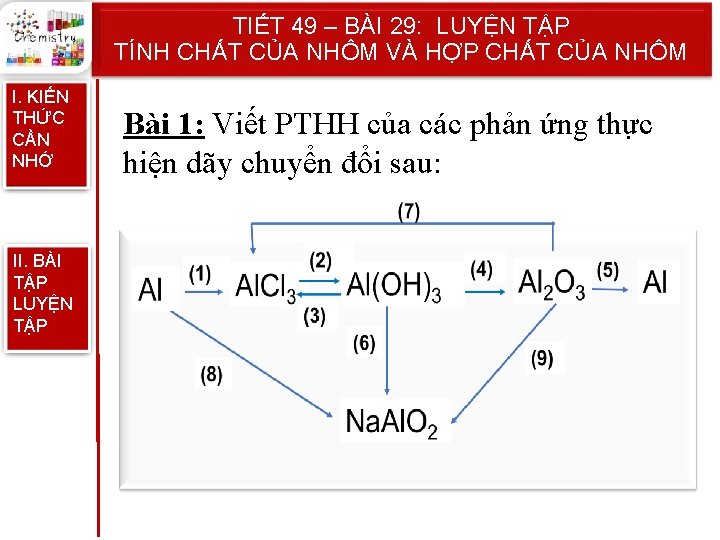
TIẾT 49 – BÀI 29: LUYỆN TẬP TÍNH CHẤT CỦA NHÔM VÀ HỢP CHẤT CỦA NHÔM I. KIẾN THỨC CẦN NHỚ II. BÀI TẬP LUYỆN TẬP Bài 1: Viết PTHH của các phản ứng thực hiện dãy chuyển đổi sau:

TIẾT 49 – BÀI 29: LUYỆN TẬP TÍNH CHẤT CỦA NHÔM VÀ HỢP CHẤT CỦA NHÔM I. KIẾN THỨC CẦN NHỚ II. BÀI TẬP LUYỆN TẬP Đáp án:

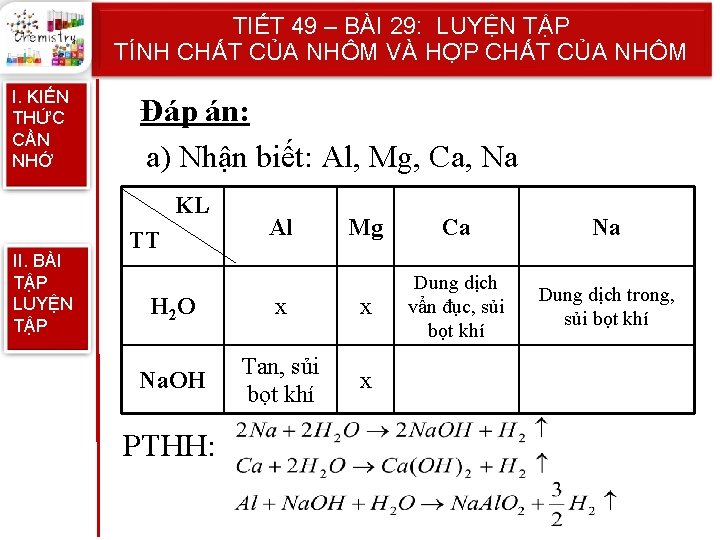
TIẾT 49 – BÀI 29: LUYỆN TẬP TÍNH CHẤT CỦA NHÔM VÀ HỢP CHẤT CỦA NHÔM I. KIẾN THỨC CẦN NHỚ II. BÀI TẬP LUYỆN TẬP Bài 2: Chỉ dùng thêm một hóa chất, hãy phân biệt các chất trong những dãy sau và viết PTHH để giải thích: a) Các kim loại: Al, Mg, Ca, Na b) Các chất bột: Ca. O, Mg. O, Al 2 O 3

TIẾT 49 – BÀI 29: LUYỆN TẬP TÍNH CHẤT CỦA NHÔM VÀ HỢP CHẤT CỦA NHÔM I. KIẾN THỨC CẦN NHỚ Đáp án: a) Nhận biết: Al, Mg, Ca, Na KL II. BÀI TẬP LUYỆN TẬP TT Al Mg Ca Na Dung dịch vẩn đục, sủi bọt khí Dung dịch trong, sủi bọt khí H 2 O x x Na. OH Tan, sủi bọt khí x PTHH:

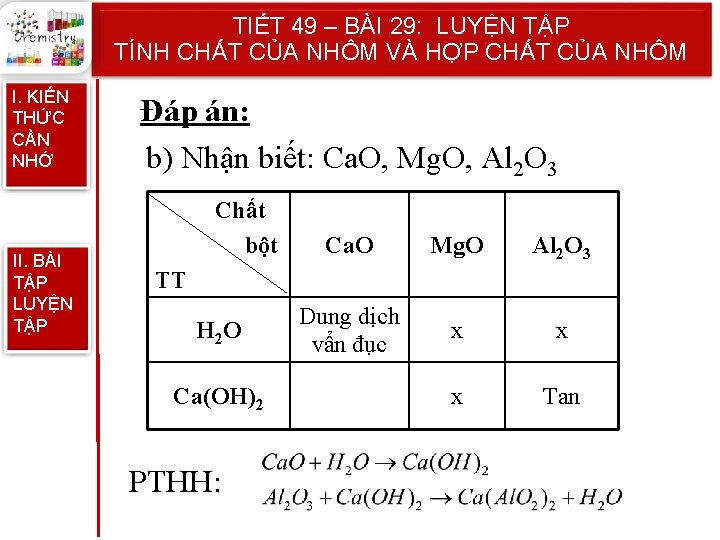
TIẾT 49 – BÀI 29: LUYỆN TẬP TÍNH CHẤT CỦA NHÔM VÀ HỢP CHẤT CỦA NHÔM I. KIẾN THỨC CẦN NHỚ II. BÀI TẬP LUYỆN TẬP Đáp án: b) Nhận biết: Ca. O, Mg. O, Al 2 O 3 Chất bột Ca. O Mg. O Al 2 O 3 Dung dịch vẩn đục x x x Tan TT H 2 O Ca(OH)2 PTHH:

TIẾT 49 – BÀI 29: LUYỆN TẬP TÍNH CHẤT CỦA NHÔM VÀ HỢP CHẤT CỦA NHÔM I. KIẾN THỨC CẦN NHỚ Bài 3: Viết PTHH để giải thích các hiện tượng xảy ra khi: a) Cho từ từ dung dịch NH 3 dư vào dung dịch Al. Cl 3 II. BÀI TẬP LUYỆN TẬP b) Cho từ từ dung dịch Na. OH đến dư vào dung dịch Al. Cl 3 c) Cho từ từ dung dịch Al 2(SO 4)3 vào dung dịch Na. OH và ngược lại d) Sục từ từ đến dư khí CO 2 vào dung dịch Na. Al. O 2 e) Cho từ từ đến dư dung dịch HCl vào dung dịch Na. Al. O 2

TIẾT 49 – BÀI 29: LUYỆN TẬP TÍNH CHẤT CỦA NHÔM VÀ HỢP CHẤT CỦA NHÔM I. KIẾN THỨC CẦN NHỚ II. BÀI TẬP LUYỆN TẬP Đáp án: a) Xuất hiện kết tủa trắng keo Al(OH)3 b) Ban đầu xuất hiện kết tủa trắng keo Al(OH)3, sau đó kết tủa tan ra dung dịch trở lại trong suốt

TIẾT 49 – BÀI 29: LUYỆN TẬP TÍNH CHẤT CỦA NHÔM VÀ HỢP CHẤT CỦA NHÔM I. KIẾN THỨC CẦN NHỚ II. BÀI TẬP LUYỆN TẬP Đáp án: c) Cho từ từ dung dịch Al 2(SO 4)3 vào dung dịch Na. OH xuất hiện kết tủa trắng keo Al(OH)3 sau đó kết tủa tan ngay. Ngược lại cho từ từ dung dịch Na. OH vào dung dịch Al 2(SO 4)3 ban đầu sẽ có kết tủa trắng keo Al(OH)3, sau đó khi dư Na. OH thì kết tủa tan ra.

TIẾT 49 – BÀI 29: LUYỆN TẬP TÍNH CHẤT CỦA NHÔM VÀ HỢP CHẤT CỦA NHÔM I. KIẾN THỨC CẦN NHỚ II. BÀI TẬP LUYỆN TẬP Đáp án: d) Xuất hiện kết tủa trắng keo Al(OH)3 e) Ban đầu xuất hiện kết tủa trắng keo Al(OH)3, sau đó khi dư HCl thì kết tủa tan.

TIẾT 49 – BÀI 29: LUYỆN TẬP TÍNH CHẤT CỦA NHÔM VÀ HỢP CHẤT CỦA NHÔM I. KIẾN THỨC CẦN NHỚ II. BÀI TẬP LUYỆN TẬP Bài 4: Cho một lượng hỗn hợp Mg – Al tác dụng với dung dịch HCl dư thu được 8, 96 lít H 2. Mặt khác, cho lượng hỗn hợp như trên tác dụng với dung dịch Na. OH dư thì thu được 6, 72 lít H 2. Các thể tích khí đều đo ở đktc. Các phản ứng xảy ra hoàn toàn. Tính khối lượng của mỗi kim loại có trong lượng hỗn hợp đã dùng.

TIẾT 49 – BÀI 29: LUYỆN TẬP TÍNH CHẤT CỦA NHÔM VÀ HỢP CHẤT CỦA NHÔM I. KIẾN THỨC CẦN NHỚ II. BÀI TẬP LUYỆN TẬP ĐỊNH HƯỚNG BÀI 4 Mg + HCl Al Mg Na. OH Al Mg. Cl Al. Cl 23 + H 2 0, 4 mol Mg Na. Al. O 2 + H 2 0, 3 mol Tính khối lượng Al; Mg

TIẾT 49 – BÀI 29: LUYỆN TẬP TÍNH CHẤT CỦA NHÔM VÀ HỢP CHẤT CỦA NHÔM I. KIẾN THỨC CẦN NHỚ II. BÀI TẬP LUYỆN TẬP Gọi x, y lần lượt là số mol của Mg, Al trong hỗn hợp. * Thí nghiệm 1: Mg + 2 HCl Mg. Cl 2 + H 2 (1) x (mol) 2 Al + 6 HCl 2 Al. Cl 3 + 3 H 2 (2) y (mol) 3 y/2 (mol) * Thí nghiệm 2: 2 Al+2 Na. OH +2 H 2 O 2 Na. Al. O 2 + 3 H 2 (3) y (mol) 3 y/2 (mol) Ta có: Theo bài ra ta có hệ phương trình:

Bài 5 (trang 134 – SGK) Vật bằng nhôm bền trong không khí và nước là do: A. Nhôm là kim loại kém hoạt động B Có màng oxit Al 2 O 3 bền vững bảo vệ B. C. Có màng hiđroxit Al(OH)3 bền vững bảo vệ D. Nhôm có tính thụ động trong nước và không khí

Bài 6 (trang 134 – SGK) Nhôm không tan trong dung dịch nào sau đây? A. HCl B. Na. HSO 4 C. H 2 SO 4 D. D NH 3

Bài 7 (trang 134 – SGK) Cho 31, 2 gam hỗn hợp bột Al và Al 2 O 3 tác dụng với dung dịch Na. OH dư thu được 13, 44 lít khí H 2(đktc). Khối lượng từng chất trong hỗn hợp ban đầu là: A. 16, 2 gam và 15 gam B. 10, 8 gam và 20, 4 gam C. 6, 4 gam và 24, 8 gam D. 11, 2 gam và 20 gam

Hướng dẫn : Ta có phản ứng: 2 Al + 2 Na. OH + 2 H 2 O → 2 Na. Al. O 2 + 3 H 2 (1) x 1, 5 x Al 2 O 3 + 2 Na. OH → 2 Na. Al. O 2 + H 2 O (2) Ta thấy chỉ có phản ứng (1) sinh ra H 2 Số mol khí H 2 sinh ra là: 13, 44/22, 4 = 0, 6 (mol) Theo (1) ta có 1, 5 x = 0, 6 => x = 0, 4 (mol) Vậy khối lượng Al là: 0, 4. 27 = 10, 8 (gam) Suy ra khối lượng Al 2 O 3 là: 31, 2 – 10, 8 = 20, 4 (gam) Đáp án: B

Bài 8: Tại sao phèn chua có tác dụng làm trong nước đục ở các vùng lũ ? - Phèn chua có công thức hóa học là: K 2 SO 4. Al 2(SO 4)3. 24 H 2 O - Khi khuấy phèn vào nước thì phèn thủy phân cho muối Al 2(SO 4)3, lúc này xảy ra phản ứng thủy phân: Al 3+ + 3 H 2 O Al(OH)3 + 3 H+ Kết tủa Al(OH)3 dạng keo có bề mặt rất phát triển, đã kết dính các hạt đất nhỏ lơ lửng trong nước đục thành hạt đất to hơn, nặng và chìm xuống làm trong nước.

Bài 9: Cho các thí nghiệm sau : (1) Sục khí CO 2 dư vào dung dịch Na. Al. O 2 (2) Sục khí NH 3 dư vào dung dịch Al. Cl 3 (3) Nhỏ từ từ đến dư dung dịch HCl loãng vào dung dịch Na. Al. O 2. Các thí nghiệm có hiện tượng giống nhau là: A. (1), (2) Đáp án: A B. (1), (3) C. (2), (3) D. (1), (2), (3)

Hướng dẫn bài 9: (1). Sục khí CO 2 dư vào dung dịch Na. Al. O 2 Hiện tượng: Xuất hiện kết tủa keo trắng, kết tủa không tan: Na. Al. O 2 + CO 2 + 2 H 2 O→ Al(OH)3 +Na. HCO 3 (2). Sục khí NH 3 dư vào dung dịch Al. Cl 3 Hiện tượng: Xuất hiện kết tủa keo trắng, kết tủa không tan: Al. Cl 3 + 3 NH 3 + 3 H 2 O → Al(OH)3 + 3 NH 4 Cl (3). Cho từ từ dd Na. OH đến dư vào dd Al. Cl 3 Hiện tượng: Xuất hiện kết tủa keo trắng, 3 Na. OH + Al. Cl 3 → Al(OH)3 ↓ + 3 Na. Cl sau đó kết tủa tan trong Na. OH dư: Na. OH + Al(OH)3 → Na. Al. O 2 + 2 H 2 O

 S; hunh
S; hunh S; hunh
S; hunh Thú mỏ vịt được xếp vào lớp thú vị
Thú mỏ vịt được xếp vào lớp thú vị Trc mrc root cause
Trc mrc root cause Trc force
Trc force Phép trừ 2 số nhị phân trong khuôn 4 bit 1011-1110
Phép trừ 2 số nhị phân trong khuôn 4 bit 1011-1110 Trc benchmark goals
Trc benchmark goals Dibels trc
Dibels trc An/trc-170
An/trc-170 Trc
Trc Trc t
Trc t T trc
T trc 1 trc
1 trc Trc-170
Trc-170 Drain survey watford
Drain survey watford Trc marc
Trc marc Sơ đồ nạp hệ điều hành
Sơ đồ nạp hệ điều hành Trc vs drc
Trc vs drc Dây tơ hồng quấn quanh chuồng lợn
Dây tơ hồng quấn quanh chuồng lợn Bài tập tính thư giá cổ phiếu thường
Bài tập tính thư giá cổ phiếu thường Chơi thử
Chơi thử Giọng cùng tên là
Giọng cùng tên là Sun mon
Sun mon Quynh-thu le
Quynh-thu le Bài tập vẽ biểu đồ hasse
Bài tập vẽ biểu đồ hasse Thu.edu
Thu.edu Sun mon
Sun mon Thư viện stl
Thư viện stl Khái niệm sống thử
Khái niệm sống thử Chiến thắng biên giới thu đông 1950 violet
Chiến thắng biên giới thu đông 1950 violet Sun mon tue
Sun mon tue Mon tue wed thurs fri sat sun
Mon tue wed thurs fri sat sun Sun mon tue
Sun mon tue Sau khi thụ phấn noãn biến thành gì
Sau khi thụ phấn noãn biến thành gì Những loài hoa thụ phấn nhờ côn trùng
Những loài hoa thụ phấn nhờ côn trùng Hình chiếu thứ 3
Hình chiếu thứ 3 Sat tomorrow
Sat tomorrow Discretionary access
Discretionary access


























































