Fzov rovnovhy v jednozlokovch sstavch Clapeyronova rovnica ClausiusClapeyronova

















- Slides: 26

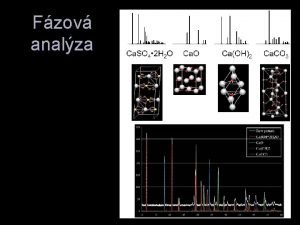
Fázové rovnováhy v jednozložkových sústavách Clapeyronova rovnica Clausius-Clapeyronova rovnica Fázové diagramy Katedra chémie, Technická univerzita v Košiciach 1

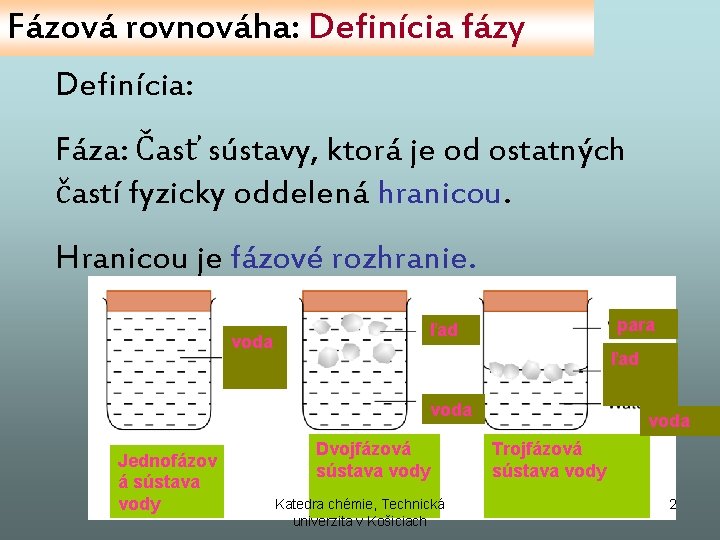
Fázová rovnováha: Definícia fázy Definícia: Fáza: Časť sústavy, ktorá je od ostatných častí fyzicky oddelená hranicou. Hranicou je fázové rozhranie. voda para ľad voda Jednofázov á sústava vody Dvojfázová sústava vody Katedra chémie, Technická univerzita v Košiciach voda Trojfázová sústava vody 2

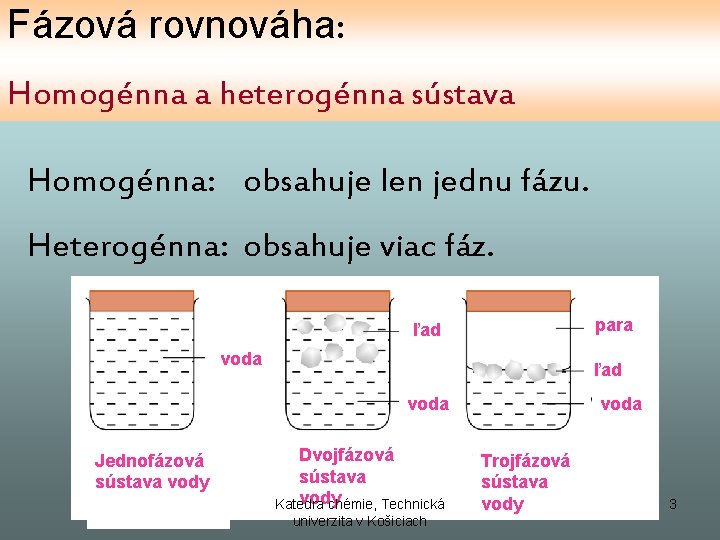
Fázová rovnováha: Homogénna a heterogénna sústava Homogénna: obsahuje len jednu fázu. Heterogénna: obsahuje viac fáz. para ľad voda Jednofázová sústava vody Dvojfázová sústava vody Katedra chémie, Technická univerzita v Košiciach voda Trojfázová sústava vody 3

Dvojfázová rovnováha: • Vyparovanie: A(l) A(g) • Kondenzácia: A(g) A(l) • Topenie: A(s) A(l) • Tuhnutie: A(l) A(s) • Rekryštalizácia: A(s 1) A(s 2) Katedra chémie, Technická univerzita v Košiciach 4

Clapeyronova rovnica • Popisuje dvojfázové rovnováhy: s-s, s-l ΔH je entalpia fázovej premeny (J/K. mol) T je teplota fázovej premeny (K) Δ V je zmena mólového objemu pri fázovej premene (m³) Katedra chémie, Technická univerzita v Košiciach 5

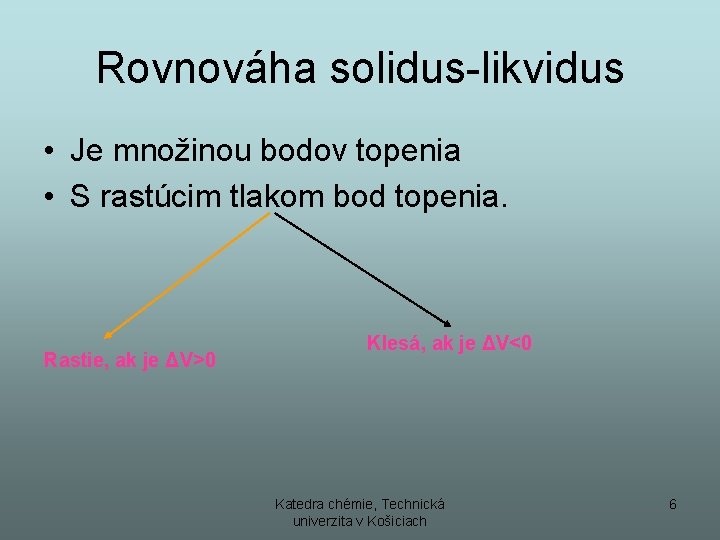
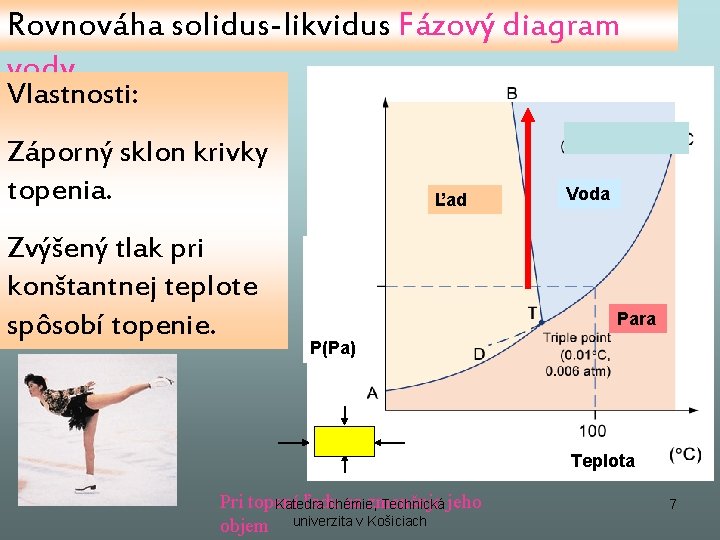
Rovnováha solidus-likvidus • Je množinou bodov topenia • S rastúcim tlakom bod topenia. Rastie, ak je ΔV>0 Klesá, ak je ΔV<0 Katedra chémie, Technická univerzita v Košiciach 6

Rovnováha solidus-likvidus Fázový diagram vody Vlastnosti: Záporný sklon krivky topenia. Zvýšený tlak pri konštantnej teplote spôsobí topenie. Ľad Voda Para P(Pa) Teplota Pri topení ľadu sa zmenšuje Katedra chémie, Technická jeho objem univerzita v Košiciach 7

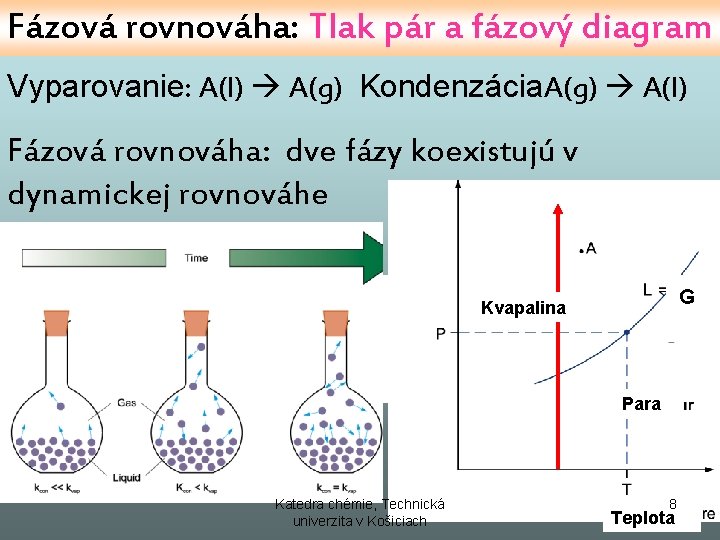
Fázová rovnováha: Tlak pár a fázový diagram Vyparovanie: A(l) A(g) Kondenzácia. A(g) A(l) Fázová rovnováha: dve fázy koexistujú v dynamickej rovnováhe GG Kvapalina Para Katedra chémie, Technická univerzita v Košiciach 8 Teplota

Dvojfázové rovnováhy s prítomnosťou pary: sublimácia a vyparovanie • Sublimácia : (s) → (g) • Tuhý oxid uhličitý známy ako „suchý ľad“ nejestvuje pri normálnom tlaku v kvapalnom stave. Suchý ľad sa netopí, ale sublimuje. Katedra chémie, Technická univerzita v Košiciach Suchý ľad 9

Body sublimácie niektorých látok Látka Bod sublimácie (ºC) Acetylén - 84 Oxid uhličitý - 78. 5 Grafit 3825 Fosfor (červený) 416 Katedra chémie, Technická univerzita v Košiciach 10

Vyparovanie: (l) → (g) • K vyparovaniu dochádza vtedy keď je počet molekúl, ktoré opúšťajú kvapalinu väčší ako počet molekúl, ktorý vstupujú do kvapaliny. • Ku kondenzácii dochádza vtedy ak viac molekúl vstupuje do kvapaliny ako kvapalinu opúšťa. • Hnacou silou toho je koncentrácia molekúl látky v atmosfére. Katedra chémie, Technická univerzita v Košiciach 11

Vyparovanie: (l) → (g) • Ak je koncentrácia vysoká, prevláda kondenzácia • Ak ani jeden proces neprevláda je to preto, že v v plynnej fáze je správna koncentrácia molekúl – nie je to ani viac a ani menej ako treba. • Plynná fáza je vtedy NASÝTENÁ • Tlak pary nad kvapalinou sa nazýva TLAK NASÝTENEJ PARY • Tlak nasýtenej pary sa zvyšuje s rastúcou teplotou Katedra chémie, Technická univerzita v Košiciach 12

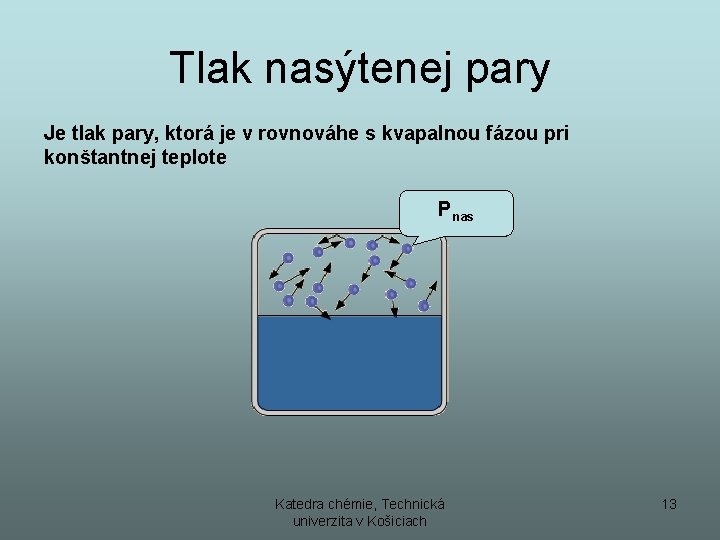
Tlak nasýtenej pary Je tlak pary, ktorá je v rovnováhe s kvapalnou fázou pri konštantnej teplote Pnas Katedra chémie, Technická univerzita v Košiciach 13

Vyparovanie • Vyparovanie kvapaliny v uzavretej nádobe prebieha dovtedy kým je počet molekúl, ktoré sa za jednotku času vyparia z povrchurovnaký ako počet molekúl, ktoré skondenzujú. • Vtedy je para NASÝTENÁ a jej tlak sa nazýva tlak nasýtenej pary. • Pri vyššej teplote uniká z povrchu kvapaliny viac molekúl a preto je tlak nasýtenej pary vyšší. • Ak je kvapalina v otvorenej nádoby je tlak pary parciálnym tlakom v zmesi plynov vo vzduchu. • Teplota, pri ktorej je tlak pary rovný atmosférickému tlaku sa nazýva bod varu. Katedra chémie, Technická univerzita v Košiciach 14

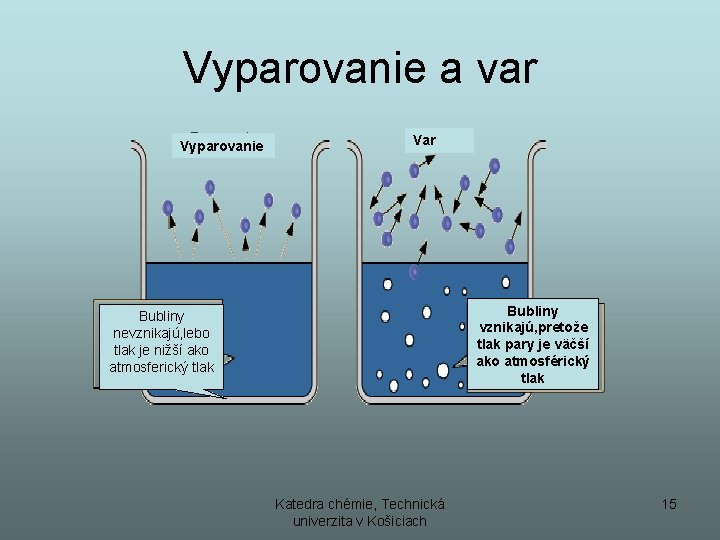
Vyparovanie a var Vyparovanie Var Bubliny vznikajú, pretože tlak pary je väčší ako atmosférický tlak Bubliny nevznikajú, lebo tlak je nižší ako atmosferický tlak Katedra chémie, Technická univerzita v Košiciach 15

Dvojfázové rovnováhy s prítomnosťou pary • Clausiusova-Clapeyronova rovnica P 2 je tlak pary pri teplote T 2 P 1 je tlak pary pri teplote T 1 ΔH je mólová entalpia vyparovania/sublimácie R je plynová konštanta Katedra chémie, Technická univerzita v Košiciach 16

Clausius Katedra chémie, Technická univerzita v Košiciach 17

Denis Papin (1647 -1712) Katedra chémie, Technická univerzita v Košiciach 18

Katedra chémie, Technická univerzita v Košiciach 19

Tlakový hrniec Tlak pary vždy rastie ak sa zvyšuje teplota! Pri zvýšenom tlaku sa zvyšuje bod varu! Katedra chémie, Technická univerzita v Košiciach 20

Tlakový hrniec • Tlakový hrniec skracuje dobu varenia tak, že voda zostáva v kvapalnom stave pri oveľa vyššej teplote ako v obyčajnom hrnci. • Pri zvýšenom tlaku sa zvyšuje bod varu vody. Katedra chémie, Technická univerzita v Košiciach 21

Bod varu pri zníženom tlaku okolia • Pokles vonkajšieho tlaku spôsobuje zníženie bodu varu Katedra chémie, Technická univerzita v Košiciach 22

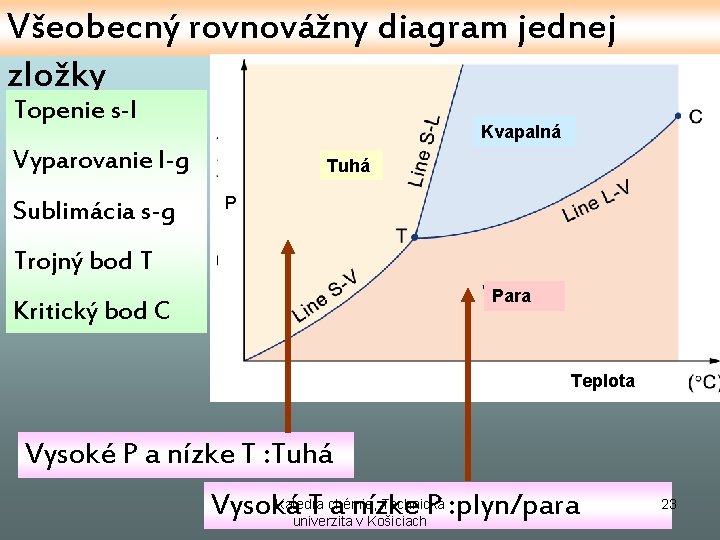
Všeobecný rovnovážny diagram jednej zložky Topenie s-l Kvapalná Vyparovanie l-g Sublimácia s-g Tuhá P Trojný bod T Para Kritický bod C Teplota Vysoké P a nízke T : Tuhá Katedra chémie, Technická Vysoká T a nízke P : plyn/para univerzita v Košiciach 23

Rovnováhy vo fázovom diagrame • • Topenie: s-l Vyparovanie l-v Sublimácia s-v Trojný bod T univariantná rovnováha: v=1 -2+2= 1 nonvariantná rovnováha: v=1 -3+2= 0 Katedra chémie, Technická univerzita v Košiciach 24

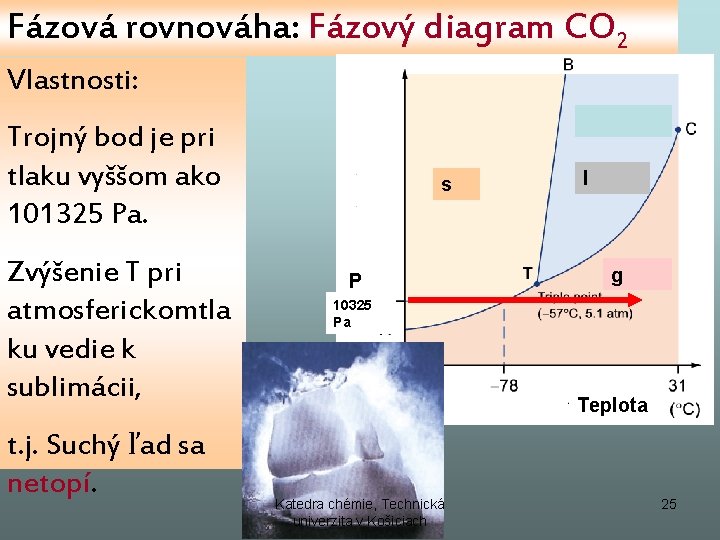
Fázová rovnováha: Fázový diagram CO 2 Vlastnosti: Trojný bod je pri tlaku vyššom ako 101325 Pa. Zvýšenie T pri atmosferickomtla ku vedie k sublimácii, t. j. Suchý ľad sa netopí. s P l g 10325 Pa Teplota Katedra chémie, Technická univerzita v Košiciach 25

Koniec Katedra chémie, Technická univerzita v Košiciach 26
 Solidus likvidus
Solidus likvidus Clapeyronova rovnica
Clapeyronova rovnica Smerovy vektor priamky
Smerovy vektor priamky Hydrodynamika
Hydrodynamika Mliečne kvasenie rovnica
Mliečne kvasenie rovnica Pri stojatom mechanickom vlnení kmitajú jednotlivé body
Pri stojatom mechanickom vlnení kmitajú jednotlivé body Vyraz s premenou
Vyraz s premenou Synapsa
Synapsa Zmiesavacia rovnica
Zmiesavacia rovnica Kalorimetrická rovnica
Kalorimetrická rovnica Normalovy vektor roviny
Normalovy vektor roviny Pozdlzne vlnenie
Pozdlzne vlnenie Rovnica paraboly
Rovnica paraboly Fotosynteza rovnica
Fotosynteza rovnica Diskretizácia
Diskretizácia Stavové veličiny
Stavové veličiny Graf nepriamej úmernosti
Graf nepriamej úmernosti Smernicovy tvar priamky
Smernicovy tvar priamky Fikov zakon
Fikov zakon Paraxialny priestor
Paraxialny priestor Premenná vyraz rovnica
Premenná vyraz rovnica Izotropné prostredie
Izotropné prostredie Rovnica hyperboly
Rovnica hyperboly Schrodingerova rovnica
Schrodingerova rovnica Rovnica postupnej mechanickej vlny
Rovnica postupnej mechanickej vlny Bilančná rovnica
Bilančná rovnica Zmiešavacia rovnica príklady
Zmiešavacia rovnica príklady