Fungsi Termodinamika Termokimia Oleh Hukum Hess Pandu Jati



























- Slides: 34

Fungsi Termodinamika, Termokimia, Oleh : Hukum Hess Pandu Jati Laksono Prodi Pend. Kimia Fakultas Ilmu Tarbiyah dan Keguruan Universitas Islam Negeri Raden Fatah Jl. KH. Zainal Abidin Fikri KM 3, 5 HP. 089695979599, Email: pandualong@gmail. com

lmu pengetahuan yang mempelajari transformasi dari pelbagai bentuk energi, pembatasan-pembatasan dalam transformasi ini serta penggunaannya. Termodinamika didasarkan atas dua postulat pokok yang dikenal sebagai hukum pertama dan hukum kedua. Hukum pertama menyangkut masalah pertukaran energi, sedangkan hukum kedua membahas arah dari pertukaran tersebut. Prodi Pendidikan Kim Termodinamika?

kalor reaksi dan suatu reaksi hendaknya dinyatakan bersama-sama dengan persamaan reaksinya, dimana kondisi-kondisi reaksi tertera dengan jelas. 1. Kalor reaksi pada Volume Tetap dan pada Tekanan Tetap 2. Penentuan Kalor Reaksi Secara Eksperimen (Kalorimetri) 3. Perhitungan Kalor Reaksi Perhitungan kalor reaksi ini dapat dilaksanakan dengan cara; a) Perhitungan dengan menggunakan Hukum Hess. b) Perhitungan data Entalpi Pembentukan Standar. c) Perkiraan Entalpi Reaksi dan data Energi Ikatan. 4. Kebergantungan Entalpi Reaksi pada temperatur. Prodi Pendidikan Kim APLIKASI HUKUM PERTAMA PADA REAKSI KIMIA

Termokimia mempelajari efek panas yang terjadi baik dalam perubahan secara kimia (reaksi kimia) maupun secera fisika (proses penguapan, peleburan, dsb. ). Efek panas dapat bersifat eksoterm, yaitu bila terjadi pelepasan kalor, dan endoterm, yaituu bila proses disertai dengan penyerapan kalor. Jumlah kalor yang bersangkutan dalam suatu reaksi bergantung pada jenis dan jumlah zat-zat yang béreaksi, pada keadaan fisik zat-zat pereaksi dan hasil reaksi, pada temperatur dan pada tekanan (terutama pada reaksi gas). Prodi Pendidikan Kim TERMOKIMIA

1. Perubahan entalpi Standar Perubahan entalpi standar per mol jika cairan murni pada tekanan 1 bar menguap menjadi tekanan 1 bar : 2. Entalpi Perubahan Fisik Perubahan entalpi standar yang menyertai perubahan fisik , dapat berupa entalpi peleburan entalpi sublimasi, entalpi pembentukan (273 K)= +716, 68 k. J/mol N 2(g) + 3 H 2(g) 2 NH 3(g) ∆H°f = -92, 22 k. J/mol gas pada Prodi Pendidikan Kim Perubahan Entalpi

Entalpi pelarutan standar ∆H°sol = suatu perubahan entalpi standar jika zat melarut pada sejumlah pelarut tertentu. HCl(g) HCl(aq) ∆Hsol = -75, 14 k. J/mol 3. Entalpi Pengionan Perubahan entalpi standar pada penghilangan satu elektron : E(g) E+ (g) + E- (g) ∆H°i = ∆U°i + R. T 4. Entalpi Perubahan Kimia Entalpi Pembakaran Standar Entalpi Hidrogenisasi Standar CH 2=CH 2(g) + H 2 (g) CH 3(g) ∆H°=-137 k. J/mol Prodi Pendidikan Kim Lanjutan

satuan panas = kalori ; joule (1 joule = 0. 24 kal); k. J ; Kkal Untuk menentukan perubahan panas yang terjadi pada reaksi-reaksi kimia dipakai kalorimeter Besarnya panas reaksi bisa dunyatakan pada : tekanan tetap ; qp = H volume tetap ; qv = U Hubungan H dan U : H = U+P V H U = + maka panas diserap, reaksi endoterm = - maka panas dilepaskan, reaksi eksoterm Prodi Pendidikan Kim Lanjutan

Ø Panas reaksi dipengaruhi oleh : - jumlah zat yang bereaksi - Keadaan fisika - Temperatur - Tekanan - Jenis reaksi (P tetap atau V tetap) Ø Dalam menuliskan reaksi kimia harus dituliskan wujud, koefisien dan kondisi percobaan. Ø Misalnya : reaksi pembentukan CO 2 pada 1 atm dan 298 K C(grafit)+ 2 O 2(g) CO 2 (g) +393, 515 k. J Prodi Pendidikan Kim Hal yang perlu diperhatikan

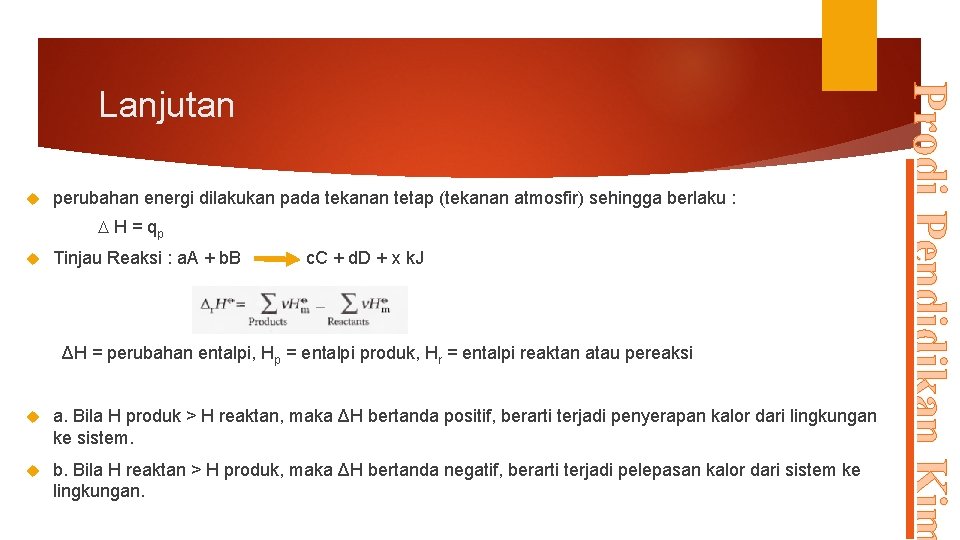
perubahan energi dilakukan pada tekanan tetap (tekanan atmosfir) sehingga berlaku : H = qp Tinjau Reaksi : a. A + b. B c. C + d. D + x k. J ΔH = perubahan entalpi, Hp = entalpi produk, Hr = entalpi reaktan atau pereaksi a. Bila H produk > H reaktan, maka ΔH bertanda positif, berarti terjadi penyerapan kalor dari lingkungan ke sistem. b. Bila H reaktan > H produk, maka ΔH bertanda negatif, berarti terjadi pelepasan kalor dari sistem ke lingkungan. Prodi Pendidikan Kim Lanjutan

Keadaan standar suatu zat pada temperatur tertentu adalah bentuk zat murni zat tersebut pada tekanan 1 bar (keadaan paling stabil) Fase Keadaan Standar Gas ideal, 1 bar, suhu tertentu Cairan murni, 1 bar, suhu tertentu Padat Kristal murni, 1 bar, suhu tertentu Misal: keadaan standar cairan etanol pada temperatur 298 K adalah cairan murni pada temperatur 298 K dan 1 bar Prodi Pendidikan Kim Keadaan Standar

1. Jika diketahui entalpi pembentukan dari berbagai zat berikut : (a) C 2 H 5 OH (l) Hf = -277, 7 k. J, (b) C 2 H 2(g) Hf = +226, 7 k. J , (c) Na. Cl(s) Hf = -410, 9 k. J Tulis Persamaan termokimia zat-zat tersebut 2. Entalpi pembakaran zat berikut : (a) Asetilene H°c = -1256 k. J/mol (b) Metanol H°c = -638 k. J/mol (c) Isooktana H°c = -5460 k. J/mol 3. Pada Pembentukan 10 g Mg. SO 4 (s) dibebaskan 107 k. J. Tulis persamaan termokimia pembentukannya, jika ( O=16, Mg=24, S=32)! 4. Pada pembakaran bensin terdapat isooktana. Tentukanlah jumlah kalor yang dibebaskan pada pembakaran 1 liter bensin , jika diketahui entalpi pembakaran -5460 k. J/mol dan massa jenis isooktana = 0, 7 kg/L. Prodi Pendidikan Kim Mari berlatih

Kalor reaksi juga ditentukan dari data entalpi pembentukan zat pereaksi dan produknya. Dalam hal ini zat pereaksi dianggap terurai lebih dahulu menjadi unsur-unsurnya, kemudian unsur-unsur bereaksi membentuk zat produk. Example : m. AB + n. CD p. AD + q. CB ∆H = ? ∆H° = [p. ∆H°f AD + q. ∆H°f CB] – [m. ∆H°f AB + n. ∆H°f CD] Prodi Pendidikan Kim Standar Entalpi Pembentukan

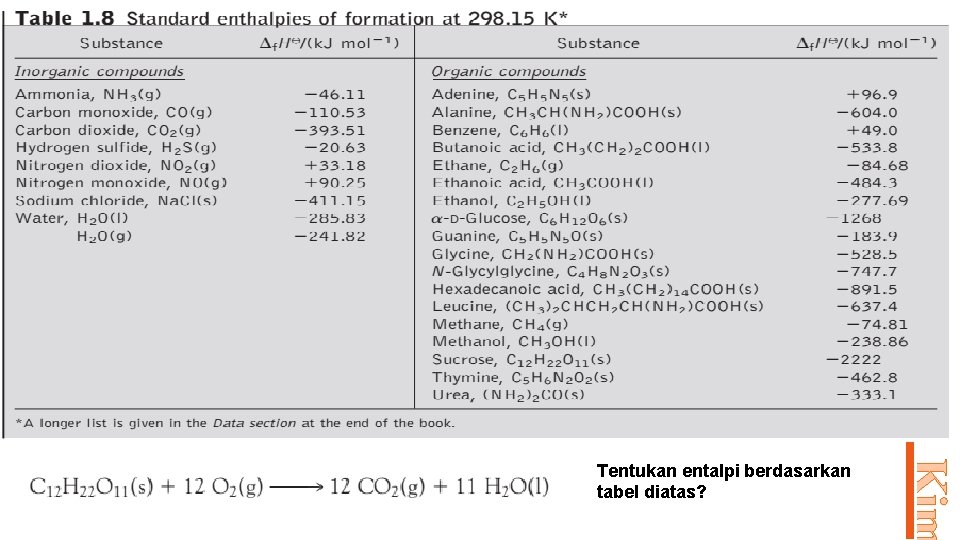
Prodi Pendidikan Kim Tentukan entalpi berdasarkan tabel diatas?

Prodi Pendidikan Kim Jawab :

Hukum Hess : Entalpi merupakan fungsi keadaan, karena itu perubahannya tidak tergantung pada jalannya proses, tetapi hanya tergantung pada keadaan awal dan keadaan akhir Reaksi: C + O 2 CO H 1 CO + O 2 CO 2 H 2 C + O 2 CO 2 H 3 Berdasarkan hukum Hess maka : H 3 = H 1+ H 2 Prodi Pendidikan Kim Hukum Hess

Definisi entalpi: H = U + PV Deferensialnya: d. H = d. U + d(PV) Untuk gas ideal: d. H = d. U + d(n. RT) Pada kondisi isotermal, dan terjadiperubahan jumlah gas, maka: H = U + n. RT Prodi Pendidikan Kim Hubungan U dan H

• Click folder Hess Prodi Pendidikan Kim Video Hess

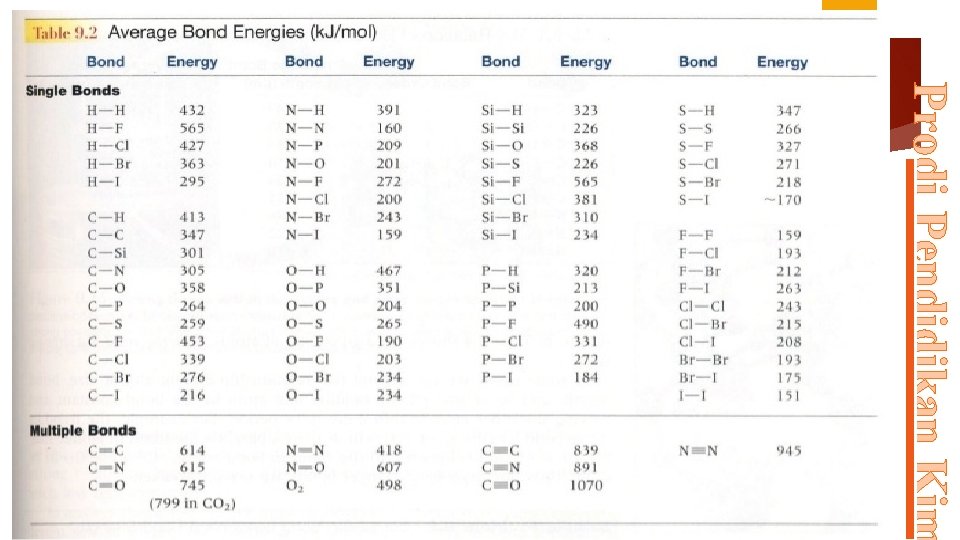
Energi disosiasi ikatan : energi yang diperlukan untuk memutuskan satu buah ikatan pada suatu molekul. Contoh : H 2 (g) 2 H (g) H 298 K=435, 9 k. J/mol Energi ikatan : rata-rata dari energi disosiasi ikatan total Data energi ikat dapat digunakan untuk meramalkan panas reaksi pada pembentukan molekul sederhana Contoh : C 2 H 2 (g) + 2 H 2 (g) C 2 H 6 (g) H= ? Hr = ∑ H pemecahan + ∑ H pembentukan dengan: H pemecahan selalu (+) H pembentukan selalu (-) Prodi Pendidikan Kim ENERGI IKATAN

Entalpi Atomisasi H atomisasi = ∑ Energi Ikatan Contoh : Reaksi Atomisasi H 2 : H 2(g) 2 H(g) H° = 436 k. J Prodi Pendidikan Kim Energi yang diperlukan untuk mengubah 1 mol zat dalam bentuk gas menjadi atom-atomnya dalam wujud gas. Atomisasi H 2 sama dengan pemutusan ikatan H-H , sehingga energi Atomisasi H 2 = energi ikatan H-H = 436 k. J/mol Energi Ikatan Rata-rata Untuk molekul yang terdiri dari tiga atau lebih atom digunakan pengertian energi ikatan rata-rata Ex : Jumlah energi dari 4 ikatan C-H dalam metana (CH 4) sama dengan entalpi standar reaksi atomisasi CH 4 (g) C(g) + 4 H(g) H°= 1. 664 k. J Dalam Hal ini H°= energi yang memutuskan 4 mol ikatan C-H, maka energi ikatan rata-rata C-H = 1664/4 =416 k. J/Mol

Untuk Cp konstan Untuk reaksi : A + B C + D Prodi Pendidikan Kim Pengaruh Suhu terhadap H

Prodi Pendidikan Kim Sehingga

Jika kapasitas panas pada tekanan tetap sebagai fungsi suhu, maka: Hubungan Cp dengan suhu dapat ditulis: Cp = a+b. T+c. T 2+d. T 3 a, b, c, d adalah tetapan Cp = a+ b. T+ c. T 2+ d. T 3 Prodi Pendidikan Kim Persamaan Kirchoff

1. Entalpi pembentukan metanol, CH 4 O(l) = -238, 6 k. J/mol, CO 2 (g) = -393, k. J/mol dan H 2 O (l) = -286 k. J/mol a. Tentukan entalpi pembakaran metanol? b. Tentukan jumlah Kalor yang dibebaskan dari pembakaran metanol? 2. Diketahui(1) S(s) + O 2(g) SO 2 (g) ∆H= -296, 8 k. J , (2) 2 SO 2(g) + O 2(g) 2 SO 3(g)∆H= -197, 8 k. J , tentukan entalpi reaksi : (3) S(s) + 1, 5 O 2(g) SO 3 (g) , ∆H. . . ? 3. Diketahui : 2 H 2(g) + O 2(g) 2 H 2 O(l) ∆H=-571, 7 k. J C 3 H 4(g) + 4 O 2(g) 3 CO 2(g) + 2 H 2 O(l) ∆H= -1941 k. J C 3 H 8(g) + 5 O 2(g) 3 CO 2(g) + 4 H 2 O(l) ∆H=-2220 k. J Tentukan Perubahan entalpi C 3 H 4(g) + 2 H 2(g) C 3 H 8 (g) ∆H=? Prodi Pendidikan Kim Latihan soal

Prodi Pendidikan Kim

1. Gunakan Tabel energi Ikatan: CH 4(g) + 2 O 2(g) CO 2(g) + 2 H 2 O(g) ∆H=. . ? CH 3 COH (g)+ H 2(g) CH 3 -CH 2 OH(g) ∆H=. . ? Prodi Pendidikan Kim

Prodi Pendidikan Kim

Prodi Pendidikan Kim

Prodi Pendidikan Kim Post Test

Prodi Pendidikan Kim

Prodi Pendidikan Kim

Prodi Pendidikan Kim

Prodi Pendidikan Kim

Prodi Pendidikan Kim

Prodi Pendidikan Kim
 Termokimia dan termodinamika
Termokimia dan termodinamika Lapisan ilmu hukum
Lapisan ilmu hukum Hukum termodinamika disebut juga sebagai
Hukum termodinamika disebut juga sebagai Hukum 1 termodinamika
Hukum 1 termodinamika Hukum nol termodinamika
Hukum nol termodinamika Hukum 2 termodinamika
Hukum 2 termodinamika Termodinamika 2
Termodinamika 2 Prinsip carnot
Prinsip carnot Aplikasi hukum termodinamika 2
Aplikasi hukum termodinamika 2 Proses termodinamika adalah
Proses termodinamika adalah Hukum termodinamik
Hukum termodinamik Hukum pertama termodinamika
Hukum pertama termodinamika Hukum termodinamika 1
Hukum termodinamika 1 Hukum kedua termodinamika entropi
Hukum kedua termodinamika entropi Sebanyak 50 ml larutan hcl 1 m bersuhu 27
Sebanyak 50 ml larutan hcl 1 m bersuhu 27 Hukum kekekalan energi termokimia
Hukum kekekalan energi termokimia Bunyi hukum hess
Bunyi hukum hess Fungsi linear dan non linear
Fungsi linear dan non linear Turunan fungsi komposisi
Turunan fungsi komposisi Dewan satuan pandu berfungsi untuk
Dewan satuan pandu berfungsi untuk Pandu nayak
Pandu nayak Lambang hw dan artinya
Lambang hw dan artinya Sosok benda kapal
Sosok benda kapal Putra pandu adikara
Putra pandu adikara Undang undang pandu hizbul wathan
Undang undang pandu hizbul wathan Pandu nayak salary
Pandu nayak salary Perintis pramuka di indonesia
Perintis pramuka di indonesia Pengurusan dan pentadbiran pandu puteri
Pengurusan dan pentadbiran pandu puteri Putra pandu adikara
Putra pandu adikara Maksud bahasa jiwa bangsa
Maksud bahasa jiwa bangsa Gambar pohon jati
Gambar pohon jati Widya mwat yasa artinya
Widya mwat yasa artinya Silsilah kerajaan pajajaran
Silsilah kerajaan pajajaran Vector kayu
Vector kayu Mot ki aagosh mein jab tak
Mot ki aagosh mein jab tak