DISPOSITIVI MEDICI NUOVE STRATEGIE E PROSPETTIVE DEL SISTEMA





























- Slides: 33

DISPOSITIVI MEDICI: NUOVE STRATEGIE E PROSPETTIVE DEL SISTEMA VIGILANZA SUI DISPOSITIVI MEDICO-DIAGNOSTICI IN VITRO: ASPETTI GENERALI Giovanna Nisticò Direzione Generale dei Farmaci e Dispositivi Medici Ministero del Lavoro, della Salute e delle Politiche Sociali Direttore Ufficio IV – Diagnostici in vitro Roma, 25 giugno 2008 dg. FDM MINISTERO DEL LAVORO, DELLA SALUTE E DELLE POLITICHE Dott. ssa Giovanna Nisticò

VIGILANZA - Le nuove linee guida § Meddev 2. 12 -1 rev 5 - April 2007 Le nuove linee guida prendono in ampia considerazione i dispositivi medicodiagnostici in vitro (IVD). dg. FDM MINISTERO DEL LAVORO, DELLA SALUTE E DELLE POLITICHE Dott. ssa Giovanna Nisticò

VIGILANZA – Le nuove linee guida MEDDEV 2. 12 -1 rev 5 - April 2007 Guidelines on a medical devices vigilance system Le nuove linee guida prevedono, tra l’altro: Ø un paragrafo (3. 1. 2) dedicato ai fabbricanti di IVD Ø un paragrafo (4. 11) in cui viene data particolare evidenza al danno indiretto causato dagli IVD Ø un paragrafo (4. 21) con la definizione di “utilizzatore” inteso come “istituzione sanitaria, professionista, paziente o chi lo assiste” Ø ripetuti riferimenti ai dispositivi per test autodiagnostici dg. FDM MINISTERO DEL LAVORO, DELLA SALUTE E DELLE POLITICHE Dott. ssa Giovanna Nisticò

VIGILANZA – Le nuove linee guida MEDDEV 2. 12 -1 rev 5 - April 2007 Guidelines on a medical devices vigilance system Le linee guida, pur non essendo legalmente vincolanti, sono state predisposte per facilitare l’applicazione uniforme e per migliorare l’implementazione delle norme del sistema di vigilanza sui dispositivi medici contenute nelle direttive 93/42/CEE (MDD), 90/385/CEE (AIMD) e 98/79/CE (IVDD). dg. FDM MINISTERO DEL LAVORO, DELLA SALUTE E DELLE POLITICHE Dott. ssa Giovanna Nisticò

VIGILANZA – Le nuove linee guida Le linee guida descrivono il sistema europeo per la notifica e la valutazione degli incidenti e le Field Safety Corrective Actions (FSCA) riguardanti i dispositivi medici (compresi gli IVD), noto come the Medical Device Vigilance System. Lo scopo principale del sistema di vigilanza è di migliorare la protezione della salute e la salvaguardia di pazienti, utilizzatori ed altri riducendo la probabilità del ripetersi di un incidente in un’altra circostanza o minimizzandone le conseguenze. Ciò si ottiene tramite la valutazione delle segnalazioni degli incidenti e tramite la diffusione delle informazioni. dg. FDM MINISTERO DEL LAVORO, DELLA SALUTE E DELLE POLITICHE Dott. ssa Giovanna Nisticò

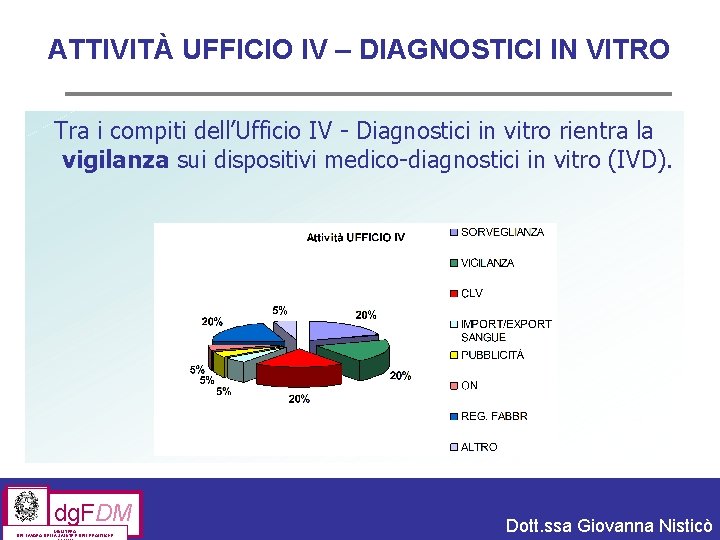
ATTIVITÀ UFFICIO IV – DIAGNOSTICI IN VITRO Il D. M. 23 giugno 2004 ha istituito, presso la Direzione generale dei farmaci e dispositivi medici, l’Ufficio IV – Diagnostici in vitro con le seguenti competenze: § autorizzazione degli organismi notificati § registrazione dei fabbricanti e banca dati europea dei dispositivi § valutazione del costo/beneficio e delle tecnologie avanzate § provvedimenti conseguenti alle ispezioni § rilascio dei certificati di libera vendita § valutazione dei messaggi pubblicitari relativi agli stessi dispositivi § rilascio autorizzazioni import/export di sangue per uso diagnostico dg. FDM MINISTERO DEL LAVORO, DELLA SALUTE E DELLE POLITICHE Dott. ssa Giovanna Nisticò

ATTIVITÀ UFFICIO IV – DIAGNOSTICI IN VITRO Tra i compiti dell’Ufficio IV - Diagnostici in vitro rientra la vigilanza sui dispositivi medico-diagnostici in vitro (IVD). dg. FDM MINISTERO DEL LAVORO, DELLA SALUTE E DELLE POLITICHE Dott. ssa Giovanna Nisticò

PRINCIPALI RIFERIMENTI NORMATIVI § Direttiva 98/79/CE relativa ai dispositivi medicodiagnostici in vitro § Decreto Legislativo 8 settembre 2000, n. 332 recante “Attuazione della direttiva 98/79/CE relativa ai dispositivi medico-diagnostici in vitro” § D. M. 15 novembre 2005 recante “Approvazione dei modelli di schede di segnalazione di incidenti o mancati incidenti, che coinvolgono dispositivi medici e dispositivi medico-diagnostici in vitro” dg. FDM MINISTERO DEL LAVORO, DELLA SALUTE E DELLE POLITICHE Dott. ssa Giovanna Nisticò

DEFINIZIONI (art. 1, d. lgs. 332/2000) dispositivo medico-diagnostico in vitro (IVD) qualsiasi dispositivo medico composto da: un reagente, un prodotto reattivo, un calibratore, un materiale di controllo, un kit, uno strumento, un apparecchio, una attrezzatura o un sistema, utilizzato da solo o in combinazione, destinato dal fabbricante ad essere impiegato in vitro per l’esame di campioni provenienti dal corpo umano, inclusi sangue e tessuti donati, unicamente o principalmente allo scopo di fornire informazioni: Ø su uno stato fisiologico o patologico, o Ø su una anomalia congenita, o Ø che consentano di determinare la sicurezza e la compatibilità con potenziali soggetti riceventi, o Ø che consentano il controllo delle misure terapeutiche dg. FDM MINISTERO DEL LAVORO, DELLA SALUTE E DELLE POLITICHE Dott. ssa Giovanna Nisticò

MARCATURA CE e LIBERA CIRCOLAZIONE Gli IVD devono recare, al momento dell’immissione in commercio, il marchio CE, corredato dal numero identificativo dell’organismo notificato nel caso in cui ne sia previsto l’intervento nelle procedure di valutazione della conformità. E’ consentita l’immissione in commercio nel territorio italiano degli IVD recanti la marcatura CE che Ø ne dimostra la conformità ai requisiti essenziali (*) del d. lgs. 332/2000 (allegato I) e Ø ne consente la libera circolazione in ambito comunitario. (*) La rispondenza ai “requisiti essenziali” significa che i dispositivi sono idonei allo scopo diagnostico stabilito e che sono stati progettati e fabbricati in modo tale che il loro uso non comprometta la salute e la sicurezza di pazienti ed utilizzatori. dg. FDM MINISTERO DEL LAVORO, DELLA SALUTE E DELLE POLITICHE Dott. ssa Giovanna Nisticò

DISPOSITIVI MEDICO-DIAGNOSTICI IN VITRO (IVD) Gli IVD, ai fini della valutazione della conformità, sono suddivisi sulla base Ø della destinazione d’uso indicata dal fabbricante e Ø del rischio per la salute pubblica in quattro gruppi: 1. Allegato II – Elenco A 2. Allegato II – Elenco B 3. Dispositivi per test autodiagnostici (sono IVD destinati dal fabbricante ad essere utilizzati a domicilio da parte di profani, quali persone non esperte di test diagnostici) 4. Altri tipi di IVD dg. FDM MINISTERO DEL LAVORO, DELLA SALUTE E DELLE POLITICHE Dott. ssa Giovanna Nisticò

DISPOSITIVI MEDICO-DIAGNOSTICI IN VITRO (IVD) Allegato II Elenco A: Reagenti e prodotti reattivi, compresi i materiali associati per la taratura e il controllo, per: v la determinazione dei seguenti gruppi sanguigni: sistema AB 0, fattore Rh (C, c, D, E, e), anti Kell v la rilevazione, l’accertamento e la quantificazione in campioni umani di marcatori dell’infezione da HIV (HIV 1 e 2), HTLV I e II e dell’epatite B, C e D Elenco B: Reagenti e prodotti reattivi, compresi i materiali associati per la taratura e il controllo, per: v la determinazione dei seguenti gruppi sanguigni: anti-Duffy e anti-Kidd v la determinazione degli anticorpi irregolari antieritrocitici v l’individuazione e la quantificazione in campioni umani delle infezioni congenite: rosolia e toxoplasmosi v la diagnosi della malattia ereditaria: fenilchetonuria v la determinazione dell’infezione da citomegalovirus e clamidia v la determinazione dei seguenti gruppi tissutali HLA: DR, A, B v la determinazione del marcatore tumorale: PSA v la valutazione del rischio della trisomia 21 v dispositivo per test autodiagnostico, compresi i materiali associati per la taratura e il controllo: dispositivo per la misurazione del glucosio nel sangue dg. FDM MINISTERO DEL LAVORO, DELLA SALUTE E DELLE POLITICHE Dott. ssa Giovanna Nisticò

REGISTRAZIONE DEI FABBRICANTI E DEI DISPOSITIVI (art. 10, d. lgs. 332/2000) Il fabbricante o il suo mandatario che immette in commercio in Italia IVD ha l’obbligo di comunicare al Ministero i suoi dati identificativi e tutti i dati atti ad identificare tali dispositivi. A titolo transitorio, fino all’attivazione della banca dati europea, i fabbricanti e/o i mandatari non stabiliti in Italia e già registrati nel loro Stato di appartenenza, sono tenuti a comunicare i dati relativi ai dispositivi che intendono mettere in commercio nel territorio italiano (art. 10, comma 6). dg. FDM MINISTERO DEL LAVORO, DELLA SALUTE E DELLE POLITICHE Dott. ssa Giovanna Nisticò

BANCA DATI EUROPEA (art. 12, d. lgs. 332/2000) In previsione dell’istituzione di una banca dati europea, il Ministero acquisisce le seguenti informazioni ai fini della loro trasmissione a detta banca dati: a) i dati relativi alla registrazione dei fabbricanti e dei dispositivi in base all’articolo 10 b) i dati relativi ai certificati rilasciati, modificati, integrati, sospesi, ritirati o rifiutati secondo le procedure di cui agli allegati III, IV, V, VI e VII c) i dati ottenuti in base alla procedura di vigilanza definita all’articolo 11 dg. FDM MINISTERO DEL LAVORO, DELLA SALUTE E DELLE POLITICHE Dott. ssa Giovanna Nisticò

Classificazione Nazionale dei dispositivi medici (CND) Commissione Unica sui dispositivi medici (CUD) La legge 289/2002 (legge finanziaria 2003), all’art. 57 ha previsto l’istituzione della CUD con il compito, tra l’altro, di classificare i dispositivi in classi e sottoclassi specifiche. La classificazione ha lo scopo di essere utilizzata per attività di sorveglianza e vigilanza da parte dell’Autorità Competente. Il decreto 20 febbraio 2007 “Approvazione della Classificazione Nazionale dei dispositivi medici (CND)” ha previsto gli IVD nella categoria “W”. dg. FDM MINISTERO DEL LAVORO, DELLA SALUTE E DELLE POLITICHE Dott. ssa Giovanna Nisticò

Classificazione Nazionale dei dispositivi medici (CND) Il decreto 20 febbraio 2007, recante “Nuove modalità per gli adempimenti previsti dall’articolo 13 del decreto legislativo 24 febbraio 1997, n. 46 e successive modificazioni e per la registrazione dei dispositivi impiantabili attivi nonché per l’iscrizione nel Repertorio dei dispositivi medici” pubblicato nel Supplemento ordinario alla “Gazzetta Ufficiale”, n. 63 del 16 marzo 2007 – Serie generale non prevede per gli IVD nuove modalità di registrazione e rinvia ad un successivo decreto l’estensione agli IVD delle disposizioni previste dal decreto sopra citato. dg. FDM MINISTERO DEL LAVORO, DELLA SALUTE E DELLE POLITICHE Dott. ssa Giovanna Nisticò

VIGILANZA IVD DIRETTIVA 98/79/CE articolo 11 DECRETO LEGISLATIVO 332/2000 articolo 11 D. M. 15 novembre 2005 “Approvazione dei modelli di schede di segnalazione di incidenti o mancati incidenti, che coinvolgono dispositivi medici e dispositivi medico-diagnostici in vitro”. Ø Linea Guida MEDDEV 2. 12 - 1 rev 5 - April 2007 Guidelines on a medical devices vigilance system dg. FDM MINISTERO DEL LAVORO, DELLA SALUTE E DELLE POLITICHE Dott. ssa Giovanna Nisticò

VIGILANZA IVD Direttiva 98/79/CE - art. 11 – Procedura di vigilanza 2)Se uno Stato membro richiede ai medici, alle istituzioni sanitarie o agli organizzatori di programmi di valutazione esterna della qualità di informare le autorità competenti di ogni incidente di cui al paragrafo 1, esso deve adottare le misure necessarie, per assicurare che sia informato dell’incidente anche il fabbricante dei dispositivi coinvolti o il suo mandatario. dg. FDM MINISTERO DEL LAVORO, DELLA SALUTE E DELLE POLITICHE Dott. ssa Giovanna Nisticò

VIGILANZA IVD d. lgs. 332/2000 – articolo 11 – Procedure di vigilanza Il comma 2 dell’articolo 11 del d. lgs. 332/2000 prevede l’obbligatorietà anche per gli operatori sanitari di comunicare al Ministero gli incidenti verificatisi con gli IVD dg. FDM MINISTERO DEL LAVORO, DELLA SALUTE E DELLE POLITICHE Dott. ssa Giovanna Nisticò

VIGILANZA IVD d. lgs. 332/2000 – articolo 11 - Procedure di vigilanza 1) Il fabbricante o il mandatario comunicano al Ministero della sanità, ai fini della registrazione e della valutazione, gli incidenti di seguito menzionati che abbiano coinvolto dispositivi muniti di marcatura CE: a) qualsiasi disfunzione, guasto o alterazione delle caratteristiche o delle prestazioni di un dispositivo, nonché ogni eventuale lacuna nell’etichetta o nelle istruzioni per l’uso che, direttamente o indirettamente, possa causare o avere causato il decesso o un peggioramento grave dello stato di salute di un paziente, di un utilizzatore o di altre persone; b) qualsiasi causa di ordine tecnico o sanitario connesso alle caratteristiche o alle prestazioni di un dispositivo, che abbia determinato, per i motivi di cui alla lettera a), il ritiro dal mercato, da parte del fabbricante, dei dispositivi dello stesso tipo. dg. FDM MINISTERO DEL LAVORO, DELLA SALUTE E DELLE POLITICHE Dott. ssa Giovanna Nisticò

VIGILANZA IVD - SANZIONI (art. 19, d. lgs. 332/2000) In caso di omessa comunicazione al Ministero di incidenti verificatisi con IVD da parte dei soggetti interessati: Ø fabbricanti, mandatari Ø legali rappresentanti delle strutture pubbliche e private Ø operatori sanitari pubblici e privati il decreto prevede l’arresto fino a 6 mesi ed un’ammenda da un milione di lire a dieci milioni di lire (da euro 516, 46 a euro 5. 164, 57). dg. FDM MINISTERO DEL LAVORO, DELLA SALUTE E DELLE POLITICHE Dott. ssa Giovanna Nisticò

VIGILANZA IVD Con il D. M. 15 novembre 2005 sono stati approvati, tra l’altro, i modelli di schede, da utilizzare per le segnalazioni al Ministero di incidenti o mancati incidenti*, specifici per gli IVD: Per gli operatori sanitari: § Scheda di rapporto di incidente o mancato incidente (allegato 4) Per i fabbricanti: 1. Scheda di rapporto iniziale (allegato 5) 2. Scheda di rapporto finale (allegato 6) * Nelle nuove linee guida non si fa più riferimento al “mancato incidente” ma si utilizza solo il termine “incidente”. Le schede si possono scaricare dal portale del Ministero. dg. FDM MINISTERO DEL LAVORO, DELLA SALUTE E DELLE POLITICHE Dott. ssa Giovanna Nisticò

VIGILANZA IVD Scheda di rapporto di incidente o mancato incidente da parte di operatori sanitari (allegato 4) La scheda è composta da 4 parti: A-“Dati relativi al luogo dove si è verificato l’episodio”: Struttura, Reparto, Data dell’episodio, Responsabile della vigilanza B-”Dati relativi al dispositivo medico-diagnostico in vitro”: Fabbricante, nome commerciale del dispositivo, Identificazione del tipo del dispositivo ( Allegato II elenco A - Allegato II elenco B - Test autodiagnostico - Altro tipo di dispositivo), C-“Dati relativi all’evento”: coinvolgimento del paziente o dell’operatore, dati sull’utilizzo del dispositivo, descrizione dell’incidente/mancato incidente, conseguenza dell’incidente, azioni intraprese dall’operatore o dalla struttura, altre informazioni D-”Dati del compilatore” dg. FDM MINISTERO DEL LAVORO, DELLA SALUTE E DELLE POLITICHE Dott. ssa Giovanna Nisticò

VIGILANZA IVD I modelli di schede da utilizzare per le segnalazioni da parte di: Ø operatori sanitari Ø fabbricanti dovranno essere rivisti alla luce delle nuove linee guida europee. I modelli dovranno essere semplificati per gli operatori sanitari. Motivi di revisione delle schede sono: ü la ridefinizione del termine “incidente” (non viene più utilizzata la terminologia “mancato incidente”) ü la tempistica di segnalazione dg. FDM MINISTERO DEL LAVORO, DELLA SALUTE E DELLE POLITICHE Dott. ssa Giovanna Nisticò

VIGILANZA IVD D. M. 15 novembre 2005, art. 2 Vengono definiti i “tempi” entro i quali devono essere effettuate al Ministero le segnalazioni di incidenti o mancati incidenti per IVD da: Ø operatori sanitari entro 10 giorni per gli incidenti e entro 30 giorni per i mancati incidenti, da quando si è verificato l’evento Øfabbricante o dal suo mandatario entro 10 giorni per gli incidenti e entro 30 giorni per i mancati incidenti dal momento in cui il fabbricante ne è venuto a conoscenza. dg. FDM MINISTERO DEL LAVORO, DELLA SALUTE E DELLE POLITICHE Dott. ssa Giovanna Nisticò

VIGILANZA IVD Le nuove linee guida per la segnalazione iniziale di incidente da parte dei fabbricanti prevedono i seguenti tempi: Ø in caso di serio pericolo per la salute pubblica IMMEDIATAMENTE e non oltre 2 giorni Ø in caso di decesso o serio peggioramento dello stato di salute IMMEDIATAMENTE e non oltre 10 giorni Ø negli altri casi IMMEDIATAMENTE e non oltre 30 giorni dg. FDM MINISTERO DEL LAVORO, DELLA SALUTE E DELLE POLITICHE Dott. ssa Giovanna Nisticò

VIGILANZA IVD Le segnalazioni devono essere inviate a: Ministero del Lavoro, della Salute e delle Politiche Sociali Dipartimento dell’Innovazione Direzione generale dei farmaci e dispositivi medici Ufficio IV – Diagnostici in vitro dell’ex Ministero della Salute Via Giorgio Ribotta, 5 00144 R O M A Fax 0039 06 59943266 dg. FDM MINISTERO DEL LAVORO, DELLA SALUTE E DELLE POLITICHE Dott. ssa Giovanna Nisticò

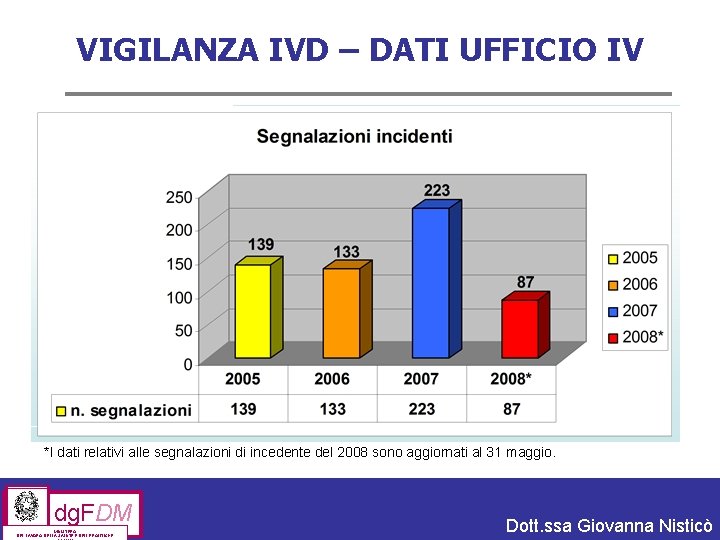
VIGILANZA IVD – DATI UFFICIO IV Il numero degli incidenti segnalati da fabbricanti, mandatari, distributori, operatori sanitari e da altre Autorità Competenti nel periodo compreso tra gennaio 2005 e maggio 2008 è di 582*. * In alcuni casi uno stesso incidente può essere segnalato da più soggetti e viene comunque gestito in un’unica valutazione. dg. FDM MINISTERO DEL LAVORO, DELLA SALUTE E DELLE POLITICHE Dott. ssa Giovanna Nisticò

VIGILANZA IVD – DATI UFFICIO IV *I dati relativi alle segnalazioni di incedente del 2008 sono aggiornati al 31 maggio. dg. FDM MINISTERO DEL LAVORO, DELLA SALUTE E DELLE POLITICHE Dott. ssa Giovanna Nisticò

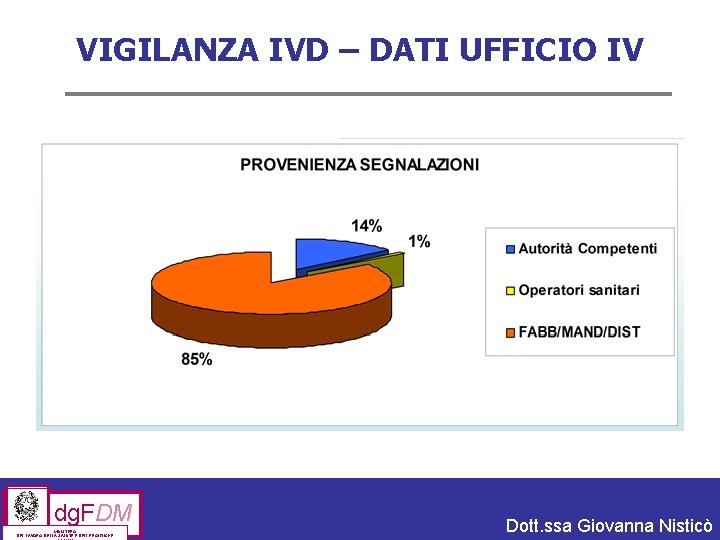
VIGILANZA IVD – DATI UFFICIO IV dg. FDM MINISTERO DEL LAVORO, DELLA SALUTE E DELLE POLITICHE Dott. ssa Giovanna Nisticò

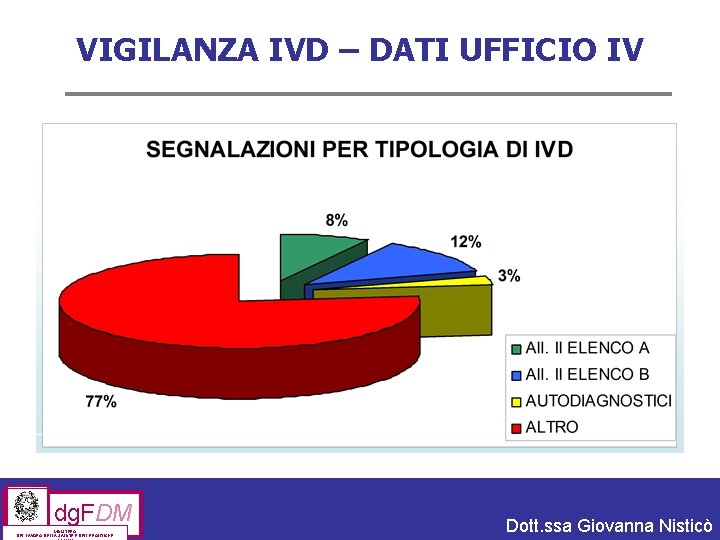
VIGILANZA IVD – DATI UFFICIO IV dg. FDM MINISTERO DEL LAVORO, DELLA SALUTE E DELLE POLITICHE Dott. ssa Giovanna Nisticò

OSSERVAZIONI E PROSPETTIVE Ø Maggiore coinvolgimento degli operatori sanitari visto che il numero di segnalazioni da parte degli stessi risulta ancora estremamente basso Ø Incremento dell’attività ispettiva presso i fabbricanti di IVD Ø Migliore coordinamento di tutti i soggetti coinvolti nelle attività connesse alla vigilanza Ø Revisione del decreto ministeriale del 15 novembre 2005 Ø Rimodulazione delle procedure di vigilanza alla luce delle nuove linee guida europee Ø Pubblicazione degli avvisi di sicurezza sul portale del Ministero (inizio fase sperimentale 1° luglio) dg. FDM MINISTERO DEL LAVORO, DELLA SALUTE E DELLE POLITICHE Dott. ssa Giovanna Nisticò

DISPOSITIVI MEDICI: NUOVE STRATEGIE E PROSPETTIVE DEL SISTEMA VIGILANZA GRAZIE dg. FDM MINISTERO DEL LAVORO, DELLA SALUTE E DELLE POLITICHE Dott. ssa Giovanna Nisticò
 Sperimentazione clinica dispositivi medici
Sperimentazione clinica dispositivi medici Classificazione nazionale dei dispositivi medici
Classificazione nazionale dei dispositivi medici Classificazione nazionale dei dispositivi medici
Classificazione nazionale dei dispositivi medici Teorie sulle emozioni
Teorie sulle emozioni Prospettive didattiche/lisa
Prospettive didattiche/lisa Teoria del legame di valenza zanichelli
Teoria del legame di valenza zanichelli Nuove tendenze del turismo
Nuove tendenze del turismo Dispositivi a semiconduttore
Dispositivi a semiconduttore Disegno tecnico dado esagonale
Disegno tecnico dado esagonale Dpi in inglese
Dpi in inglese Dispositivi di memorizzazione
Dispositivi di memorizzazione Dispositivi optoelettronici
Dispositivi optoelettronici Nuove risorse digitali e loro impatto sulla didattica
Nuove risorse digitali e loro impatto sulla didattica Dickens progresso
Dickens progresso Ente per le nuove tecnologie
Ente per le nuove tecnologie Ente per le nuove tecnologie
Ente per le nuove tecnologie Le nuove teorie di legame zanichelli
Le nuove teorie di legame zanichelli Linee guida blsd
Linee guida blsd Eugenio montale satura
Eugenio montale satura Vecchie e nuove dipendenze
Vecchie e nuove dipendenze Nuove risorse digitali e loro impatto sulla didattica
Nuove risorse digitali e loro impatto sulla didattica Sigarette diana nuove
Sigarette diana nuove Nuove tecnologie fotovoltaico
Nuove tecnologie fotovoltaico Giovanni de medici
Giovanni de medici Medici family and art
Medici family and art Giovanni de medici
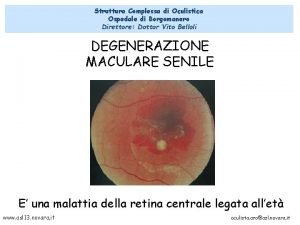
Giovanni de medici Oculistica ospedale borgomanero
Oculistica ospedale borgomanero Medici antiqui pectoris
Medici antiqui pectoris Medici antiqui pectoris
Medici antiqui pectoris The medici effect
The medici effect New sacristy san lorenzo
New sacristy san lorenzo Microintreprindere sau pfa
Microintreprindere sau pfa Ordine dei medici pistoia
Ordine dei medici pistoia Medici családfa
Medici családfa