Dispositivi Medici nuove strategie e prospettive del sistema
















- Slides: 20

Dispositivi Medici: nuove strategie e prospettive del sistema vigilanza Valeria Proietti Ministero del Lavoro, della Salute e delle Politiche Sociali Direzione generale del sistema informativo dell’ex Ministero della Salute Sistemi informativi a supporto della vigilanza sui dispositivi medici SANIT – Roma 25 Giugno 2008

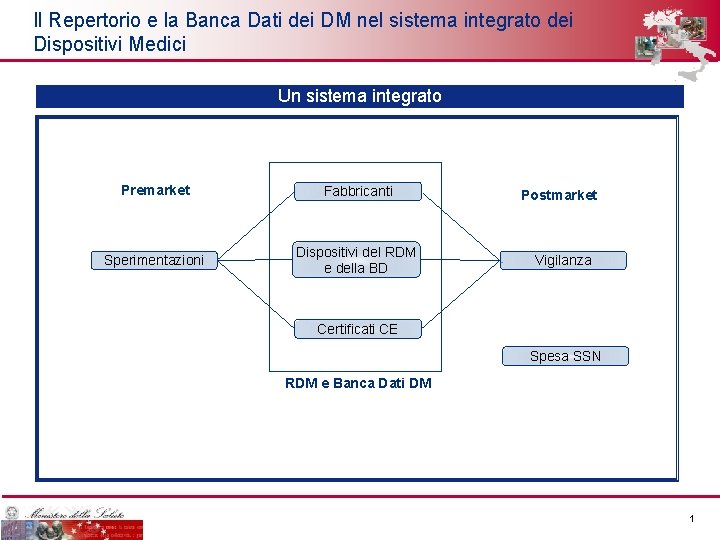
Il Repertorio e la Banca Dati dei DM nel sistema integrato dei Dispositivi Medici Un sistema integrato Premarket Fabbricanti Sperimentazioni Dispositivi del RDM e della BD Postmarket Vigilanza Certificati CE Spesa SSN RDM e Banca Dati DM 1 1

Obiettivi del progetto Obiettivo startegico dell’ NSIS Disporre di un anagrafe di riferimento unica e certa dei dispositivi medici che diventi patrimonio comune nel Nuovo Sistema Informativo Sanitario L’anagrafe dei DM è lo strumento esenziale per: ־ Governare in modo e sicuro e controllato l’acquisizione di dispositivi medici nel SSN ־ Favorire forme di acquisto centralizzate, economie e maggiore trasparenza nelle procedure di acquisto ־ Migliorare la sicurezza per il paziente e avviare la vigilanza sui dispositivi ־ Correlare, ove possibile, la prestazione sanitaria con il/i dispositivi medici coinvolti 2 2

Gli utenti del sistema informativo Ad oggi gli utenti della Banca Dati e Repertorio sono: § Fabbricante, Mandatario, Responsabile dell’immissione o altro soggetto delegato (FA/MA/RIC) – Inserimento dati aziendali (attraverso portale imprese) – Inserimento dei dispositivi – Definizione dispositivi proposti al SSN – Validazione con firma digitale § Ministero del Lavoro, della Salute e delle Politiche Sociali - Direzione Generale dei farmaci e dei dispositivi medici - Ufficio III – Esame e pubblicazione delle richieste § Regioni e Aziende Sanitarie – Consultazione del Repertorio 3 3

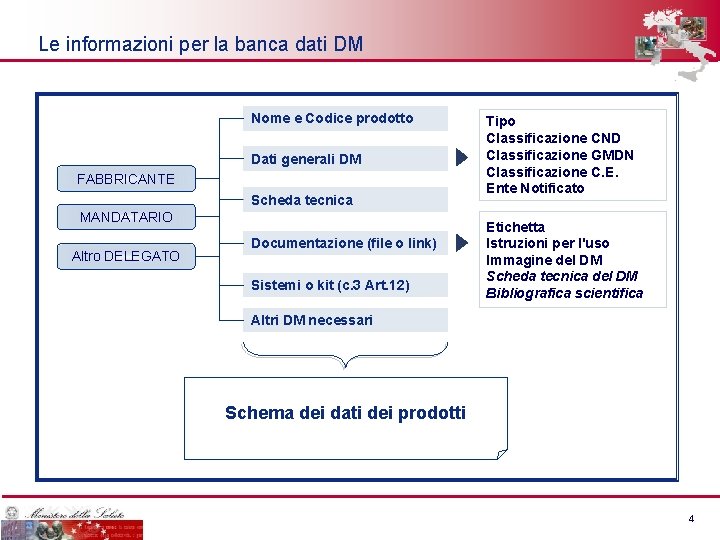
Le informazioni per la banca dati DM Nome e Codice prodotto Dati generali DM FABBRICANTE Scheda tecnica MANDATARIO Altro DELEGATO Documentazione (file o link) Sistemi o kit (c. 3 Art. 12) Tipo Classificazione CND Classificazione GMDN Classificazione C. E. Ente Notificato Etichetta Istruzioni per l'uso Immagine del DM Scheda tecnica del DM Bibliografica scientifica Altri DM necessari Schema dei dati dei prodotti 4 4

Le informazioni per la banca dati DM – Scheda Tecnica La scheda tecnica si articola in più sezioni: Caratteristiche tecniche generali Dati di sterilizzazione Descrizione del DM, destinazione d’uso (D. lgs. 46/97), misura. Solo per DM sterili (Metodo, tipo di validazione del metodo, periodo max utilizzo). Materiali costituenti il DM a diretto contatto con il paziente Latex free e certificazione relativa, materiale e condizioni di smaltimento. Presenza di tessuti sostanze di origine animale Famiglia, provenienza (Stato e documentazione), parte utilizzata di tessuti o sostanze. Presenza di medicinali Confezionamento primario Modo d'uso Principio attivo da Banca Dati Farmaco. Materiali e smaltimento particolare. Solo per pluriuso sterili o da sterilizzare (metodo, modalità, numero max). 5 5

Risultati immediati del progetto La Banca Dati e il Repertorio consentono di: § Effettuare analisi quantitative e qualitative dei dispositivi presenti sul mercato italiano § Effettuare il monitoraggio dell’offerta di DM dalla prima immissione in commercio all’uscita dal mercato § Responsabilizzare Fabbricanti/Mandatari/Responsabili dell’immissione in commercio sulla reperibilità delle informazioni e sulla loro integrità § Mettere a disposizione servizi specifici di consultazione per le Regioni e le Aziende Sanitarie. 6 6

Integrazione del sistema di Vigilanza con la Banca Dati e Repertorio dei DM § A breve Pubblicazione dell’elenco dei responsabili per la vigilanza sui dispositivi medici delle aziende sanitarie e delle Regioni, consultabile all'interno dell'area riservata del portale del ministero dedicata al Repertorio. Tale elenco potrà essere aggiornato dagli utenti del Repertorio con profilo "Regioni", per la parte relativa al territorio di competenza. § Prossimi passi Integrazione delle schede per la segnalazione di incidenti o mancati incidenti (adeguate alle nuove linee guida europee Meddev) nella Banca Dati e Repertorio dei Dispositivi Medici. 7 7

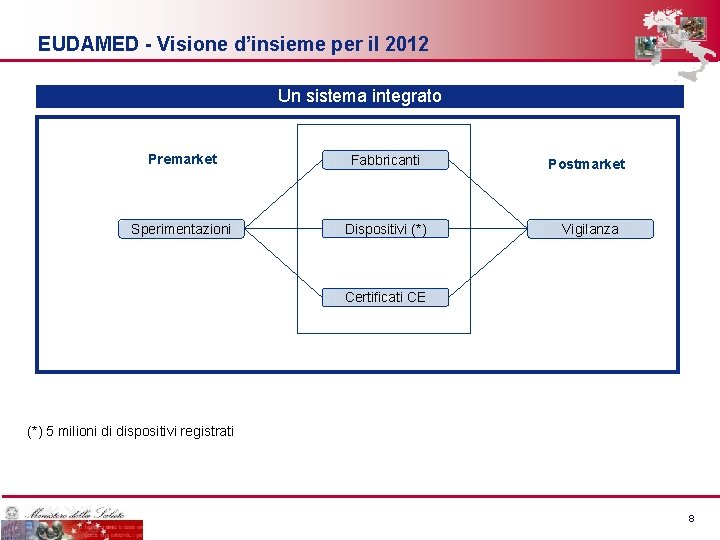
EUDAMED - Visione d’insieme per il 2012 Un sistema integrato Premarket Fabbricanti Sperimentazioni Dispositivi (*) Postmarket Vigilanza Certificati CE (*) 5 milioni di dispositivi registrati 8 8

EUDAMED – EUropean DAtabase on MEdical Device § EUDAMED si prefigura come un sistema informativo per lo scambio legale di informazioni collegate all’applicazione di direttive europee sui dispositivi medici tra la Commisisone Europea (Enterprise and Industry Directorate General) e le autorità competenti negli Stati Membri dell’UE. § EUDAMED si propone di aiutare le autorità europee nel condurre la sorveglianza sul mercato dei dispositivi medici attraverso lo scambio di informazioni. La sorveglianza del mercato dei dispositivi medici è una componente chiave dell’impianto regolatorio stabilito dalle direttive 385/90/UE, 42/93/UE e 79/98/UE. Gli Stati Membri hanno necessità di verificare che i dispositivi immessi sul mercato siano conformi con le previsioni delle direttive e che non vengano frapposti ostacoli per il libero scambio di merci. § Le Direttive raccomandano inoltre che i dati necessari siano memorizzati in un database in formato standardizzato. § “Il progetto EUDAMED” si propone di indirizzare la realizzazione di questa previsione delle Direttive. § Il progetto è articolato in due fasi. 9 9

EUDAMED – Fase 1 § Realizzazione di una applicazione accessibile via web alla Competent Authority per registrare: § § Fabbricanti Dispositivi Certificati Report di incidenti in un database comune. § Il sistema consente alle CA di registrare manualmente i dati nel database centrale o di procedere con la registrazione di più dati attraverso il caricamento di un file dal sistema nazionale utilizzando un formato XML § La CA svolge quindi un ruolo di validatore delle informazioni registrate in EUDAMED 10 10

EUDAMED - Fase 2 La fase 2 del progetto prevede, lo sviluppo di nuove funzioni per agevolare la ricerca di dispositivi e le analisi statistiche. Sono inoltre in fase di discussione: § Integrazione delle istruzioni per l’uso (IFU) § Gestione di una unica lista di fabbricanti ed un’unica lista di DM, per evitare registrazioni ridondanti (identificazione); § Estensione ad altri gruppi di dispositivi (su misura e kit) per completare le informazioni rispetto ai DM commercializzati in EU; § Multilinguismo, a partire dalla traduzione del nomenclatore GMDN utilizzato del database; § Inserimento nel sistema non solo dei report delle CA, ma anche i report iniziale e finale del fabbricante; § Inserimento di dati in Eudamed da parte di altre categorie di utilizzatori potenziali: Organismi notificati, fabbricanti, ecc. § Diffusione delle informazioni di Eudamed al pubblico § Ulteriori informazioni per registrare un incidente; § Adozione di una nomenclatura comune per gli incidenti e/o una codifica dei dettagli dell’incidente 11 11

EUDAMED e la Direttiva 2007/47/UE Quali dati gestisce e gestirà EUDAMED entro settembre 2012 § (a) dati relativi alla registrazione di fabbricanti e dispositivi, ad esclusione dei dispositivi su misura § (b) dati relativi ai certificati rilasciati, modificati, revocati, sospesi o rifiutati; § (c) dati relativi alle procedure di vigilanza § (d) dati relativi alle indagini cliniche ed alle sperimentazioni 12 12

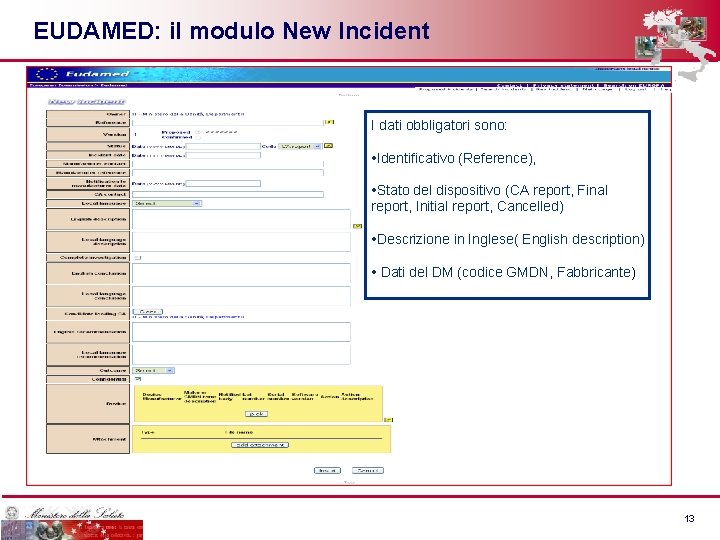
EUDAMED: il modulo New Incident I dati obbligatori sono: • Identificativo (Reference), • Stato del dispositivo (CA report, Final report, Initial report, Cancelled) • Descrizione in Inglese( English description) • Dati del DM (codice GMDN, Fabbricante) 13 13

EUDAMED: definizione di Incident § Incidents An incident is basically any adverse event that is reported about a device in accordance with the provisions of the directives. The MDD, AIMDD and IVDD define the term incident as follows: a) “Any malfunction or deterioration in the characteristics and/or performance of a device, as well as any inadequacy in the labelling or the instructions for use which might lead to or might have led to the death of a patient or user or to a serious deterioration in his state of health. ” b) “Any technical or medical reason resulting in withdrawal of a device from the market by the manufacturer. ” 14 14

Eudamed : gestione degli incidenti § A seconda del profilo utente è possibile: § § § Ricercare un incidente e visualizzarne i dettagli Proporre un nuovo incidente Confermare un incidente proposto Aggiornare un incidente proposto/confermato Cancellare un incidente proposto/confermato Modificare lo stato di un incidente confermato § Censisce solo i Global Competent Authority Report (GCAR) § I dati obbligatori sono: § § Identificativo (Reference), Stato del dispositivo (CA report, Final report, Initial report, Cancelled) Descrizione in Inglese( English description) Dati del DM (codice GMDN, Fabbricante) 15 15

Come sta procedendo il Md. S per alimentare correttamente EUDAMED? NEW L’acquisizione dei certificati CE è disgiunta dai DM: soluzione verso EUDAMED Numero certificato CE Data di scadenza Il numero di certificato rilasciato dall’ON La data di scadenza del certificato ON che ha rilasciato il certificato Il codice e la denominazione dell’ON Eventuali norme armonizzate Gli estremi delle norme armonizzate comunitarie e delle norme nazionali di recepimento eventualmente applicate Immagine del certificato il file allegato contenente l’immagine del certificato A breve il coinvolgimento degli stessi ON per la comunicazione delle revoche e sospensioni, oltre che dei rinnovi di certificati CE 16 16

Eudamed e Repertorio DM: Validazione dei dati da parte della CA La Fase 1 di EUDAMED prevede l’inserimento dei dati dei DM da parte della CA In lavorazione Consolidato Firmato Pubblicato Repertorio dei DM Il processo che porta alla pubblicazione di un dispositivo nel Repertorio è tecnicamente gestito da un motore di workflow che rende automatici i passaggi di stato di una notifica, consentendo le segnalazioni dal backoffice 17 17

La fotografia* dei dispositivi presenti nella Banca Dati e nel RDM q Utenti del sistema: 872 per oltre 1. 350 aziende q Dispositivi in lavorazione: oltre 8. 000 q Dispositivi firmati digitalmente: oltre 2100 q Dispositivi pubblicati in banca dati: oltre 4400 q Dispositivi pubblicati nel RDM: oltre 4250 * Situazione al 13 giugno 2008 18 18

Grazie per l’attenzione 19 19
 Sperimentazione clinica dispositivi medici
Sperimentazione clinica dispositivi medici Classificazione nazionale dei dispositivi medici
Classificazione nazionale dei dispositivi medici Classificazione cnd dispositivi medici
Classificazione cnd dispositivi medici Feedback periferico di james
Feedback periferico di james Prospettive didattiche/lisa
Prospettive didattiche/lisa Ibridazioni
Ibridazioni Nuove tendenze del turismo
Nuove tendenze del turismo Dispositivi a semiconduttore
Dispositivi a semiconduttore Vite prigioniera disegno
Vite prigioniera disegno Dispositivi di protezione individuale in inglese
Dispositivi di protezione individuale in inglese Dispositivi di memorizzazione
Dispositivi di memorizzazione Dispositivi optoelettronici
Dispositivi optoelettronici Impatto
Impatto Tesina sulle nuove tecnologie
Tesina sulle nuove tecnologie Ente per le nuove tecnologie
Ente per le nuove tecnologie Ente per le nuove tecnologie
Ente per le nuove tecnologie Le nuove teorie di legame zanichelli
Le nuove teorie di legame zanichelli Linee guida blsd
Linee guida blsd Eugenio montale satura
Eugenio montale satura Vecchie e nuove dipendenze
Vecchie e nuove dipendenze Nuove risorse digitali e loro impatto sulla didattica
Nuove risorse digitali e loro impatto sulla didattica