Clculos qumicos e de frmulas Massa atmica do




























- Slides: 29

Cálculos químicos e de fórmulas


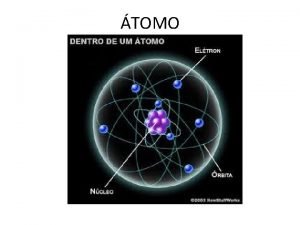
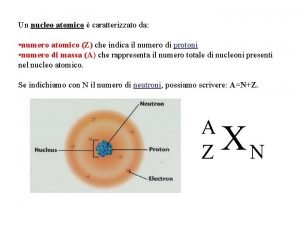
Massa atômica do elemento(M) É um n° que indica quantas vezes a massa de um átomo é >ou< que 1/12 avos da massa do 12 C.

Sua unidade é expressa em u. m. a (u) (unidade de massa atômica)

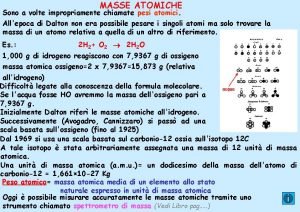
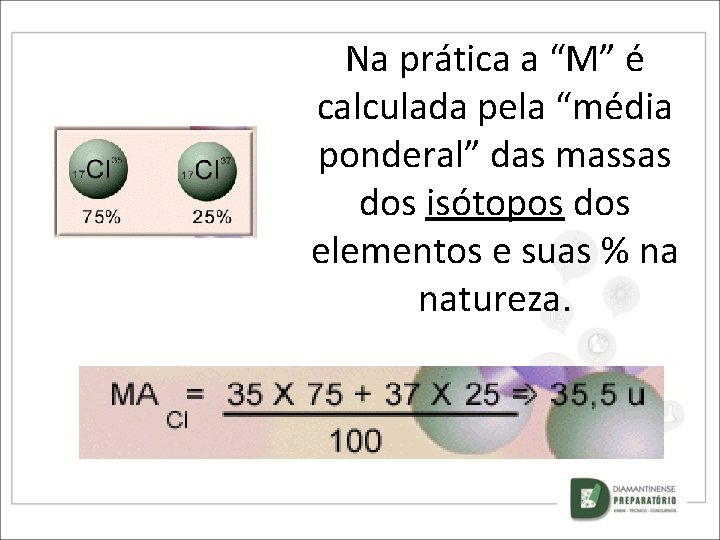
Mas a maioria dos elemento possui vários isótopos. A massa de qual deles é apresentada na tabela periódica? ? ?

Na prática a “M” é calculada pela “média ponderal” das massas dos isótopos dos elementos e suas % na natureza.

Massa molecular(MM) O conceito é semelhante a”M”, porém é aplicada a soma das massas atômicas dos átomos que formam a molécula. Portanto, o “H” tem M=1 u “O” tem M=16 u E a “H 2 O” tem MM=18 u

Massa molecular (MM) soma da massa dos átomos de uma molécula (união de ametal + ametal ou“H”). H 2 O = 18 uma Massa fórmula (MF) soma das massas dos átomos de um íon fórmula (união de metal e ametal) Na. Cl = 58 uma

Cuidado com a MM dos sais hidratados. . . Cu. SO 4. 5 H 2 O Isso não é uma multiplicação; apesar de parecer. . .

A título de curiosidade: 1 uma = 1, 66. 10 -30 g


Avogadro percebeu que a massa atômica de cada elemento (em gramas) continha um n° fixo de moléculas. Este n° foi chamado de constante de Avogadro , e é = a: 6. 10²³

Atenção , esse n° não pode ser esquecido 6. 10²³

Constante da Avogadro – é a dúzia da química, só que ao invés de ser = a 12, é = a 6, 02. 1023 unidades da matéria a ser quantificada(átomos, moléculas. . . ). O valor 6, 02. 1023 foi batizado pelos químicos como “Mol”. Portanto, 6, 02. 1023 = 1 mol

Existe uma fórmula que relaciona: Massa atômica (M) , n° de mols (n) e massas em gramas (m). n = m / M Obs: N° de mols é sinônimo de quantidade de matéria


Determinação de fórmulas Identifica-se um composto pelo seu nome ou pela sua fórmula , que é constituída pelos elementos que a compõem e suas quantidades H 2 SO 4 (o ácido sulfúrico é formado por 2 átomos de “H”, 1 de “S” e 4 de “O”). Esse tipo de fórmula é chamado de fórmula molecular (FM)(ou bruta).

Outro tipo de representação dos compostos é a fórmula mínima que é obtida dividindo-se a FM pelo MDC dos índices da molécula obtendo-se os < nos inteiros dos elementos que compõem a subst. Ex: A glicose C 6 H 12 O 6(FM). P/ calcularmos a f. mínima basta dividirmos C 6 H 12 O 6/6 = CH 2 O

(A partir da “FM” H 2 SO 4 e M 98 g/mol) 98 g 100% 2 g. H X% 32 g. S Y% 64 g. O Z% X=2, 04%, Y=32, 65%, Z=65, 30% F% = H 2, 04%S 32, 65%O 65, 30%

(A partir da fórmula %) H 2, 04%S 32, 65%O 65, 30% Divide-se a % de cada elemento / M; • Divide-se cada um dos valores encontrados pelo menor deles; • Descreve-se a fórmula mínima.

a) A partir da fórmula mínima Por definição , fórmula molecular = (fórmula mínima)n • Sabendo-se a “M” , multiplica-se a fórmula mínima por valores inteiros pequenos , até o valor de “M”.

b) A partir da fórmula centesimal Tendo um composto , 2, 04% de H , 32, 65% de S e 65, 3% de O. 100%H 2 SO 4 98 g 2, 04%H X. 1 32, 65%S Y. 32 65, 3%O Z. 16 X=2 , Y=1 , Z=4

Lanterna dos reprovados Através do numero de Avogadro. 1 Mol de moléculas eu vou poder calcular. Dividindo a massa , pela massa atômica. Número de Moles é baba de calcular. Relação de Moles e a massa atômica. E o Avogadro eu vou mostrar pra vocês. Se um Mol de átomos nós contarmos todos. No final eu acho 6. 10 ²³. Já chegou a prova , tá desesperado. A pressão é tanta , vê se não vai defecar.


Fenômeno Químico-altera matéria (alteração de temp. , cor, cheiro) , sinônimo de “Reação Química”. Reagentes Produtos (equação) 2 H 2(g)+O 2(g) 2 H 2 O(l) Fenômenos Físicos não alteram a matéria. (Mudanças de estados físicos. )

1. Lei das proporções constantes P/as substâncias Uma subst. apresenta seus elementos combinados em proporção (em massa) constante. 18 g de H 2 O possui: 2 g de H , p/ 16 g de O 36 g 4 g p/ 32 g 180 g 20 g p/ 160 g

P/ as reações Numa reação, as massas dos reag. e prod. obedecem sempre uma proporção constante 2 H 2 + O 2 2 H 2 O 4 g + 32 g 36 g 8 g + 64 g 72 g 20 g + 320 g 180 g

2. Lei da Conservação das massas Na reação a massa de reag. é igual a massa de produtos (sistema fechado). 2 H 2 + O 2 2 H 2 O 4 g + 32 g 36 g

Resumão p/ não errar na hora “H” • 1 molécula de H 2 O “pesa” 18 u; • 1 mol de moléculas de H 2 O (6, 02. 1023 ) pesam 18 gramas; É importantíssimo saber a relacão 1 mol de H 2 O = 6, 02. 1023 moléculas de H 2 O e“pesa” 18 g.
 Clculos
Clculos Clculos
Clculos Atmica
Atmica Atmica
Atmica Masa atomica absoluta
Masa atomica absoluta Atmica
Atmica Comisin
Comisin Relacion molar
Relacion molar Atmica
Atmica Atmica
Atmica Joseph thomson
Joseph thomson Las partículas fundamentales del átomo son
Las partículas fundamentales del átomo son Concentrazione percentuale massa su massa
Concentrazione percentuale massa su massa Ligação ionica
Ligação ionica Numero atomico
Numero atomico Ixotimico
Ixotimico Unidade de medida u
Unidade de medida u La mole schema
La mole schema Rapporto massa grassa massa magra
Rapporto massa grassa massa magra Come si calcola massa molecolare
Come si calcola massa molecolare Contoh soal pusat massa lamina
Contoh soal pusat massa lamina Rapporto massa grassa massa magra
Rapporto massa grassa massa magra K equilibrio
K equilibrio Transferência de calor
Transferência de calor Pressão hidrostática
Pressão hidrostática Massa unitaria
Massa unitaria Konsep gubahan massa
Konsep gubahan massa Pada pengaratan 5 milyar atom besi
Pada pengaratan 5 milyar atom besi Deconvoluzione spettro di massa
Deconvoluzione spettro di massa Momento linear fórmula
Momento linear fórmula