CALORIMETRIA Prof Rangel M Nunes Maio de 2019













- Slides: 22

CALORIMETRIA Prof. Rangel M. Nunes Maio de 2019

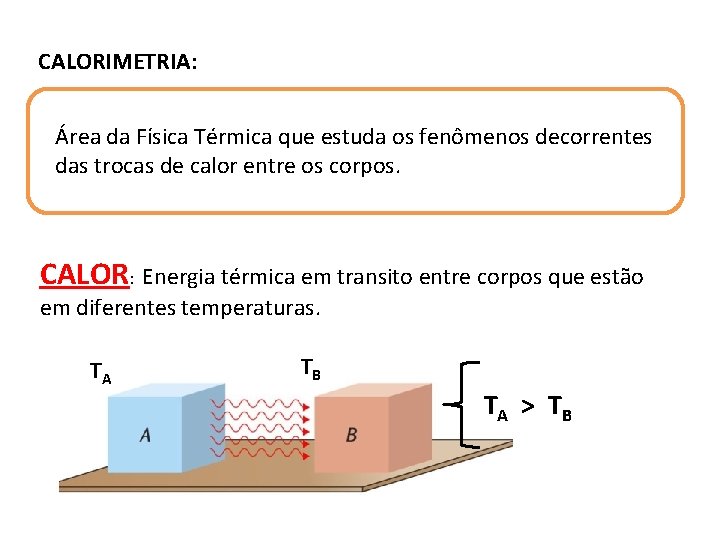
CALORIMETRIA: Área da Física Térmica que estuda os fenômenos decorrentes das trocas de calor entre os corpos. CALOR: Energia térmica em transito entre corpos que estão em diferentes temperaturas. TA TB TA > T B

A QUANTIDADE DE CALOR (Q). Q: Medida do calor cedido ou absorvido por um corpo. Se Q é negativo (-Q) o corpo perde calor e sua temperatura DIMINUI. Se Q é positivo (+Q) o corpo recebe calor e sua temperatura AUMENTA. +Q -Q

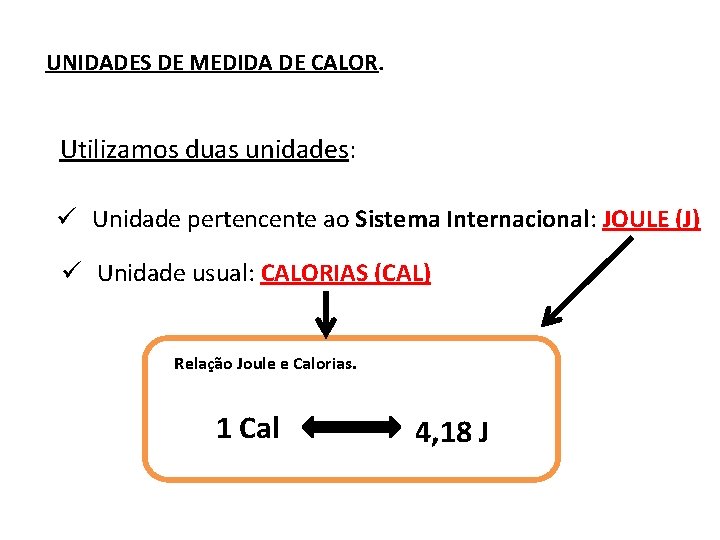
UNIDADES DE MEDIDA DE CALOR. Utilizamos duas unidades: ü Unidade pertencente ao Sistema Internacional: JOULE (J) ü Unidade usual: CALORIAS (CAL) Relação Joule e Calorias. 1 Cal 4, 18 J

CALOR ESPECÍFICO ( c ) Quantidade de calor absorvido por unidade de massa, para que a temperatura se eleve em uma unidade. [ c ] = cal/(g. °C) [ c ] = J/(kg. k) Depende da substância e do estado físico da substância. Hidrogênio: 3, 0 cal/(g. °C)

DETERNIBAÇÃO DA QUANTIDADE DE CALOR. Determinamos a quantidade de calor pela equação: C : calor específico; Q = m. c. (T – T 0) m: massa do material que recebe ou abrorve calor T – T 0 = ∆T : diferença de Temperatura. As unidades de m e T : Dependem da unidade do calor específico

CAPACIDADE TÉRMICA. Capacidade de uma substância de absorver calor por unidade de Temperatura.

APLICAÇÕES (Placas de Aquecimento Solar).

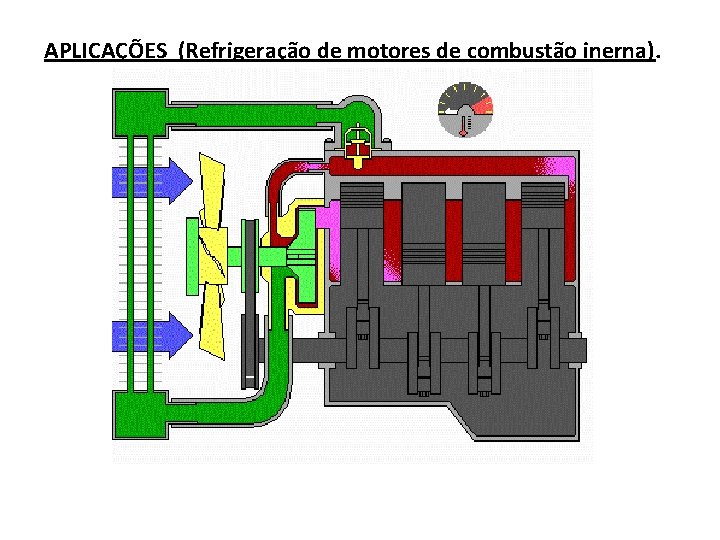
APLICAÇÕES (Refrigeração de motores de combustão inerna).

REFRIGERAÇÃO GASOSA A HIDROGÊNIO.

CALOR SENSÍVEL. Q = m. c. (T – T 0) Determine a quantidade de calor que uma fonte térmica deve fornecer a 200 g de água para que sua temperatura se eleve de 25°C para 80°C. Considere c. H 20 = 1, 0 cal / (g °C).

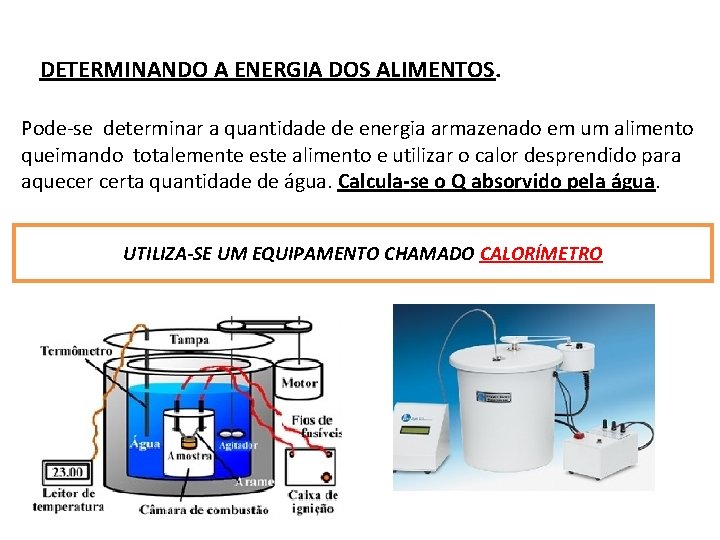
DETERMINANDO A ENERGIA DOS ALIMENTOS. Pode-se determinar a quantidade de energia armazenado em um alimento queimando totalemente este alimento e utilizar o calor desprendido para aquecer certa quantidade de água. Calcula-se o Q absorvido pela água. UTILIZA-SE UM EQUIPAMENTO CHAMADO CALORÍMETRO

Uma amostra de 20 g de um alimento é queimado completamente no interior de um calorímetro que contem 200 g de água. A água é aquecida de 20°C para 80°C. Sendo c. H 20 = 1, 0 cal/g. °C. Determine a quantidade aproximada de energia contida no alimento.

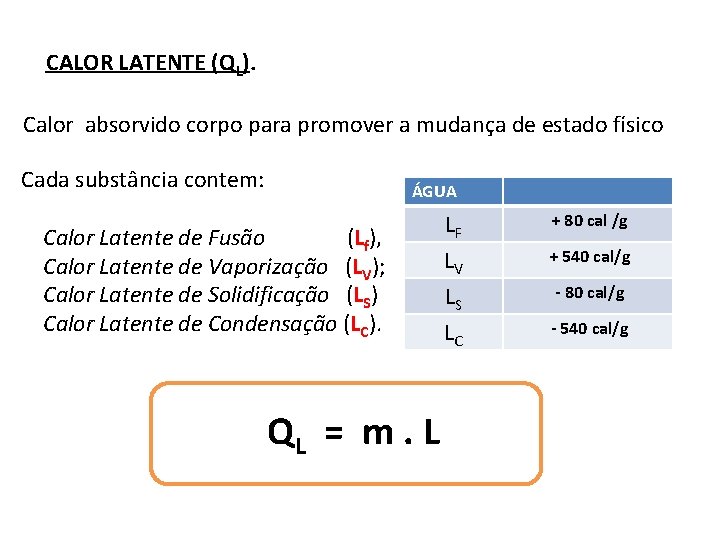
CALOR LATENTE (QL). Calor absorvido corpo para promover a mudança de estado físico Cada substância contem: ÁGUA Calor Latente de Fusão (Lf), Calor Latente de Vaporização (LV); Calor Latente de Solidificação (LS) Calor Latente de Condensação (LC). QL = m. L LF + 80 cal /g LV LS LC + 540 cal/g - 80 cal/g - 540 cal/g

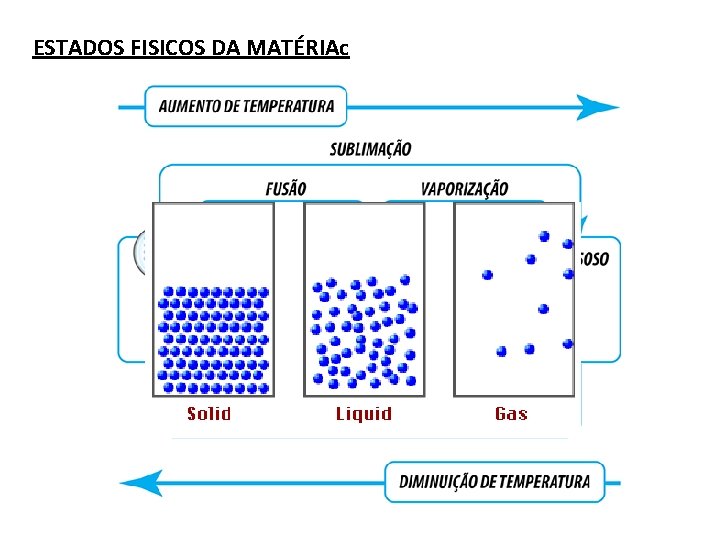
ESTADOS FISICOS DA MATÉRIAc

VAPOR DE ÁGUA E GÁS Vapor: Gás: Quando uma substancia esta em estado de vapor, pode-se liquefaze-la apenas aumentando a pressão oudiminuindoa temperatura. Deve-se aumentar a pressão e diminuir a temperatura Sumultaneamente. A água sera considerada gas com Temperatura acima de 374°C (Temperatura crítica) Com isso, podemos dizer que todo vapor é um gás, mas nem todo gás é um vapor.


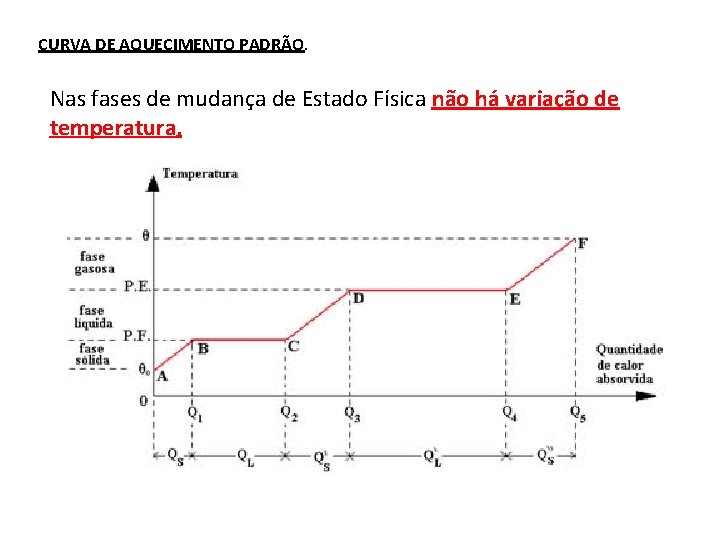
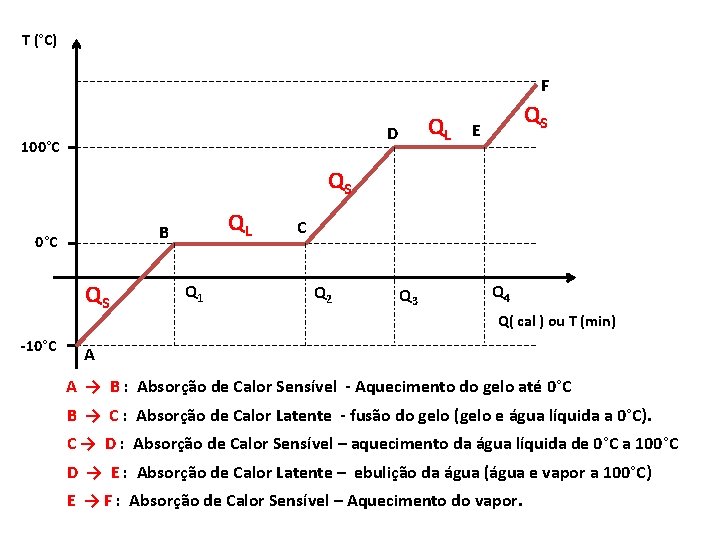
CURVA DE AQUECIMENTO PADRÃO. Nas fases de mudança de Estado Física não há variação de temperatura.

T (°C) F QL D 100°C QS E QS 0°C QS -10°C QL B Q 1 C Q 2 Q 3 Q 4 Q( cal ) ou T (min) A A → B : Absorção de Calor Sensível - Aquecimento do gelo até 0°C B → C : Absorção de Calor Latente - fusão do gelo (gelo e água líquida a 0°C). C → D : Absorção de Calor Sensível – aquecimento da água líquida de 0°C a 100°C D → E : Absorção de Calor Latente – ebulição da água (água e vapor a 100°C) E → F : Absorção de Calor Sensível – Aquecimento do vapor.

Determine a quantidade de calor que uma fonte térmica deve fornecer a uma massa de gelo de 200 g a -5°C para obter vapor a 120°C. Suponha que não ha perda de massa durante o processo.

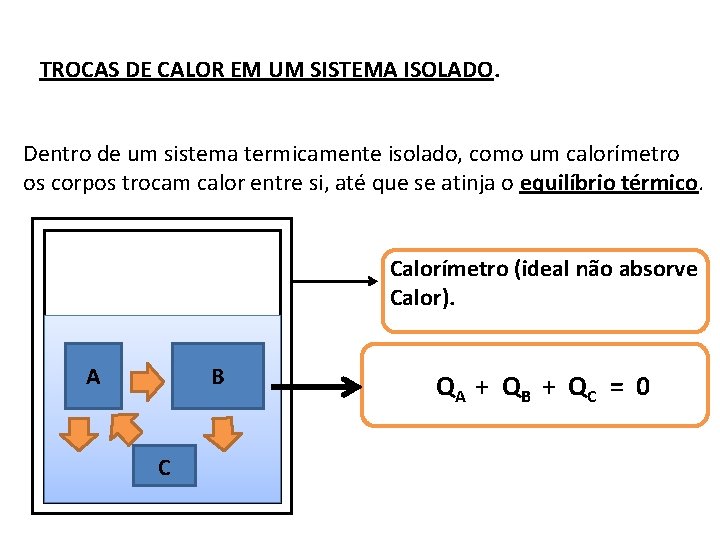
TROCAS DE CALOR EM UM SISTEMA ISOLADO. Dentro de um sistema termicamente isolado, como um calorímetro os corpos trocam calor entre si, até que se atinja o equilíbrio térmico. Calorímetro (ideal não absorve Calor). A B C QA + Q B + Q C = 0

Um bloco de ferro a 500°C é colocado dentro de um calorímetro ideal com 400 ml de água a 10°C. Determine a temperatura final do sistema. Considere c. Fe = 0, 11 cal/g. °C.
 Pgqp como funciona
Pgqp como funciona Karoline almeida rangel
Karoline almeida rangel Abdon rangel
Abdon rangel Mario gabriel rangel vargas
Mario gabriel rangel vargas Nucleo universitario rafael rangel
Nucleo universitario rafael rangel Elisa aline nunes
Elisa aline nunes Filomena nunes
Filomena nunes Joni nunes
Joni nunes Onfalocele
Onfalocele Pessoas essenciais
Pessoas essenciais Plnio
Plnio Squeaks pneumologie
Squeaks pneumologie Cego do maio escola
Cego do maio escola David de maio
David de maio Lei do cosseno
Lei do cosseno Tommasa maio
Tommasa maio Maio vaniko
Maio vaniko Knoodl
Knoodl Deepak sharan recoup
Deepak sharan recoup Frank di maio
Frank di maio Alessia di maio
Alessia di maio Desenho sobre abuso infantil
Desenho sobre abuso infantil Emily maio
Emily maio