AZ ATOM Atom atommag elektronfelh proton neutron elektron

























- Slides: 46

AZ ATOM Atom: atommag + elektronfelhő = proton, neutron, elektron Elemi részecskék

Atomok Dalton elmélete (1805): John DALTON 1766 - 1844 1. Az elemek apró részecskékből, atomokból állnak. Atom: görög szó = „nem osztható”. 2. Egy elem valamennyi atomja azonos. 3. A különböző elemek atomjainak eltérő tömegük van (megkülönböztethetőek). 4. A különböző elemek atomjai kombinálódhatnak; egy vegyület több, mint egy elem atomjainak speciális kombinációja. 5. Egy kémiai reakcióban az atomok nem keletkeznek, nem pusztulnak el és nem osztódnak kisebb részekre, hanem partnert cserélnek új anyagot létrehozva.

Elektronok Katódsugárzás töltött részecskékből áll, melyek az elektród atomjaiból jönnek. => Az atomok oszthatók !!!!! Thomson-féle atommodell Joseph John THOMSON 1856 - 1940 ● ● ●

Katódsugárcső Rés Katódsugár Foszforeszkáló háttér

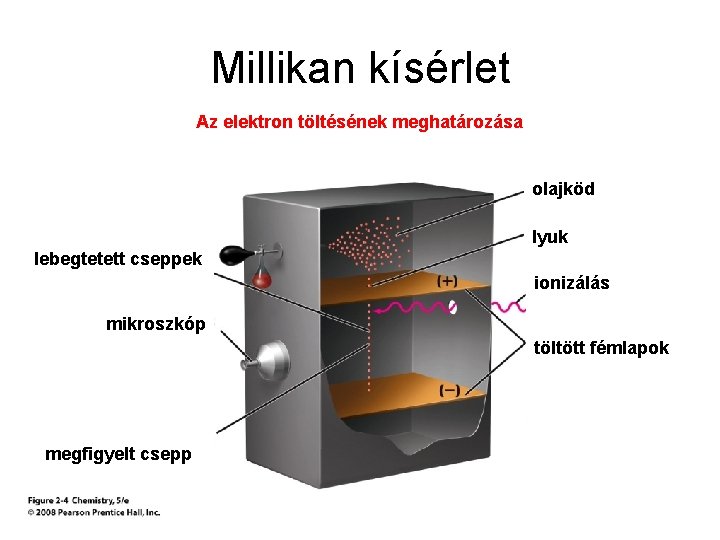
Millikan kísérlet Az elektron töltésének meghatározása olajköd lyuk lebegtetett cseppek ionizálás mikroszkóp töltött fémlapok megfigyelt csepp

Atommag atommag ● ● elektron Ernest RUTHERFORD 1871 - 1937

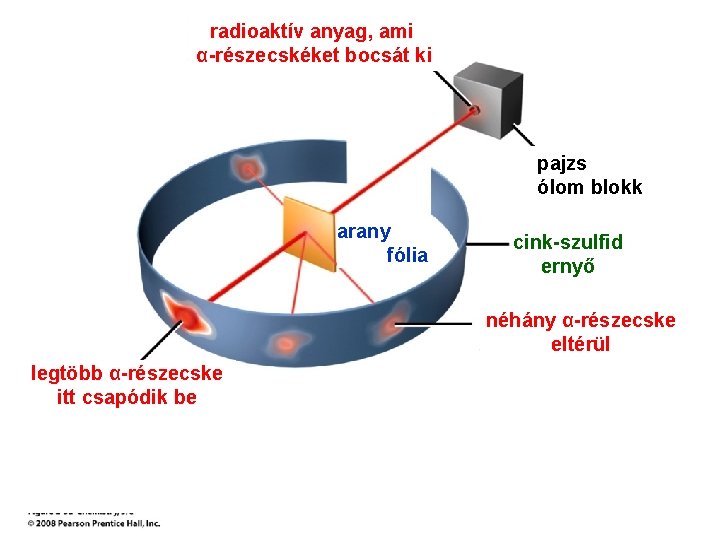
radioaktív anyag, ami α-részecskéket bocsát ki pajzs ólom blokk arany fólia cink-szulfid ernyő néhány α-részecske eltérül legtöbb α-részecske itt csapódik be

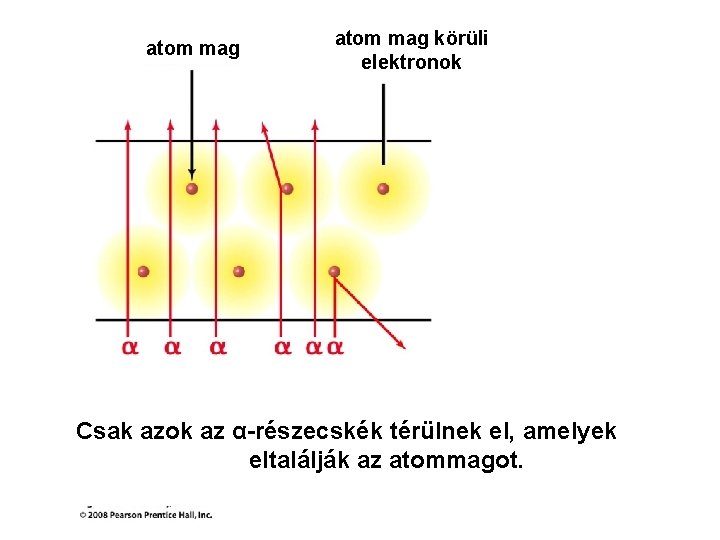
atom mag körüli elektronok Csak azok az α-részecskék térülnek el, amelyek eltalálják az atommagot.


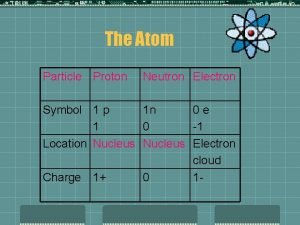
Elemi részecskék tulajdonságai ----------------------------------részecske jelölés töltés* tömeg (g) ----------------------------------Elektron e-1 9, 109∙ 10 -28 Proton p +1 1, 673∙ 10 -24 Neutron n 0 1, 675∙ 10 -24 ----------------------------------* a töltés a következő szám többszöröseként van megadva: 1, 60∙ 10 -19 C

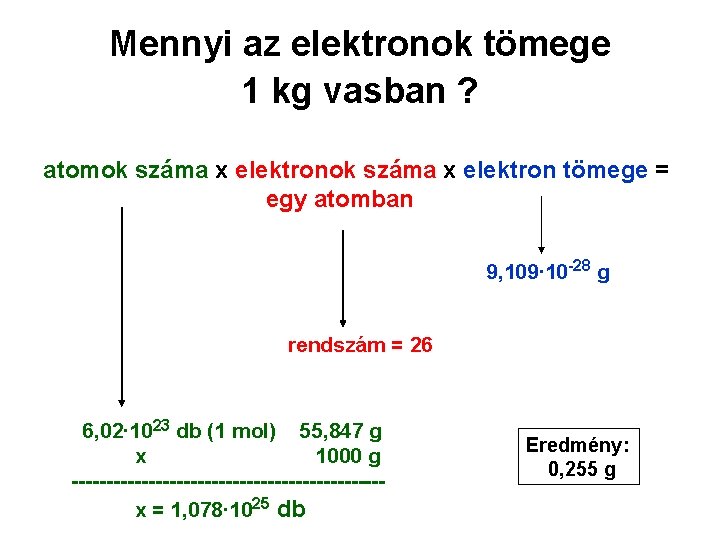
Mennyi az elektronok tömege 1 kg vasban ? atomok száma x elektron tömege = egy atomban 9, 109∙ 10 -28 g rendszám = 26 6, 02∙ 1023 db (1 mol) 55, 847 g x 1000 g ----------------------x = 1, 078∙ 1025 db Eredmény: 0, 255 g

Atom: atommag + elektronok atommag: protonok + neutronok Atomszerkezet: az elektronok elrendeződése az atommag körül megértése alapvetően fontos az: --- atomok tulajdonságainak megértéséhez, --- a belőlük képződő vegyületek megértéséhez, --- a reakcióik értelmezéséhez.

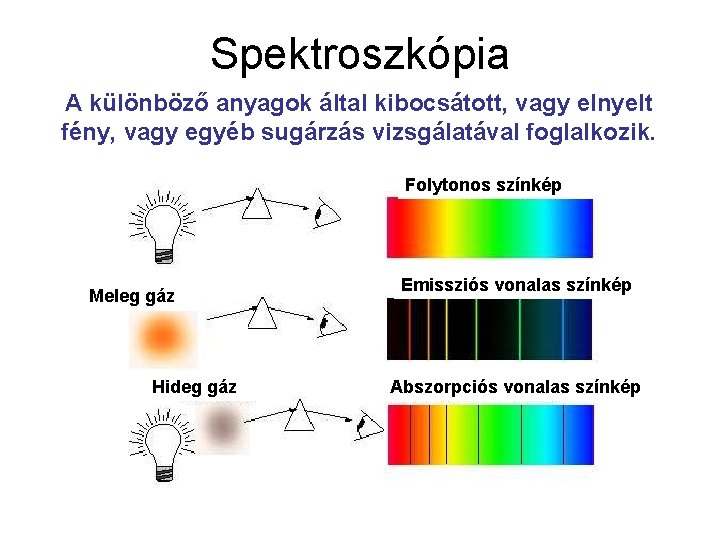
Spektroszkópia A különböző anyagok által kibocsátott, vagy elnyelt fény, vagy egyéb sugárzás vizsgálatával foglalkozik. Folytonos színkép Meleg gáz Hideg gáz Emissziós vonalas színkép Abszorpciós vonalas színkép

Newton kísérletei fehér fénnyel Sir Isaac Newton (1642– 1727)

A hidrogén színképe Gázt melegítve, vagy elektromos kisülés: vonalas spektrum A hidrogén látható spektruma a Balmer-féle sorozatban: Joseph Balmer, 1885 A fotonok frekvenciája leírható a köv. sorozattal: ν ~ 1/4 – 1/n 2 ahol n= 3, 4, 5, …. . Gerjesztett hidrogénlámpa és az általa kibocsájtott fény három látható összetevője.

A hidrogén színképe A teljes spektrum leírása (IR, látható, UV) Johannes Rydberg ν = R∙(1/k 2 – 1/n 2) IR R= 3, 29∙ 1015 Hz látható UV n= k+1, k+2, k+3, …. k= 1 Lyman k= 2 Balmer k= 3 Paschen k= 4 Bracket k= 5 Pfund sorozat Foton energiája: E= hν h= 6, 63∙ 10 -34 J/Hz

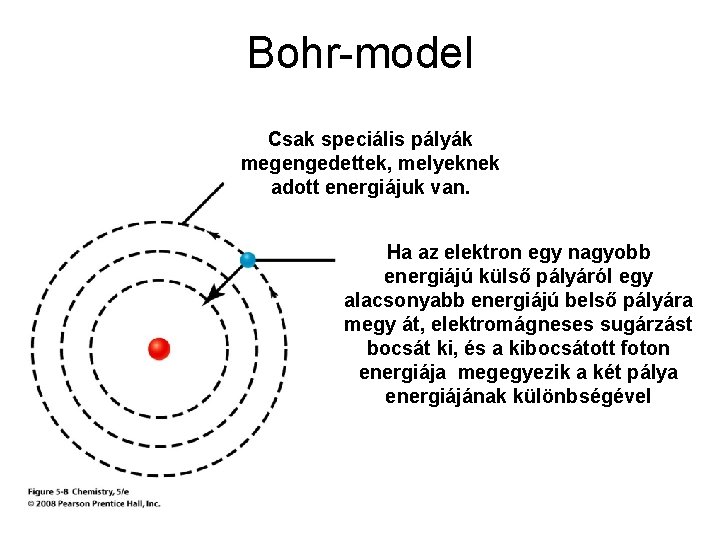
Bohr atommodell Niels Bohr: E = −h∙R/n 2 1. A hidrogénatom egy pozitív töltésű részecskéből és egy elektronból áll, az elektron r sugarú pályán kering energiaveszteség nélkül 2. Az elektron nem keringhet tetszőleges sugarú pályán. 3. Az adott sugarú pályán keringő elektron meghatározott energiával rendelkezik. 4. A két pálya közötti elektronátmenet egy, a pályák energiájának különbségével megegyező energiájú foton elnyelésével, vagy kibocsájtásával jár. Ei → Ej E = − h. R/ni 2 − (− h. R/nj 2)= h. R(1/nj 2 − 1/ni 2) = hn

Bohr-model Csak pályák of the hydrogen Niels Bohr proposed in speciális 1914 a model megengedettek, melyeknek atom as a nucleus with an electron circling around it. adott energiájuk van. In this model, the energy levels of the orbits are az elektron quantized so that only certain Ha specific orbitsegy nagyobb energiájú külsőfor pályáról corresponding to certain specific energies the egy alacsonyabb energiájú belső pályára electron are available. megy át, elektromágneses sugárzást bocsát ki, és a kibocsátott foton energiája megegyezik a két pálya energiájának különbségével

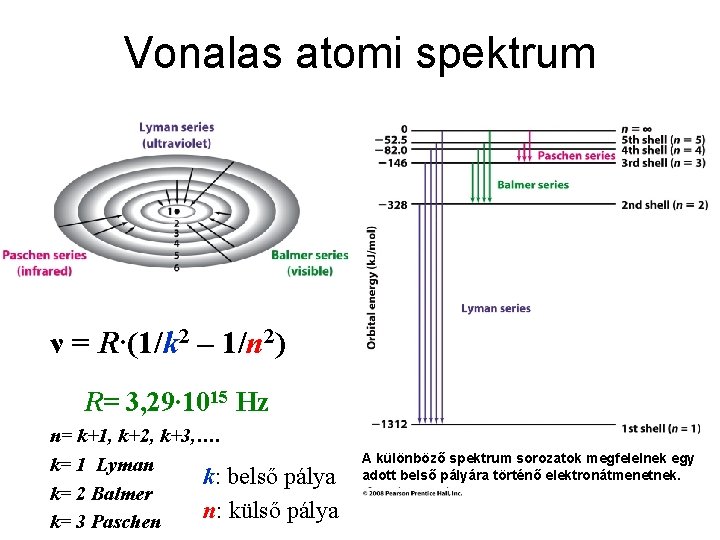
Vonalas atomi spektrum ν = R∙(1/k 2 – 1/n 2) R= 3, 29∙ 1015 Hz n= k+1, k+2, k+3, …. k= 1 Lyman k: belső pálya k= 2 Balmer n: külső pálya k= 3 Paschen A különböző spektrum sorozatok megfelelnek egy adott belső pályára történő elektronátmenetnek.

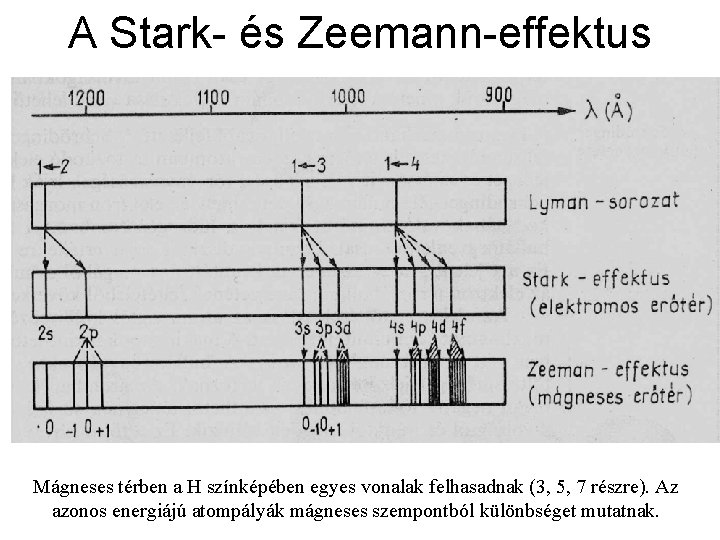
A Stark- és Zeemann-effektus Mágneses térben a H színképében egyes vonalak felhasadnak (3, 5, 7 részre). Az azonos energiájú atompályák mágneses szempontból különbséget mutatnak.

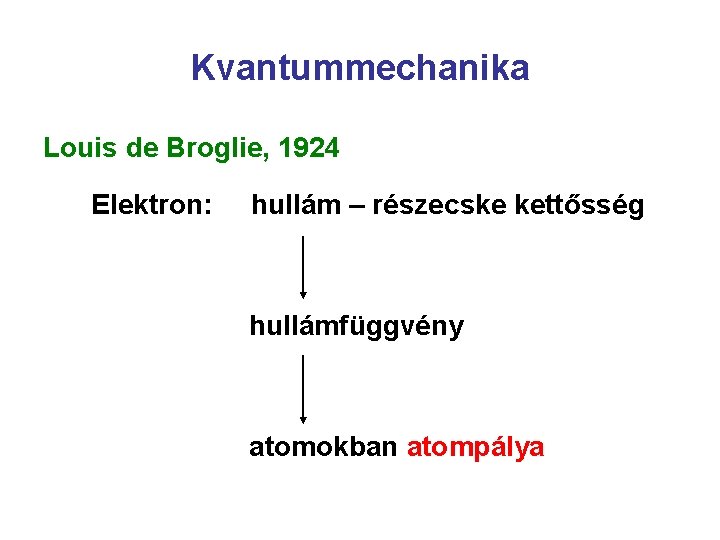
Kvantummechanika Louis de Broglie, 1924 Elektron: hullám – részecske kettősség hullámfüggvény atomokban atompálya

Kvantummechanika Erwin Schrödinger, 1926 1. Az atom energiája kvantált 2. Atompályák három számmal jellemezhetőek (kvantumszámok) 1. Fő 2. Mellék 3. Mágneses

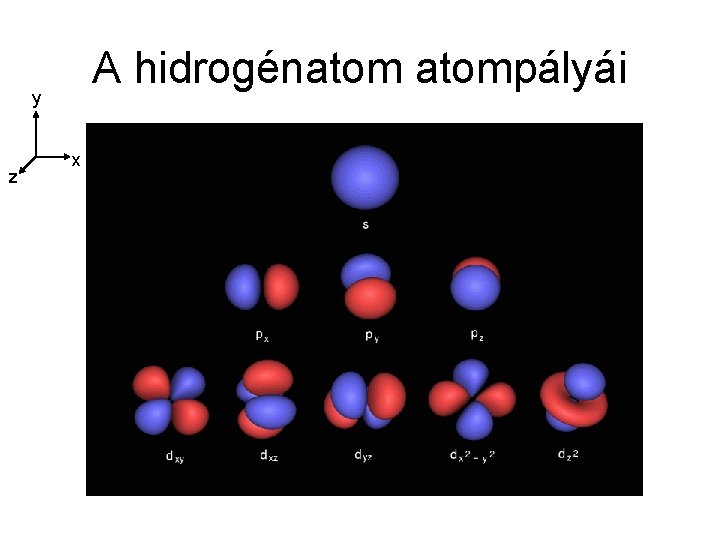
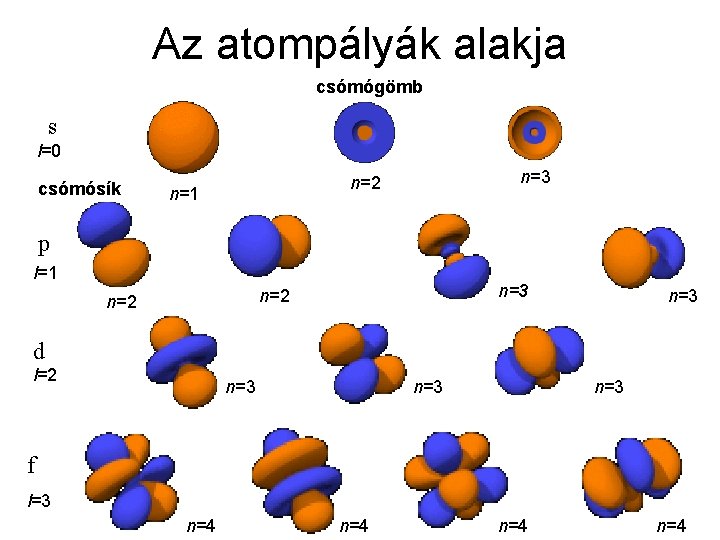
Az atomok elektronszerkezete Atompálya: olyan térrész, ahol az elektron nagy (90%-os) valószínűséggel megtalálható. (n, l, m) Főkvantumszám: n n = 1, 2, 3, 4… K, L, M, N - HÉJAK Méret és elektronenergia elsősorban n-től függ. Mellékkvantumszám: l l = 0, 1 , …, n− 1 Az atompálya „alakja” (és energiája) l-től függ. s, p, d, f, g - ALHÉJAK Mágneses kvantumszám: m m= −l, −l+1, …, 0, …, l− 1, l Az atompálya „irányát” határozza meg, azonos energiájú pályák.

Kvantumszámok n=1 l=0 m=0 s alhéj K (elektron)héj n=2 l=0 m=– 1 m=0 m=+1 s alhéj L (elektron)héj m=0 m=– 1 m=0 m=+1 m=– 2 m=– 1 m=0 m=+1 m=+2 s alhéj l=1 n=3 l=0 l=1 l=2 p alhéj d alhéj L (elektron)héj

A hidrogénatompályái y z x

Az atompályák alakja csómógömb s l=0 csómósík n=3 n=2 n=1 p l=1 n=3 n=2 n=3 d l=2 n=3 n=3 f l=3 n=4 n=4

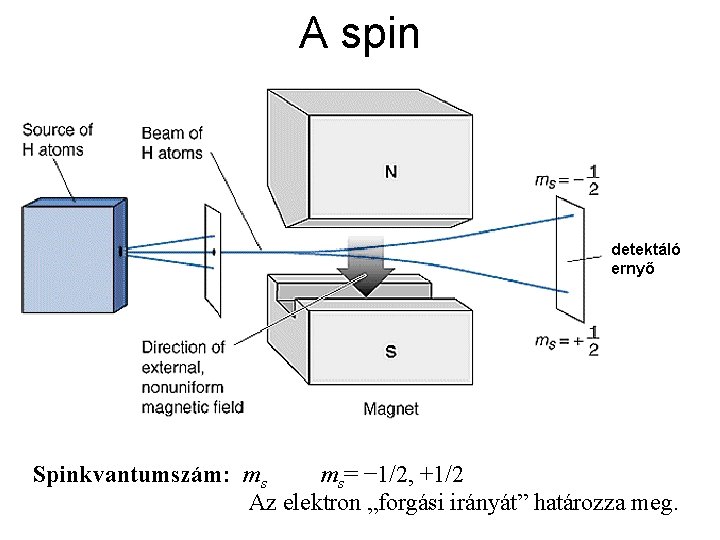
A spin detektáló ernyő Spinkvantumszám: ms ms= − 1/2, +1/2 Az elektron „forgási irányát” határozza meg.

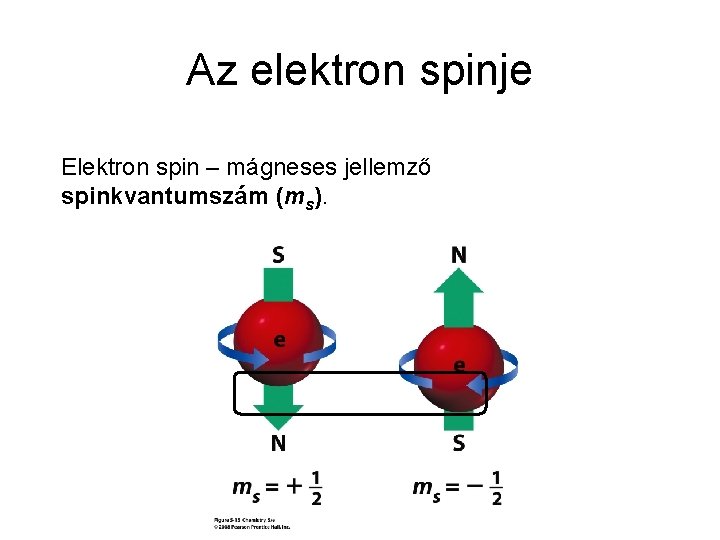
Az elektron spinje Elektron spin – mágneses jellemző spinkvantumszám (ms).

Az elektronburok szerkezete Az alhéjak a H-atomban: Az alhéjak többelektronos atomokban: E

Az elektronburok felépülése • Az energiaminimumra törekvés elve (felépülési elv): Az elektronok a legalacsonyabb energiájú pályákat foglalják el. • Pauli-elv: Egy atomon belül nem lehet két olyan elektron, amelynek minden kvantumszáma megegyezik. n. héj, n 2 pálya, max. 2 n 2 elektron – Egy pályán maximum két elektron helyezkedhet el ellentétes spínnel. • Hund-szabály: Azonos energiájú szintek közül a különböző mágneses kvantumszámúak („térbelileg különbözőek”) töltődnek be először (Így vannak az elektronok a legmesszebb egymástól) azonos spinnel (maximális multiplicitás). Paramágnes Diamágnes

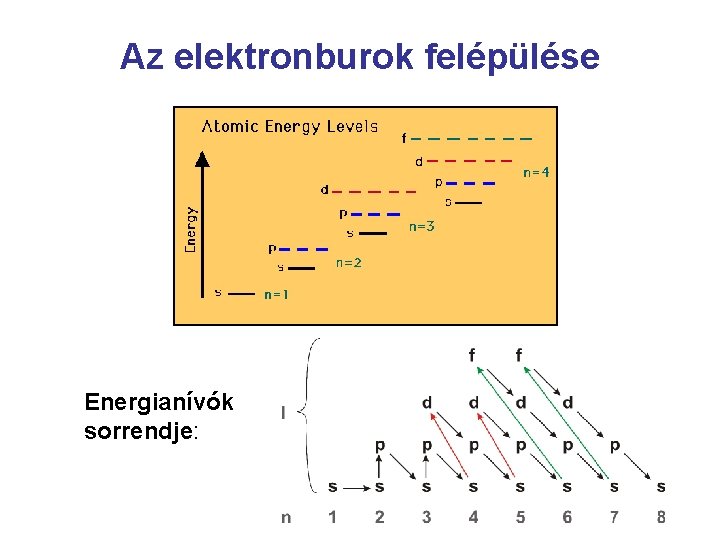
Az elektronburok felépülése Energianívók sorrendje:

Az elektronburok felépülése • Vegyérték héj --- vegyérték elektronok • Atom-törzs

Az elektronburok szerkezete • Elektronkonfiguráció: Az elektronkonfiguráció leírja, hogy az elektronok miképpen oszlanak el a héjakon, alhéjakon, pályákon és mekkora a spinkvantumszámuk. Jelölésük például: 1 s 1, 1 s 22 p 3, …

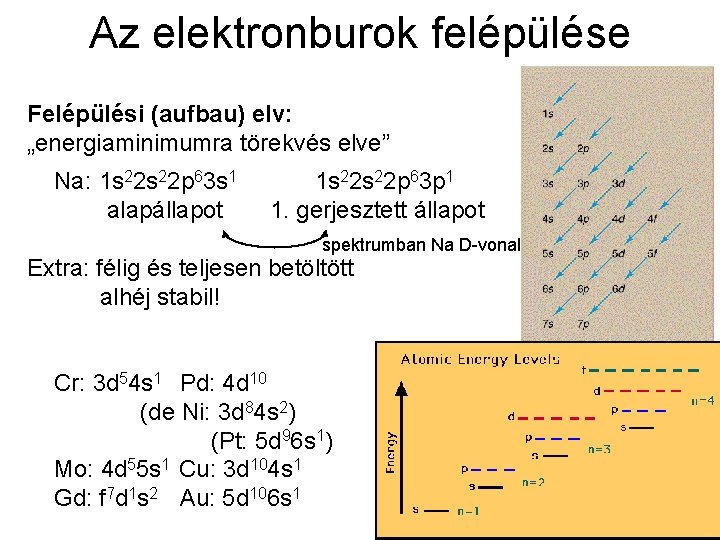
Az elektronburok felépülése Felépülési (aufbau) elv: „energiaminimumra törekvés elve” Na: 1 s 22 p 63 s 1 alapállapot 1 s 22 p 63 p 1 1. gerjesztett állapot spektrumban Na D-vonal Extra: félig és teljesen betöltött alhéj stabil! Cr: 3 d 54 s 1 Pd: 4 d 10 (de Ni: 3 d 84 s 2) (Pt: 5 d 96 s 1) Mo: 4 d 55 s 1 Cu: 3 d 104 s 1 Gd: f 7 d 1 s 2 Au: 5 d 106 s 1

A periódusos rendszer periódusok és oszlopok/csoportok eka Al, eka Si 1872. 66 ismert elem alapján atomtömeg szerint Cu Zn __ __ As Se Br Mengyelejev Ga M (g/mol) 63 65 68 72 79 78 80 68 69, 9 1914. Henry G. Moseley rendszám szerint! Ea 2 O 3 5, 9 alacsony magas Ga 2 O 3 r 5, 91 g/cm 3 o. p. 30, 1 C f. p. 1983 C Felosztás: s, p, d, f – mező lantanidák és aktinidák


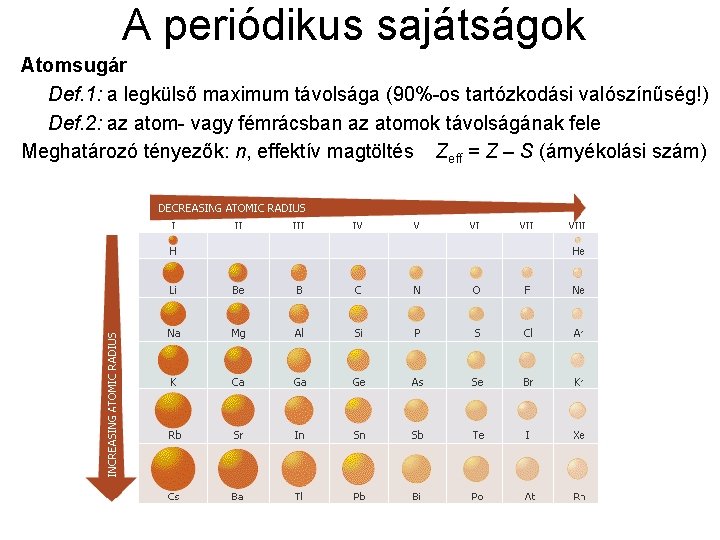
A periódikus sajátságok Atomsugár Def. 1: a legkülső maximum távolsága (90%-os tartózkodási valószínűség!) Def. 2: az atom- vagy fémrácsban az atomok távolságának fele Meghatározó tényezők: n, effektív magtöltés Zeff = Z – S (árnyékolási szám)

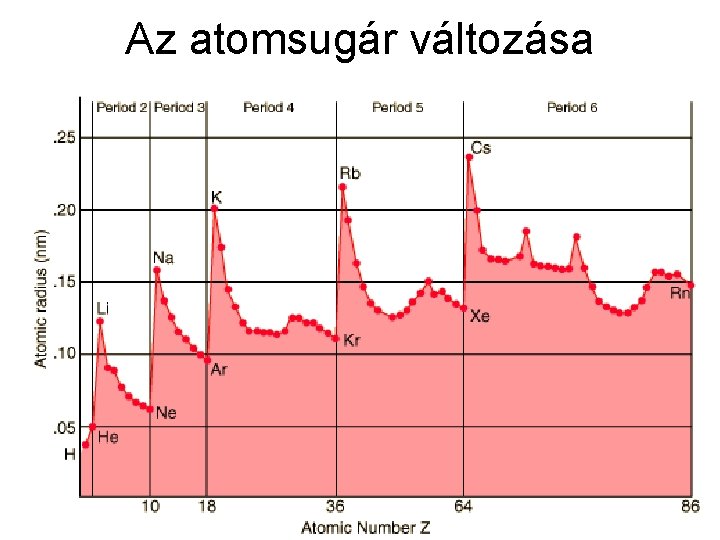
Az atomsugár változása

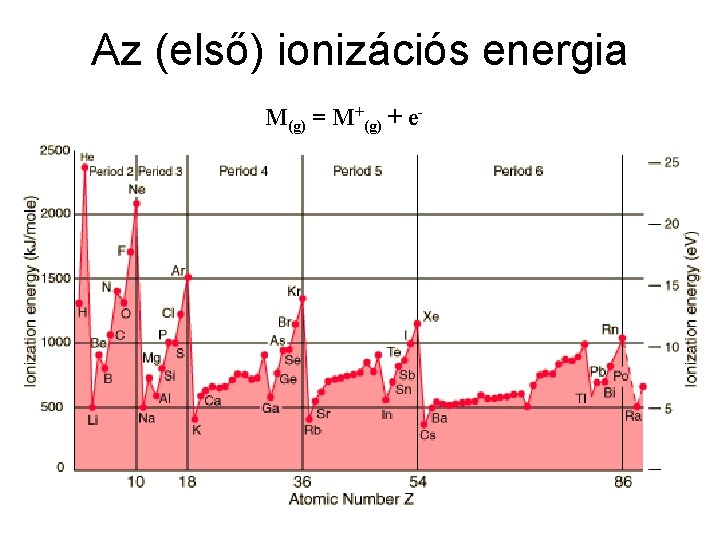
A periódikus sajátságok • Ionizációs energia: Az első ionizációs energia az az energia, amely egy atom (vagy molekula) leglazábban kötött elektronjának eltávolításához szükséges. (Történhet pl. elektronütközéssel vagy fotonok hatására. ) A(g) → A+(g) + e− Perióduson belül nő: ok: csökkenő atomméret, növekvő Zeff (effektív magtöltés) Li B C Zeff: 1, 3 2, 7 3, 35 eltérések: IIIA p vs. s VIA VA páratlan vs. párosított

A periódikus sajátságok • Elektron affinitás: Az az energia amely akkor szabadul fel, ha egy atom, vagy molekula egy elektront felvesz. Definiálható az alábbi két módon is: 1. A−(g) → A(g) + e− magyar, Boksai 2. A(g)+ e− → A−(g) angolszász, Nyilasi IUPAC definíció: 1 -nél a befektetett energia, vagy a 2 -nél a felszabaduló energia (a kettő ekvivalens)

Az (első) ionizációs energia M(g) = M+(g) + e-


Elektronegativitás

Elektronegativitás Mulliken: Pauling: A kémiai kötést létesítő atomok azon képessége, hogy a molekulán belül, a szomszédos atomoktól elektronokat (azaz közös elektronpárokat) vonzanak magukhoz. F elektronegativitása választott: 4, 0

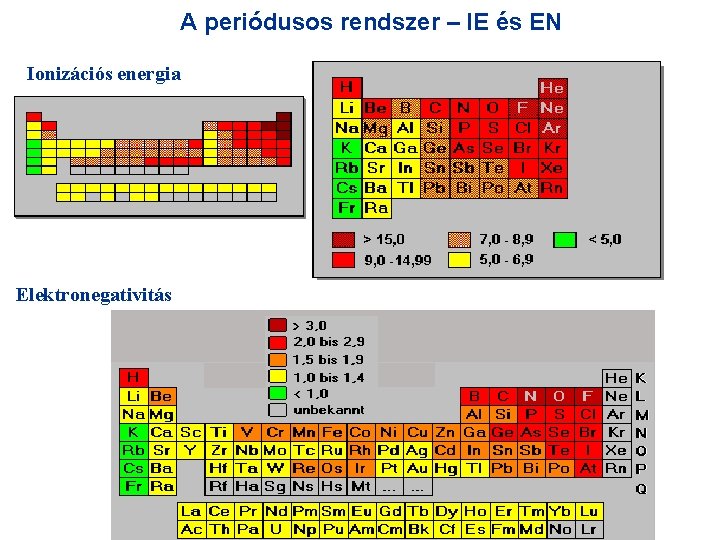
A periódusos rendszer – IE és EN Ionizációs energia Elektronegativitás

 Proton neutron elektron
Proton neutron elektron Symbole proton neutron electron
Symbole proton neutron electron What element
What element Menurut bohr elektron-elektron dalam atom
Menurut bohr elektron-elektron dalam atom Proton neutron quarks
Proton neutron quarks Proton neutron electron
Proton neutron electron Proton neutron quarks
Proton neutron quarks Proton neutron
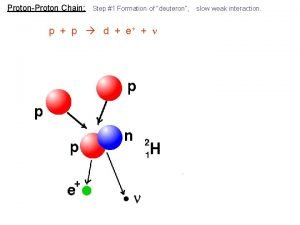
Proton neutron Proton proton chain
Proton proton chain Fission definition
Fission definition Proton proton chain
Proton proton chain Aturan aufbau
Aturan aufbau Lambang atom no 31
Lambang atom no 31 Teori atom democritus
Teori atom democritus The structure of the atom section 2 defining the atom
The structure of the atom section 2 defining the atom Angular momentum
Angular momentum Neutron superhighway
Neutron superhighway Schwarzschild radius
Schwarzschild radius Neutron star
Neutron star Neutron dosimeter
Neutron dosimeter Binary neutron star
Binary neutron star Mass of neutron
Mass of neutron Neutron fission
Neutron fission Neutron life cycle
Neutron life cycle Candela y neutron
Candela y neutron Neutron star
Neutron star Neutron star
Neutron star Neutron emission
Neutron emission Cristian massimi unibo
Cristian massimi unibo The atoms family album
The atoms family album Find the number of protons au
Find the number of protons au Degeneracy pressure
Degeneracy pressure Nedm meaning
Nedm meaning Mirjam van daalen
Mirjam van daalen Photon neutron
Photon neutron Neutron star
Neutron star Spallation neutron source
Spallation neutron source Spallation neutron source
Spallation neutron source Proton capture equation
Proton capture equation Proton charge
Proton charge Neutron skin
Neutron skin Hydrogen isotope with 1 neutron
Hydrogen isotope with 1 neutron Neutron star
Neutron star Isis neutron and muon source
Isis neutron and muon source Masa del neutron
Masa del neutron Siapakah penemu proton
Siapakah penemu proton Neutron capture
Neutron capture