LATOME Un atome est form dun noyau trs


































- Slides: 34

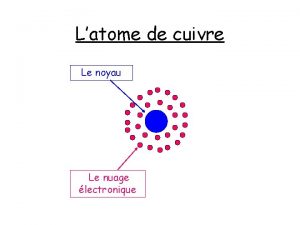
L’ATOME

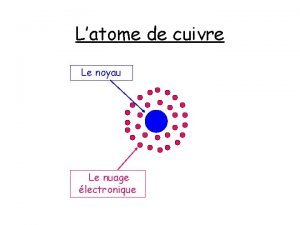
• Un atome est formé d’un noyau très petit autour duquel des électrons (de charge négative) se déplacent à grande distance. Il est donc essentiellement constitué de vide : l’atome a une structure lacunaire. • On le représente de la façon suivante :


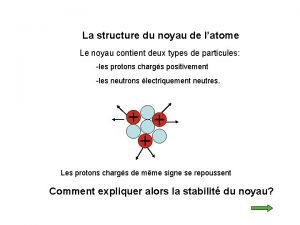
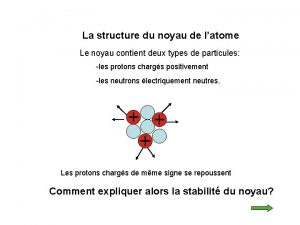
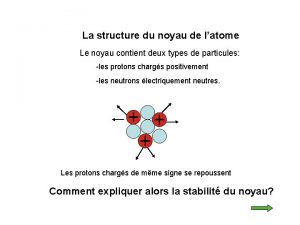
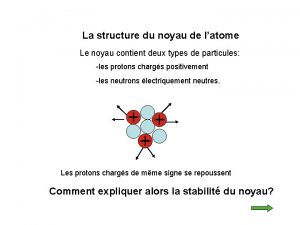
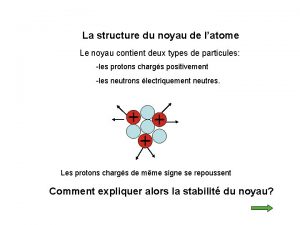
I – Le noyau atomique : 1) Composition du noyau : • Le noyau de l’atome est constitué de deux types de particules : les protons et les neutrons. • Les protons et les neutrons sont appelés les nucléons. • Certaines propriétés de ces particules sont regroupées dans le tableau ci-dessous :


2) Les nombres A et Z : • Il convient de représenter le noyau d’un atome par le symbole : A X Z • où X représente le symbole de l’élément chimique.

• Z est le nombre de protons du noyau. Z est appelé le nombre de charge ou numéro atomique. • A est le nombre de nucléons (neutrons + protons) présents dans ce noyau. • Donc le nombre de neutrons N est : N = A - Z

Exemple : Calculer le nombre de protons et de neutrons des atomes suivants : • Le carbone : 126 C. • Le fer : 5626 Fe. • L’hydrogène : 11 H

Réponse : • Le carbone : 126 C : A = 12 nucléons; Z = 6 protons et N = A - Z = 12 -6 = 6 neutrons. • Le fer : 5626 Fe : 56 nucléons dont : 26 protons et 30 neutrons. • L’hydrogène : 11 H : 1 nucléon dont : 1 proton et 0 neutron.

3) Les isotopes : On peut trouver sur Terre 3 types d’atomes de carbone : • Le carbone : 126 C. • Le carbone : 136 C. • Le carbone : 146 C. Quelle est leur nombre de proton et de neutron ?

• Le carbone : 126 C : 6 protons et 6 neutrons. • Le carbone : 136 C : 6 protons et 7 neutrons. • Le carbone : 146 C : 6 protons et 8 neutrons. • Conclusion ?

• Les atomes isotopes d’un élément sont les ensembles d’atomes caractérisés par le même numéro atomique Z et des nombres de nucléons A différents (donc ils ont le même nombre de protons mais un nombre différents de neutrons). • Ils sont représentés par le même symbole chimique.

II – Les électrons : • Le nombre Z représente aussi le nombre d’électrons de l’atome. • La charge d’un électron est : qe = -1, 6× 10 -19 C • La masse d’un électron est : me = 9, 1× 10 -31 kg

III - Propriété de l’atome : 1) Donner la composition (c’est-à-dire : le nombre de protons, neutrons et électrons) de l’atome de carbone 126 C. 2) Calculer la charge du noyau de carbone 12 C. 6 3) Calculer la charge du nuage électronique du carbone 126 C. 4) Calculer la charge totale de l’atome.

Réponses : 1) L’atome de carbone possède 6 protons, 6 neutrons et 6 électrons. 2) Le noyau contient les protons et les neutrons. Les neutrons ont une charge nulle qn = 0 C et les protons ont une charge : qp = +1, 6× 10 -19 C. La charge du noyau est : Qnoyau = 6× 0 + 6× 1, 6× 10 -19 = 9, 6× 10 -19 C.

3) Le nuage électronique est constitué des électrons. Chaque électron a une charge : qe = -1, 6× 10 -19 C. La charge du nuage électronique est : Qnuage = 6 × (-1, 6× 10 -19 ) = - 9, 6× 10 -19 C. 4) La charge totale de l’atome est : Q = Qnoyau + Qnuage = 9, 6× 10 -19 + (- 9, 6× 10 -19) = 0 C.

• L’atome est donc électriquement neutre. • On parle d’électroneutralité (ou neutralité électronique) de l’atome.

IV – Les ions : • Les atomes peuvent perdre ou gagner un ou plusieurs électrons. On parle alors d’ions (et non plus d’atome).

• Si un atome a perdu un ou plusieurs électrons (donc des particules négatives), on obtient un ion positif aussi appelé cation. • Exemple : l’atome de sodium (symbole Na) peut perdre un électron pour former l’ion sodium. Donc cet ion a une charge positive en excès. On notera l’ion sodium : Na+

• Si un atome a gagné un ou plusieurs électrons (donc des particules négatives), on obtient un ion négatif aussi appelé anion. • Exemple : l’atome de chlore (symbole Cl) peut gagner un électron pour former l’ion chlorure. Donc cet ion a une charge négative en excès. On notera l’ion chlorure : Cl -

Remarque : • Le nombre de protons et de neutrons est inchangé lorsqu’un atome se transforme en ion donc le noyau de l’atome n’est pas modifié.

Exemple : Donner la composition des atomes ou ions suivants : • Atome d’oxygène : 168 O. • Ion oxygène 168 O 2 • Atome d’aluminium : 2713 Al. • Ion aluminium : 2713 Al 3+

Réponses : • Atome d’oxygène : 168 O : Z=8 protons et 8 électrons, 16 -8 = 8 neutrons. • Ion oxygène 168 O 2 - : Z=8 protons, 16 -8 = 8 neutrons. L’atome d’oxygène a 8 électrons, en se transformant en ion, il a gagné 2 électrons (car sa charge est 2 - donc il a gagné 2 charges négatives) donc il possède 8+2 = 10 électrons.

• Atome d’aluminium : 2713 Al : Z=13 protons et 13 électrons, 27 -13 = 14 neutrons. • Ion aluminium : 2713 Al 3+ : 13 protons et 14 neutrons car l’atome et l’ion ont le même noyau. L’atome d’aluminium a 13 électrons, en se transformant en ion, il a perdu 3 électrons (car sa charge est 3+ donc il a perdu 3 charges négatives) donc il possède 13 -3 = 10 électrons.

Exercices : • Soit l'ion fer II que l'on note : 5626 Fe 2+. • 1) Donner le nombre de protons, de neutrons et d'électrons de cet ion. • 2) Calculer la charge en Coulomb de cet ion.

Réponse : • Z = 26 donc 26 protons, A-Z = 56 -26 = 30 neutrons, L'atome de fer possède 26 électrons car Z = 26 mais en devenant un ion Fe 2+, il a perdu 2 électrons donc il possède 26 -2 = 24 électrons. • 2) Charge de l'ion : Qion = Qnoyau +Q nuage = 26×(+1, 6. 10 -19) + 24 × (-1, 6. 10 -19) = +3, 2. 10 -19 C.

V – Masse d’un atome : • Un atome est constitué de Z protons, (A-Z) neutrons et Z électrons. • Notons : mp : la masse d’un proton , mn = la masse d’un neutron et me = la masse d’un électron. • La masse d’un atome est donc égale à : m = Z × mp + (A - Z) × mn + Z × me

Exercice : • calculer la masse d’un atome de carbone 12 C. 6 2) Calculer la masse du noyau d’un atome de carbone 126 C.

1) L’atome de carbone possède 6 protons, 6 neutrons et 6 électrons. Donc : m = Z × mp + (A - Z) × mn + Z × me = 6 × 1, 67 × 10 -27 + 6 × 9, 1 × 10 -31= 2, 00 × 10 -26 kg. La masse de l’atome de carbone 126 C est : matome = 2, 00 × 10 -26 kg

2) Le noyau possède 6 protons et 6 neutrons. Donc : mnoyau = Z × mp + (A - Z) × mn = 6 × 1, 67 × 10 -27 + 6 × 1, 67 × 10 -27 = 2, 00 × 1026 kg. La masse du noyau de carbone 126 C est : mnoyau = 2, 00 × 10 -26 kg Conclusion ?

• La masse de l’atome est alors pratiquement égale à celle de son noyau. • On peut aussi dire que la masse de l’atome est concentrée dans son noyau. • On peut donc calculer la masse d'un atome en appliquant la formule : m = A × mp = A × mn car mn=mp. • C'est pour cela que l'on appelle A : le nombre de masse,

Exercice : • La charge électrique portée par un ion est +4, 8. 10 -19 C. La masse de son noyau est 4, 5. 10 -26 kg. Donner sa composition, son écriture symbolique, sachant que son noyau contient 14 neutrons.

Réponse : • La masse du noyau est donnée par : m = A×mndonc : A = m/mn=4, 5× 10 -26 / 1, 67× 10 -27 = 27 nucléons. • La charge de l'ion est égale à : +4, 8. 10 -19 C. Donc c'est un ion positif car sa charge est positive. Il a perdu : 4, 8. 1019/1, 6. 10 -19= 3 électrons. • Cet atome possède 27 nucléons dont 14 neutrons et 2714 = 13 protons, il possède 13 -3 = 10 électrons. • D'après la classification périodique, c'est l'ion aluminium (car Z = 13). • La représentation de l'ion aluminium est : • 27 Al 3+ 13

Quelques exercices sur internet : • http: //helium 4. fr/quiz/atome/ • http: //ww 3. acpoitiers. fr/voir. asp? p=sc_phys/tournier/seco ndes/chimie/ANZ/anz. htm • http: //ww 3. acpoitiers. fr/voir. asp? p=sc_phys/tournier/seco ndes/chimie/atome. htm • http: //phys. free. fr/exatomes. htm • http: //phys. free. fr/exions. htm
 Schéma de lewis de l'azote
Schéma de lewis de l'azote Llment
Llment Xavier assfeld
Xavier assfeld Xxxaex
Xxxaex Couche electronique
Couche electronique Aufbau eines eisenatoms
Aufbau eines eisenatoms Corrige
Corrige La longue histoire de l'atome
La longue histoire de l'atome Couche externe d'un atome
Couche externe d'un atome Ns1(n-1)d5
Ns1(n-1)d5 Niels bohr phrase atome
Niels bohr phrase atome Impuls physik 3
Impuls physik 3 Woraus bestehen atome
Woraus bestehen atome Impuls chemie 4 lösungen
Impuls chemie 4 lösungen Noyau caudé
Noyau caudé énergie de liaison d'un noyau
énergie de liaison d'un noyau Différenciation cortico-sous-corticale
Différenciation cortico-sous-corticale P-bromonitrobenzene
P-bromonitrobenzene énergie de liaison d'un noyau
énergie de liaison d'un noyau Noyau lenticulaire
Noyau lenticulaire Bobine à noyau de fer
Bobine à noyau de fer Noyau épididymaire froid
Noyau épididymaire froid Physiologie des noyaux gris centraux
Physiologie des noyaux gris centraux Noyau
Noyau Anatomie radiologique du coude
Anatomie radiologique du coude Noyau thoracique de clarke
Noyau thoracique de clarke Noyau
Noyau What is b heavy molasses
What is b heavy molasses Righmove plus
Righmove plus Trs oficina
Trs oficina Trs vs orp
Trs vs orp Trs surcharge
Trs surcharge Tess.trs
Tess.trs Trs mil
Trs mil Trs active care bswift
Trs active care bswift