Anlise qualitativa e quantitativa no automatizada Avaliao da

















- Slides: 22


Análise qualitativa e quantitativa não automatizada Avaliação da motilidade e vitalidade

Preparo para análise seminal • Em uma lâmina, colocar 10 µl de sêmen e cobrir com uma lamínula de 22 x 22 mm • Repousar por alguns minutos • Examinar em 10 X e 40 X • Verificar o número de espermatozóides por campo

Aglutinação • A sua presença pode sugerir causa imunológica de infertilidade • Deve ser analisada em 10 campos • A sua presença deve ser relatada, e o tipo de aglutinação registrado • • Cabeça-cabeça Cauda-cauda Peça intermediária – peça intermediária Mista (vários tipos presentes)

Motilidade • Dever ser classificada nas seguintes categorias: • • Motilidade progressiva e rápida Motilidade progressiva lenta Motilidade não progressiva Sem movimento • A avaliação da motilidade dever ser feita imediatamente após a liquefação, 2 h e 6 h após a primeira avaliação

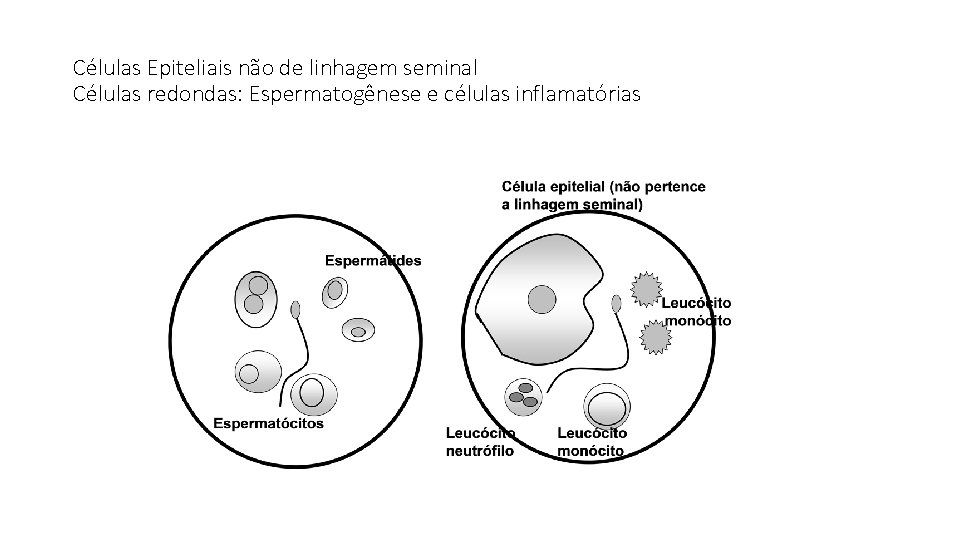
Células Epiteliais não de linhagem seminal Células redondas: Espermatogênese e células inflamatórias

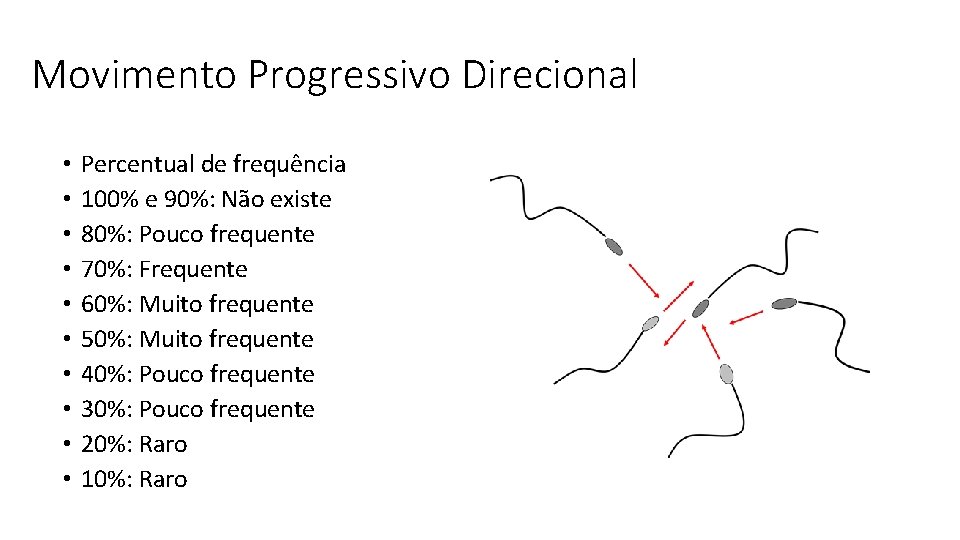
Movimento Progressivo Direcional • • • Percentual de frequência 100% e 90%: Não existe 80%: Pouco frequente 70%: Frequente 60%: Muito frequente 50%: Muito frequente 40%: Pouco frequente 30%: Pouco frequente 20%: Raro 10%: Raro

Movimento Progressivo Pouco Direcional (lento) • Percentual de frequência • 60%: Raro • 50%: Frequente • 40%: Muito frequente • 30%: Muito frequente • 20%: Frequente • 10%: Raro

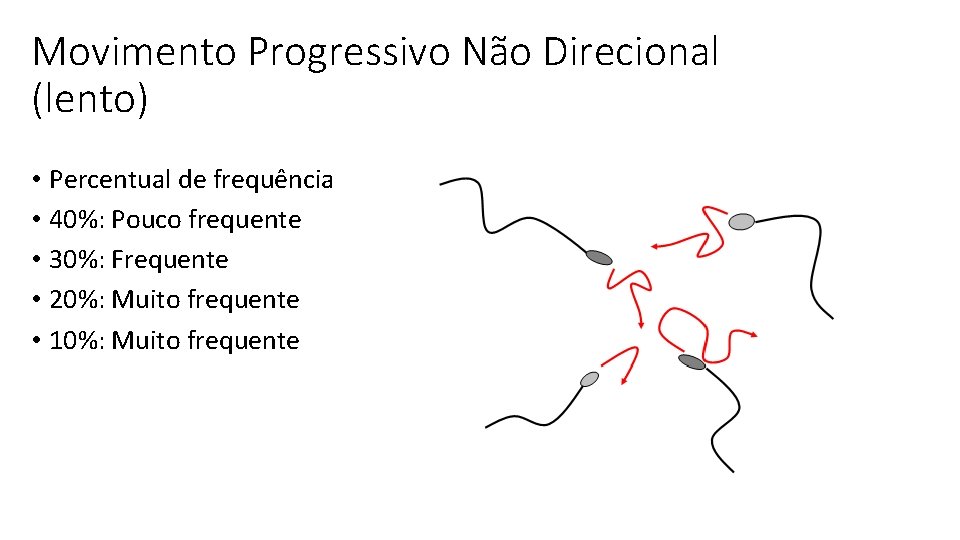
Movimento Progressivo Não Direcional (lento) • Percentual de frequência • 40%: Pouco frequente • 30%: Frequente • 20%: Muito frequente • 10%: Muito frequente

Vitalidade • Reflete a proporção de espermatozoides que estão "vivos“ na amostra, o método de escolha é a técnica de coloração Eosina / Nigrosina • Baseia-se na “integridade funcional da membrana plasmática viva”, que não permite a passagem do corante, enquanto a membrana das células mortas permite a passagem do corante • Espermatozoides vivos – não corados • Espermatozoides mortos – corados

Reagentes • Eosina amarela ou amarelada (Merck) – solução salina a 3%, estocar em temperatura ambiente • Nigrosina hidrossolúvel (Merck) – solução a 8% em salina • • Pesar 8 gramas de nigrosina, tornando-a pó fino em um gral Adicionar 10 ml de etanol a 95 o Levar a estufa de 100 o. C até evaporação do etanol Adicionar salina lentamente, mexendo a nigrosina até completa dissolução, completa volume em 100 ml, estocar a temperatura ambiente e filtrar periodicamente

Técnica • Colocar uma gota de sêmen bem homogeneizado sobre uma lâmina de microscopia • Adicionar 2 gotas de solução de Eosina a 3% e misturar imediatamente • Adicionar rapidamente 3 a 4 gotas de suspensão de Nigrosina a 8% e misturar imediatamente • Preparar 4 esfregaços bem grossos com a mistura acima, secando-os rapidamente (secador de cabelo) • Observar ao microscópio, com objetiva de imersão, contar 100 gametas (vivos e mortos)

Valores de referência • Acima de 70% de vivos • Necrospermia – acima de 30% de mortos

Contagem de espermatozoides • É realizada, após a liquefação total do sêmen, em câmara de contagem. • Apesar das câmaras de Horwell e de Makler serem específicas para a contagem de espermatozoides, a câmara de Neubauer (hemocitômetro) ainda é largamente utilizada.

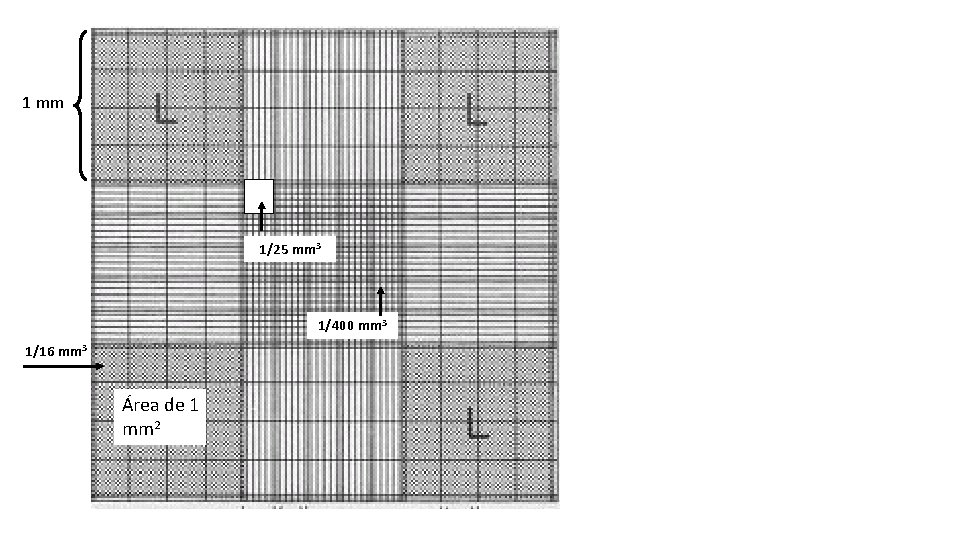
Câmara de Neubauer • É uma lâmina de vidro espessa, com uma depressão central de contagem, adaptada ao microscópio de campo claro e ao de contraste de fases • É formada por 9 quadrados de 1 mm 2 de área total de 9 mm 2 • A depressão central é de 0. 1 mm até a superfície • A área marcada (L) corresponde a 1 mm 2 • O volume compreendido entre a superfície e a lamínula é de 0. 1 mm 3, ou 0. 1 µL total de 0, 9 mm 3

1 mm 1/25 mm 3 1/400 mm 3 1/16 mm 3 Área de 1 mm 2


Técnica • Diluir o esperma de 1/40, depois de liquefeito e homogeinizado, em solução salina a 0, 9% com 5% de formaldeido • Exemplo: 0, 1 ml de esperma + 3, 9 ml de solução diluente • Após homogeinizar bem, colocar na câmara e aguardar 5 minutos em ambiente úmido, para sedimentação dos gametas • Contar com objetiva de 40 X os 5 quadrantes e multiplicar por 80. 000 • Com concentração alta, contar o quadrante central e multiplicar por 400. 000

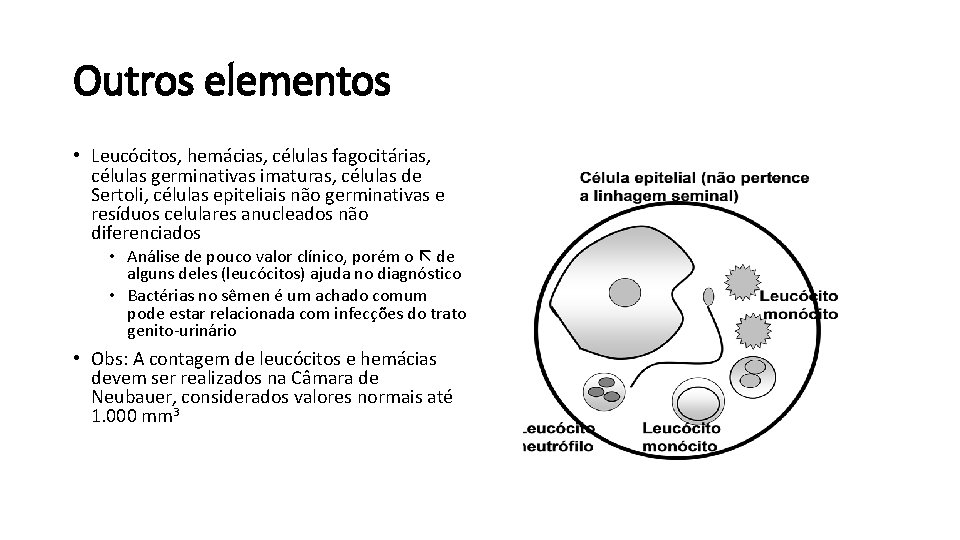
Outros elementos • Leucócitos, hemácias, células fagocitárias, células germinativas imaturas, células de Sertoli, células epiteliais não germinativas e resíduos celulares anucleados não diferenciados • Análise de pouco valor clínico, porém o de alguns deles (leucócitos) ajuda no diagnóstico • Bactérias no sêmen é um achado comum pode estar relacionada com infecções do trato genito-urinário • Obs: A contagem de leucócitos e hemácias devem ser realizados na Câmara de Neubauer, considerados valores normais até 1. 000 mm 3

Técnicas analíticas complementares (opcionais) • Detecção de anticorpos anti-espermatozóides • Imunobeads, teste de aglutinação macroscópica (MAR Teste) e outros • A presença destes anticorpos sugere infertilidade • Marcadores bioquímicos: • fosfatase ácida e ácido cítrico (marcadores da próstata) • frutose e prostaglandinas (vesículas seminais) • Cultura seminal

Interferentes: Medicamentos • O relato do uso de medicamentos é importante na execução do exame • Podem provocar aumento, ou diminuição das contagens e da motilidade dos espermatozóides • ácido valpróico, cetoconazol, cimetidina, fluconazol, ramitidina, anfepramona, decanoato de testosterona, fenitoína, haloperidol, sulfassalazina, reserpina, trimetopina, cafeína e outros.

• Drogas de abuso como, por exemplo: álcool, tabaco, maconha, cocaína e outras • Preservativos de látex • Temperaturas extremas de conservação da amostra (ideal entre 20 e 40ºC)
 Statistica qualitativa
Statistica qualitativa O que é survey
O que é survey Ricerca qualitativa
Ricerca qualitativa Diferenças entre pesquisa qualitativa e quantitativa
Diferenças entre pesquisa qualitativa e quantitativa Anlise swot
Anlise swot Teoria quantitativa della moneta
Teoria quantitativa della moneta Tipos de estado civil
Tipos de estado civil Teoria quantitativa da moeda
Teoria quantitativa da moeda Variancia formula
Variancia formula Ferrografia quantitativa
Ferrografia quantitativa Desenho de pesquisa quantitativa
Desenho de pesquisa quantitativa Equilibrio hardy weinberg
Equilibrio hardy weinberg Herança quantitativa
Herança quantitativa Técnicas de pesquisa quantitativa
Técnicas de pesquisa quantitativa Herança quantitativa
Herança quantitativa Gene do daltonismo
Gene do daltonismo Pesquisa qualitativa
Pesquisa qualitativa Tipos de amostragem qualitativa
Tipos de amostragem qualitativa Oq é pesquisa qualitativa
Oq é pesquisa qualitativa Analisi qualitativa inorganica
Analisi qualitativa inorganica Analise qualitativa
Analise qualitativa Ricerca qualitativa infermieristica
Ricerca qualitativa infermieristica La ricerca qualitativa in educazione
La ricerca qualitativa in educazione