ALKOHOLOK FELADATOK 1 A fenol nitrlsakor keletkezett nitrovegylet

















- Slides: 18

ALKOHOLOK FELADATOK

1. A fenol nitrálásakor keletkezett nitrovegyület 15, 217% N-t tartalmaz. Határozza meg a nitrovegyületet és írja le az előállítási reakcióját. Számítsa ki 69 g termék előállításához szükséges 80%-os tisztaságú fenol tömegét, ha a hozam 75%-os. >a feltételezett nitrovegyület: >a móltömege: >az x kiszámítása: C 6 H 6 -XO(NO 2)X M = 94+45 x 100 g termék. . 15, 217 g N (94+45 x)g. . . . 14 x g N x=2 -a termék dinitro-fenol

>a nitrovegyület előállítási reakciója: C 6 H 5─OH +2 HNO 3→ C 6 H 4 O(NO 2)2+2 H 2 O >az elméletileg keletkezett termék tömege: 69 g. . . 75% m ………. . . 100% m = 92 g C 6 H 4 O(NO 2)2 >a reagált fenol tömege reakció szerint: 94 g fenol. . . 184 g termék x g. . . . 92 g termék x = 47 g fenol >a bevezetett fenol tömege: 100 g-ban. . . . 80 g fenol y g. . . 47 g fenol y = 58, 75 g (80%-os fenol)

2. A koleszterin szintézise során keletkező köztes (intermedier) vegyület a mevalonsav, melynek szerkezete: CH 3 | HO─CH 2─C─CH 2─COOH | OH a)Jegyezze le a funkciós csoportokat, a szénlánc típusát és a primer: szekunder: tercier C atomok számarányát. b)Határozza meg a C: O atomok tömegarányát. c)Számítsa ki hány g mevalonsav tartalmaz ugyanannyi oxigént, mint 45 g glükóz. >a funkciós csoportok: -OH, hidroxil -COOH, karboxil >a szénlánc típusa: alifás, telített, elágazó

>Cp: Cs: Ct = 3: 2: 1 >az atomok tömegaránya: C: O = 72: 64|: 8 C: O = 9: 8 >a glükózban az oxigén tömege: 180 g C 6 H 12 O 6. . . . 96 g oxigén 45 g. . . . . x g oxigén x = 24 g oxigén >a mevalonsav (C 6 H 12 O 4 ) móltömege: M=148 g/mol 148 g. . . 64 g oxigén y g. . . . 24 g oxigén y = 55, 5 g mevalonsav

3. Egy 287, 5 g 80%-os glicerinoldatot nitrálnak. Számítsa ki a szükséges 63%-os salétromsavoldat tömegét és a keletkezett termék mennyiségét (mólban). CH 2 ─OH | CH 2─OH + 3 HNO 3 → CH 2 ─O ─NO 2 | CH 2 ─O ─NO 2 + 3 H 2 O | CH 2 ─O ─NO 2 >a glicerin tömege az oldatban: 100 g oldatban. . . . 80 g glicerin 287, 5 g. . . . . x g glicerin x = 230 g glicerin

>a HNO 3 oldat tömege: 100 g oldatban. . 63 g HNO 3 z g. . . . 472, 5 g HNO 3 z = 750 g oldat >a keletkezett termék mólszáma: 92 g glicerin. . 1 mol nitroglicerin 230 g. . . . . n mol n = 2, 5 mol

4. Számítsa ki hány mól metanolt kell elégetni 5116, 8 kcal hőmennyiség keletkezéséhez (fűtőértéke 5330 kcal/kg). >a metanol tömege: 5330 kcal. . 1 kg metanol 5116, 8 kcal. . . . x kg metanol x = 0, 96 kg metanol >a metanol mólszáma: 32 g metanol. . 1 mol 960 g …………… n mol n = 30 mol metanol

>a metanol tömege: m = d · V = 0, 78 g/cm 3 · 820, 6 cm 3 = 640 g >a levegő térfogata: V = 5 · VO 2 V = 5 · 672 L = 3360 L

6. Ecetsavas erjedéssel 2, 3 kg 15% etanolt tartalmazó borból, 12%-os ecetsav tartalmú étecetet állítanak elő. Számítsa ki a nyert étecet tömegét g-ban. CH 3─ CH 2─OH+ O 2→ CH 3─COOH+H 2 O >a reakció alapján a keletkezett ecetsav tömege: 46 g etanol ……. . 60 g ecetsav 345 g ……………… x g ecetsav x = 450 g ecetsav

7. A szilva glükóztartalma 15 tömeg%. Számítsa ki 6 kg szilvából keletkezett etanol térfogatát (ml-ben), ha a hozam 80%-os. (etanol sűrűsége 0, 78 g/ml) C 6 H 12 O 6 → 2 CH 3─ CH 2─OH + 2 CO 2

8. Egy telített, tercier, monohidroxi-alkohol 18, 18 tömeg % oxigént tartalmaz. Határozza meg a molekula- és szerkezeti képletét. Számítsa ki 66 g alkohol dehidratációjából keletkező anyag tömegét. >az alkohol molekulatömeg kiszámítása: 100 g alkohol. . 18, 18 g oxigén M. . . . 16 g oxigén M = 88 g/mol >alkalmazzuk Cn. H 2 n+2 O általános képlet: >az alkohol szerkezete: 12 n+2 n+2+16 = 88 n = 5, C 5 H 12 O CH 3 | CH 3─C─CH 2─CH 3 → CH 3─C═CH─CH 3 +H 2 O | | OH CH 3 >a reakció szerint: 88 g alkohol. . . 70 g alkén 66 g. . . x g alkén x = 52, 5 g alkén (2 -metil-2 -butén)

9. A glicerin-trinitrát ütésre robban, a következő reakció szerint: 4 C 3 H 5(ONO 2)3 → 12 CO 2 + 10 H 2 O + 6 N 2 + O 2 Számítsa ki 227 g glicerin-trinitrát robbanásakor keletkező gázok térfogatát (n. k. között).

10. Az ecetsavas erjedés 117 kcal/mol energiafelszabadulással jár. Számolja ki 150 g ecetsav keletkezésekor nyert hőmennyiségét. CH 3─ CH 2─OH+ O 2→ CH 3─COOH+H 2 O >a keletkezett hőmennyiség: 1 mol. . 117 kcal 2, 5 mol. . . . x kcal x = 292, 5 kcal

11. Számolja ki 0, 2 mol acetil-szalicilsav, 200 ml etanololdatban (d = 0, 78 g/ml) való feloldásával nyert oldat tömeg%-os koncentrációját. >az etanololdat tömege: V = 200 ml d = 0, 78 g/ml m = d · V = 156 g etanol >a szalicilsav etanolos oldat tömege : m = 36 g+156 g = 192 g

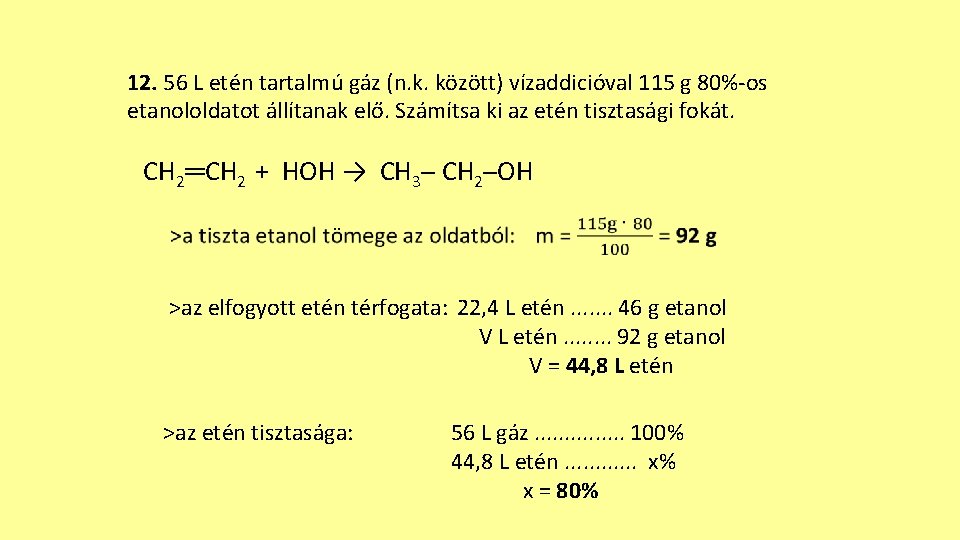
12. 56 L etén tartalmú gáz (n. k. között) vízaddicióval 115 g 80%-os etanololdatot állítanak elő. Számítsa ki az etén tisztasági fokát. CH 2═CH 2 + HOH → CH 3─ CH 2─OH >az elfogyott etén térfogata: 22, 4 L etén. . . . 46 g etanol V L etén. . . . 92 g etanol V = 44, 8 L etén >az etén tisztasága: 56 L gáz. . . . 100% 44, 8 L etén. . . x% x = 80%

13. Egy elegyben a metanol és az etanol mólaránya 2: 3. Számítsa ki: a) az elegy mól%-os összetételét. b) az elegy tömeg%-os összetételét.

KÖSZÖNÖM SZÉPEN A FIGYELMET! Farkas Melinda kémia tanárnő , , Apáczai Csere János” Elméleti Líceum
 Hegyomlással keletkezett tavak
Hegyomlással keletkezett tavak Etanol funkciós csoportja
Etanol funkciós csoportja Oxigéntartalmú szerves vegyületek csoportosítása
Oxigéntartalmú szerves vegyületek csoportosítása Szekunder alkohol
Szekunder alkohol Obtinerea fenolului din benzen
Obtinerea fenolului din benzen Fenol que es
Fenol que es Is phenol soluble in water
Is phenol soluble in water Fenol grubu
Fenol grubu Hydroxysloučeniny
Hydroxysloučeniny Hydroliza chlorobenzenu
Hydroliza chlorobenzenu 1 naftalenol
1 naftalenol Fenol
Fenol Diagram 3 fase
Diagram 3 fase Nazewnictwo fenoli
Nazewnictwo fenoli Apa yang dimaksud dengan senyawa hidrokarbon? *
Apa yang dimaksud dengan senyawa hidrokarbon? * Fenol
Fenol Fenol grubu
Fenol grubu Mesofase pada padatan dapat berupa
Mesofase pada padatan dapat berupa Struktur fenol terdiri atas
Struktur fenol terdiri atas