Aldehdos y Cetonas Lic Ral Hernndez M Introduccin















- Slides: 41

Aldehídos y Cetonas Lic. Raúl Hernández M.

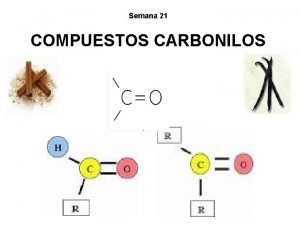
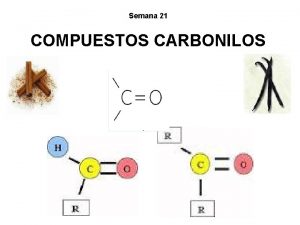
Introducción Los aldehídos y las cetonas son dos clases de derivados hidrocarbonados estrechamente relacionados, que contienen oxígeno. Cada uno de estos compuestos tiene un grupo carbonilo, un átomo de carbono unido a un átomo de oxígeno por medio de un doble enlace. Lic. Raúl Hernández M. Grupo carbonilo 2

• En los aldehídos un grupo unido al carbonilo es el hidrógeno, y el otro un grupo alquil o aril. • La única excepción es el formaldehído, los dos grupos unidos al carbonilo son hidrógenos. Lic. Raúl Hernández M. 3

• En las cetonas, siempre van unidos grupos alquil o aril. Lic. Raúl Hernández M. 4

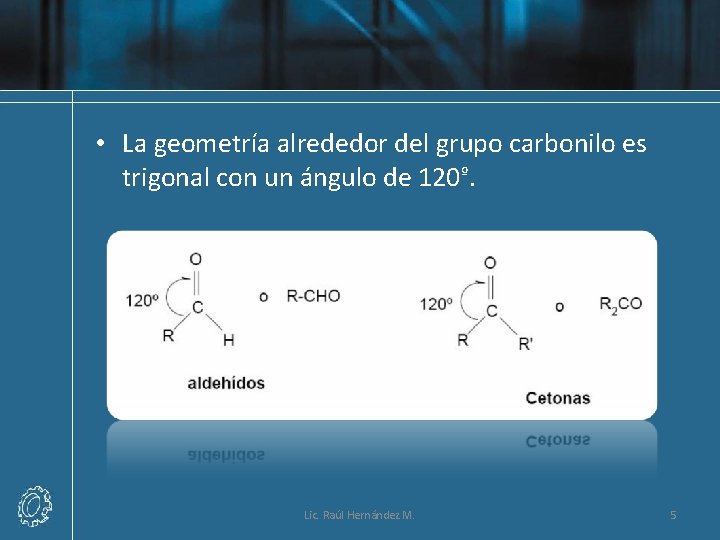
• La geometría alrededor del grupo carbonilo es trigonal con un ángulo de 120º. Lic. Raúl Hernández M. 5

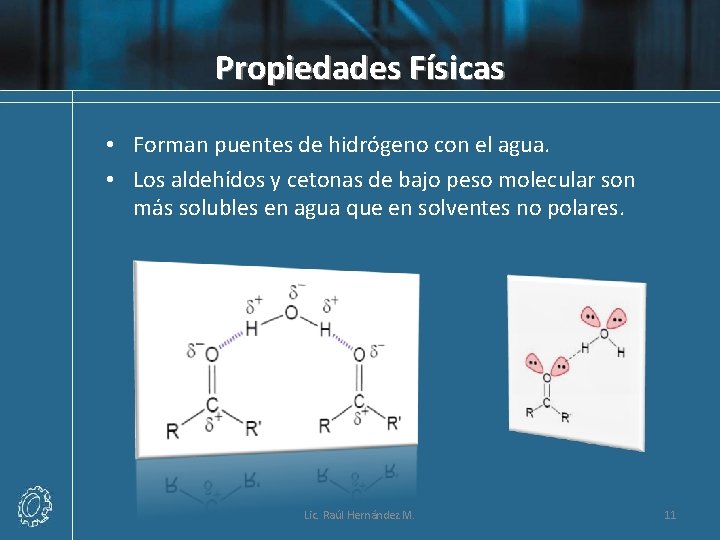
Propiedades Físicas • El oxígeno es más electronegativo que el carbono, por lo tanto, el doble enlace carbono-oxígeno es polar; y el oxígeno lleva la carga parcial negativa y el carbono la carga parcial positiva. Lic. Raúl Hernández M. 6

Lic. Raúl Hernández M. 7

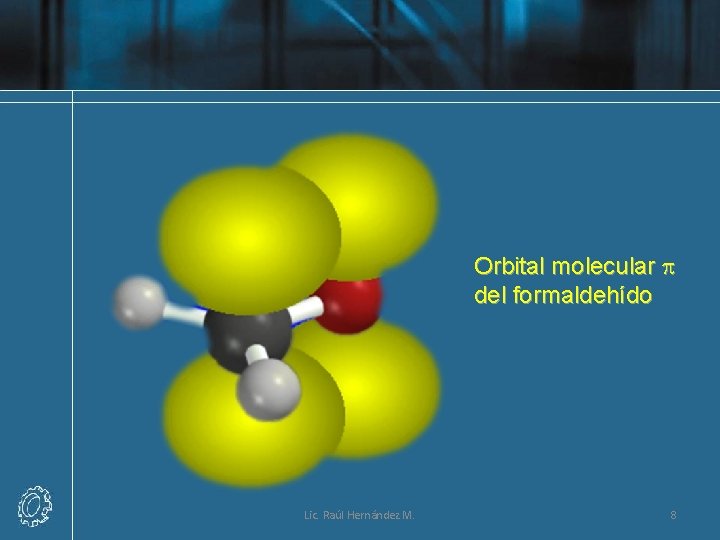
Orbital molecular p del formaldehído Lic. Raúl Hernández M. 8

Lic. Raúl Hernández M. 9

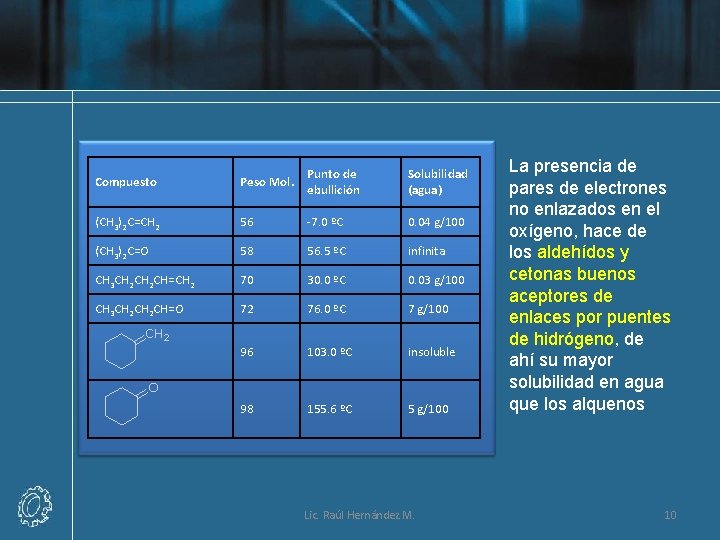
Compuesto Peso Mol. Punto de ebullición Solubilidad (agua) (CH 3)2 C=CH 2 56 -7. 0 ºC 0. 04 g/100 (CH 3)2 C=O 58 56. 5 ºC infinita CH 3 CH 2 CH=CH 2 70 30. 0 ºC 0. 03 g/100 CH 3 CH 2 CH=O 72 76. 0 ºC 7 g/100 96 103. 0 ºC insoluble 98 155. 6 ºC 5 g/100 Lic. Raúl Hernández M. La presencia de pares de electrones no enlazados en el oxígeno, hace de los aldehídos y cetonas buenos aceptores de enlaces por puentes de hidrógeno, de ahí su mayor solubilidad en agua que los alquenos 10

Propiedades Físicas • Forman puentes de hidrógeno con el agua. • Los aldehídos y cetonas de bajo peso molecular son más solubles en agua que en solventes no polares. Lic. Raúl Hernández M. 11

Propiedades Físicas • Los puntos de ebullición de aldehídos y cetonas son menores que los de los alcoholes y aminas Lic. Raúl Hernández M. 12

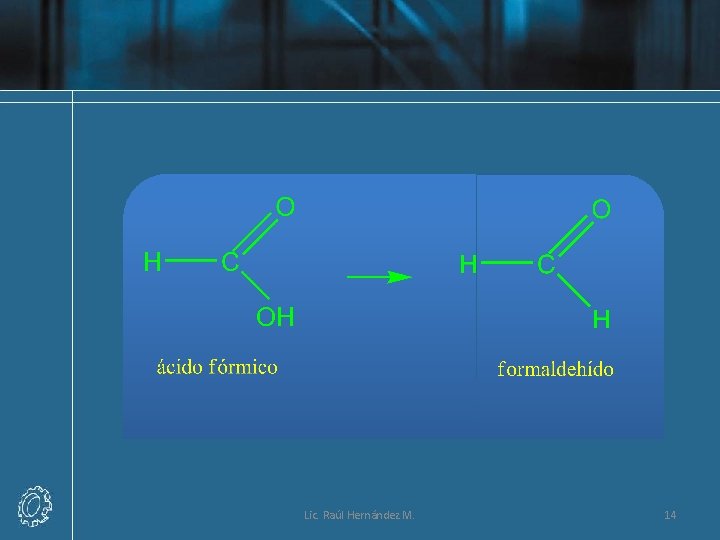
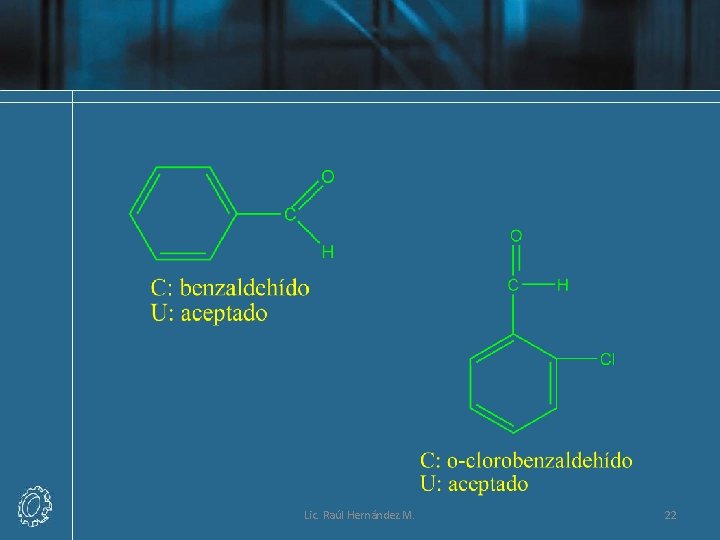
Nomenclatura Común de Aldehídos • A los aldehídos simples se les asigna nombres que corresponden a los ácidos orgánicos (RCOOH) que tienen el mismo número de átomos de carbono. Por ejemplo, el ácido orgánico más simple es el fórmico, HCOOH, el aldehído correspondiente es el formaldehído, HCHO. Para escribir el nombre común de un aldehído, se elimina del nombre común la palabra ácido y la terminación -ico se remplaza por aldehído. Lic. Raúl Hernández M. 13

Lic. Raúl Hernández M. 14

Nomenclatura UIQPA • Se toma como la cadena más larga de carbonos aquella que contiene el grupo carbonilo. La o final del nombre del alcano se sustituye por el sufijo al, el cual designa al grupo funcional de los aldehídos. Lic. Raúl Hernández M. 15

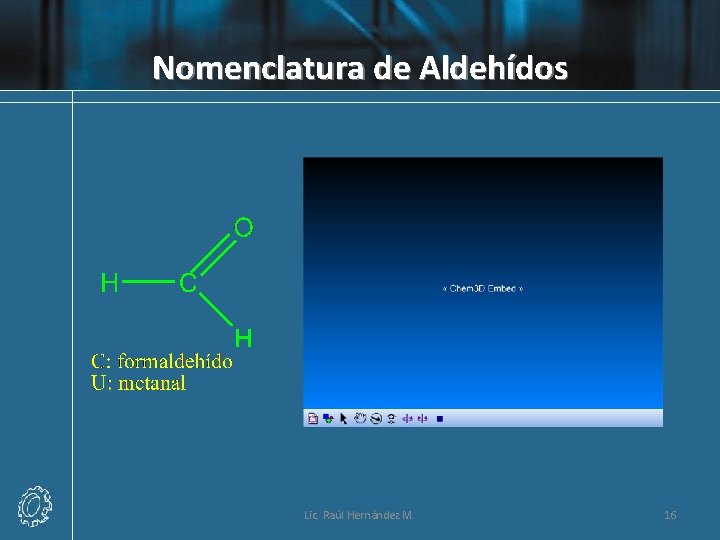
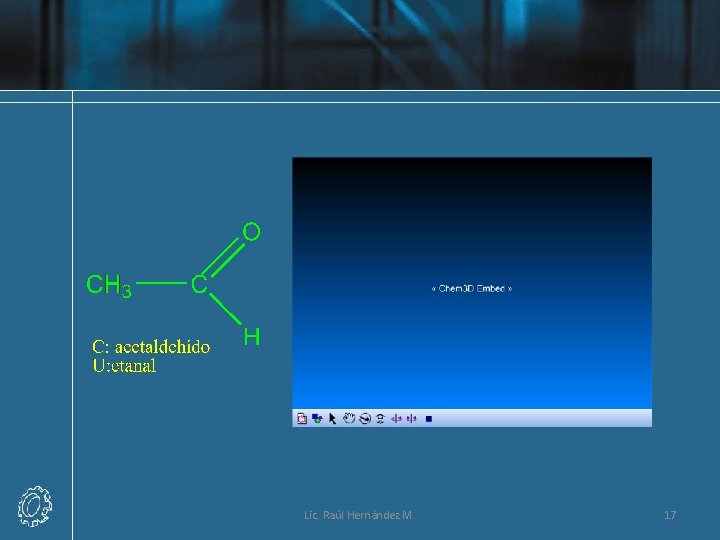
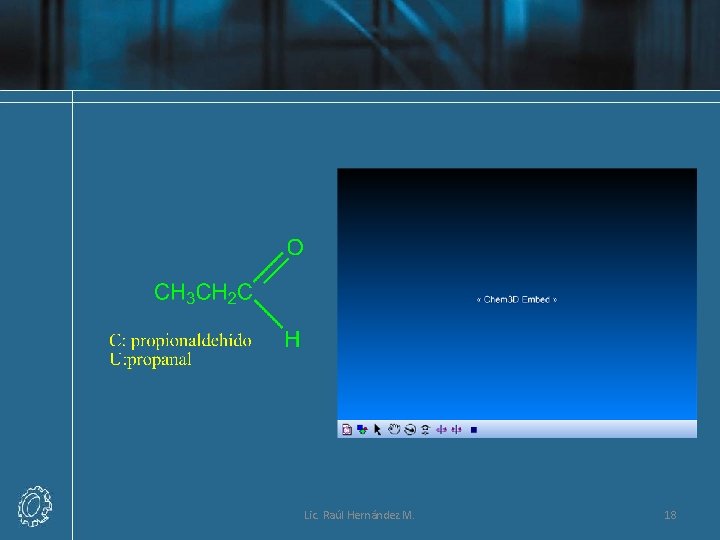
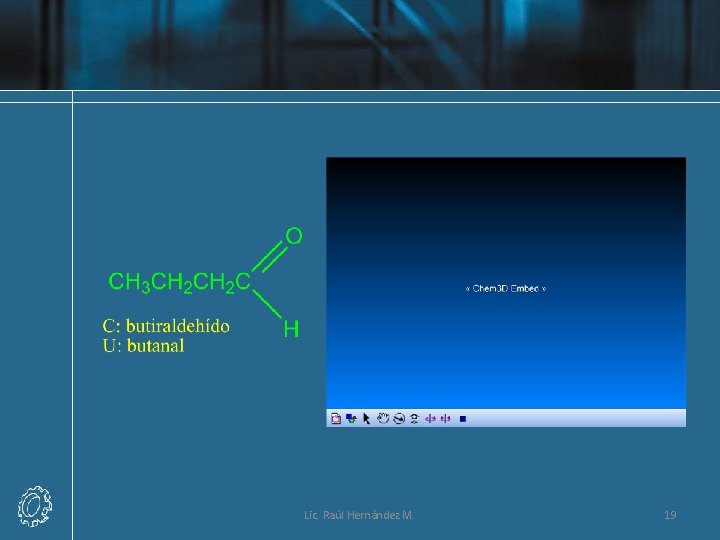
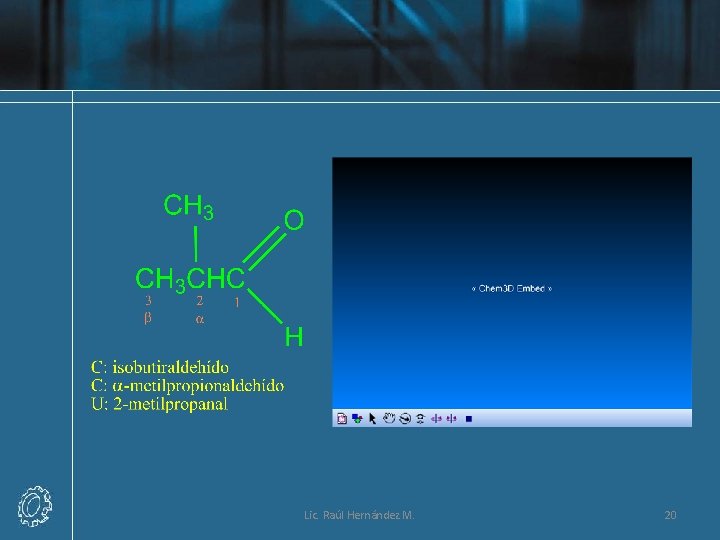
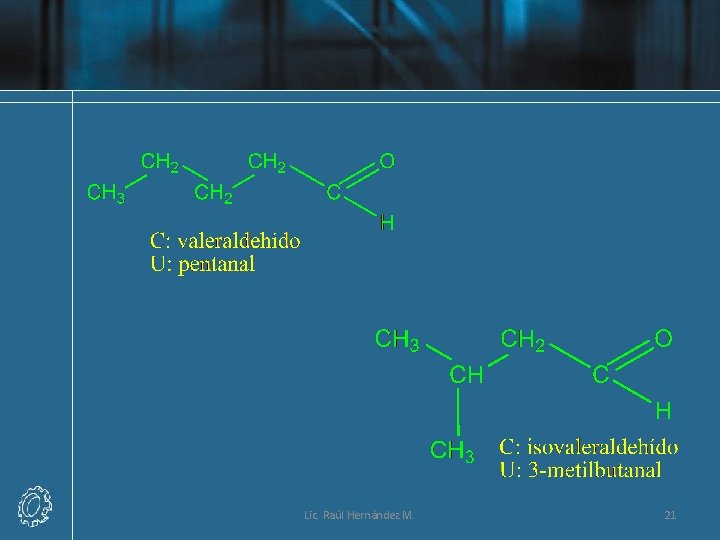
Nomenclatura de Aldehídos Lic. Raúl Hernández M. 16

Lic. Raúl Hernández M. 17

Lic. Raúl Hernández M. 18

Lic. Raúl Hernández M. 19

Lic. Raúl Hernández M. 20

Lic. Raúl Hernández M. 21

Lic. Raúl Hernández M. 22

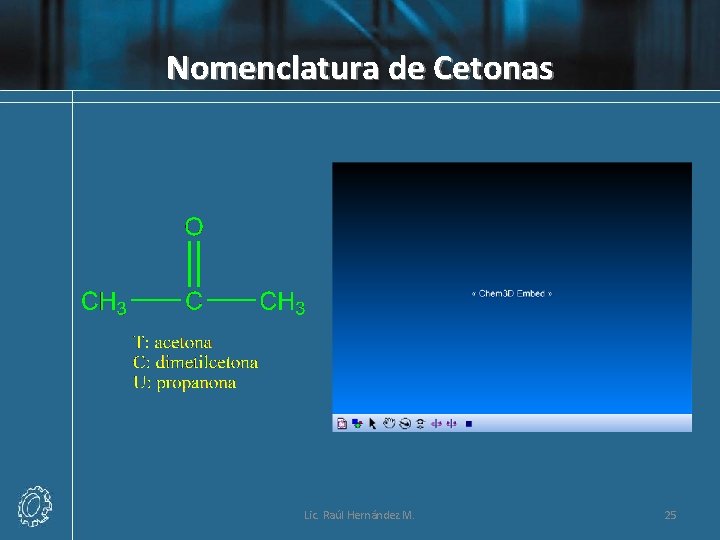
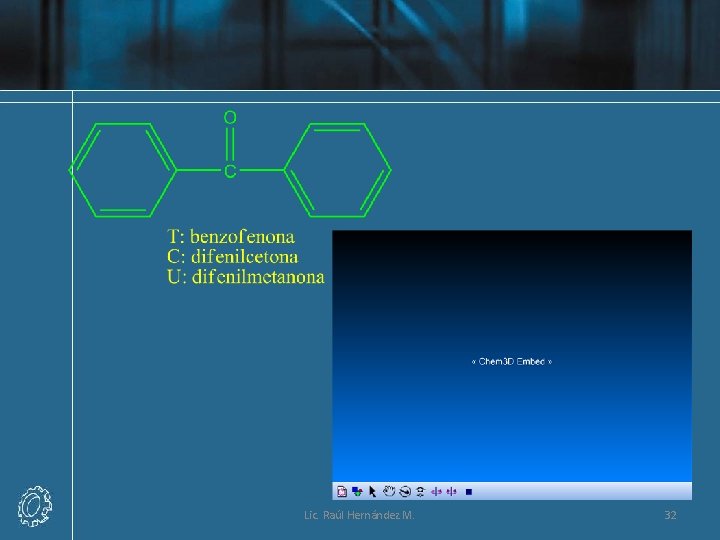
Nomenclatura Común de las Cetonas • Los nombres comunes de las cetonas se derivan de los nombres de los dos grupos unidos al grupo carbonilo ordenados alfabéticamente, seguido por la palabra cetona. Por lo tanto, la acetona también puede llamarse dimetilcetona, ya que hay dos grupos metilo enlazados al grupo carbonilo. Lic. Raúl Hernández M. 23

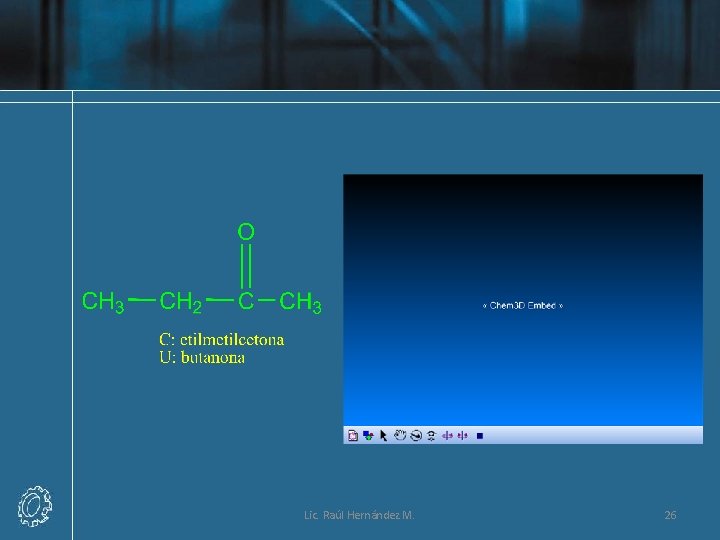
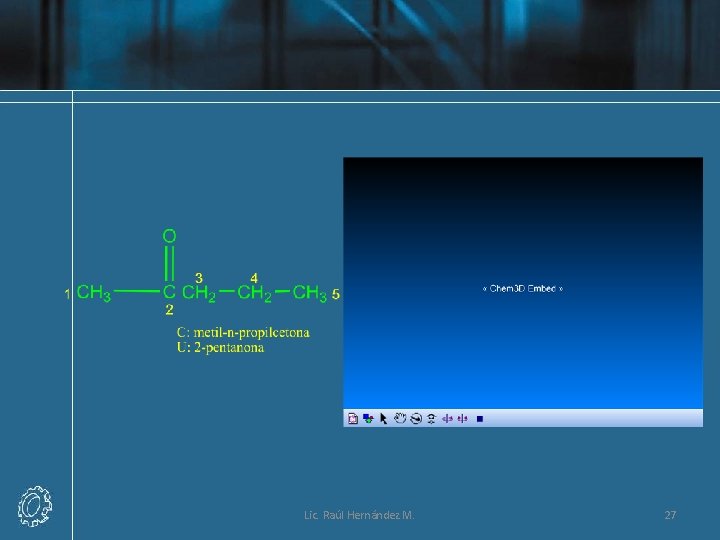
Nomenclatura UIQPA • La terminación en el sistema de IUPAC para las cetonas es -ona. Se elimina la o final del nombre del alcano precursor y se remplaza por -ona. Para cetonas con cinco o más átomos de carbono, se enumera la cadena y se le coloca el número más bajo posible al átomo de carbono del grupo carbonilo. Este número se utiliza para ubicar el grupo carbonilo, el cual se separa mediante un guión del nombre de la cetona principal. Los grupos sustituyentes se localizan y se nombran como en los otros compuestos. Lic. Raúl Hernández M. 24

Nomenclatura de Cetonas Lic. Raúl Hernández M. 25

Lic. Raúl Hernández M. 26

Lic. Raúl Hernández M. 27

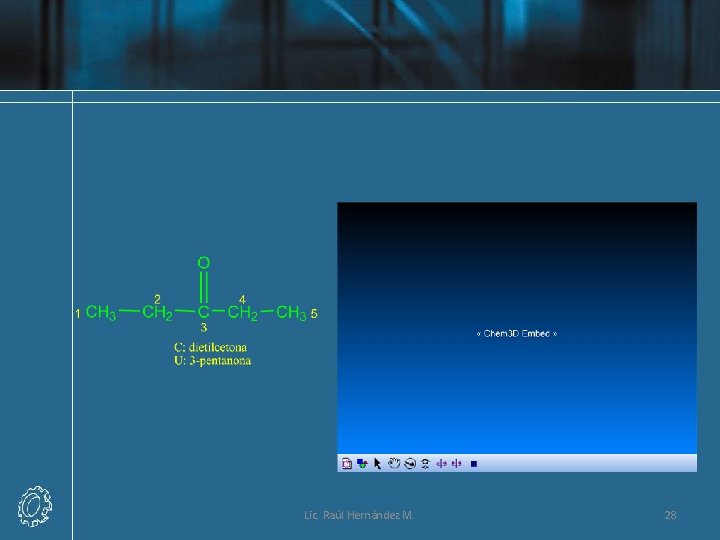
Lic. Raúl Hernández M. 28

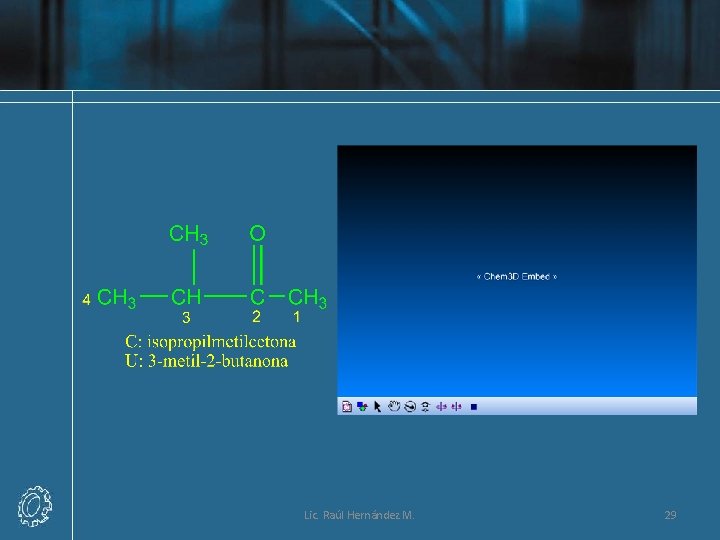
Lic. Raúl Hernández M. 29

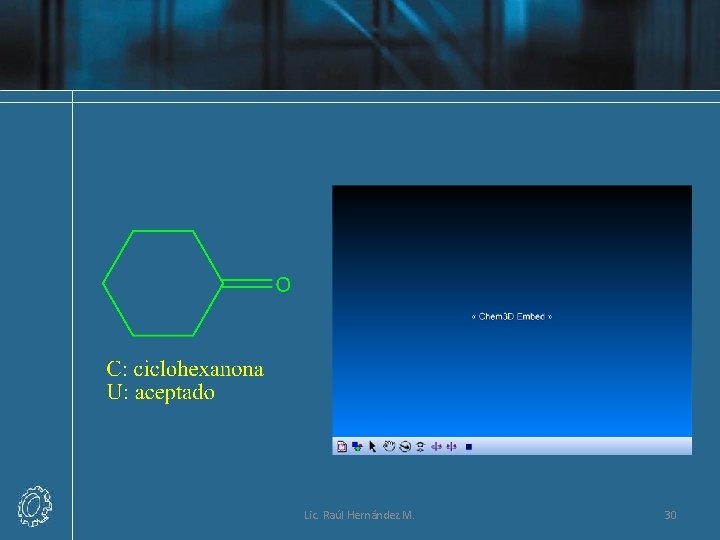
Lic. Raúl Hernández M. 30

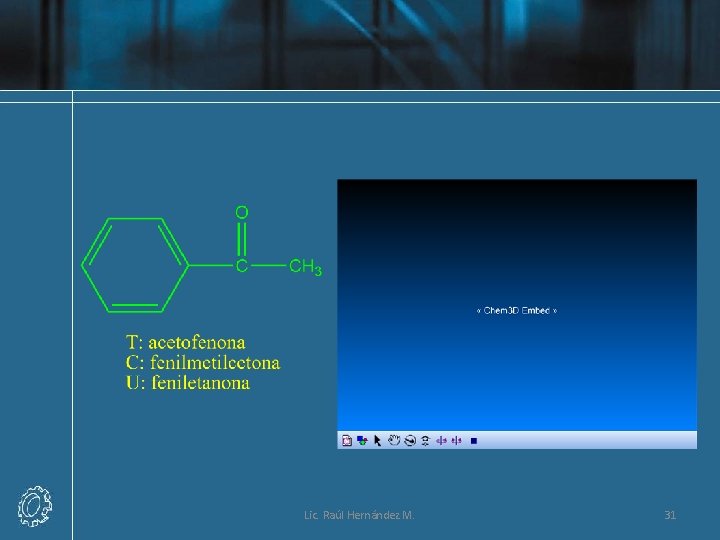
Lic. Raúl Hernández M. 31

Lic. Raúl Hernández M. 32

Reacciones de Adición Mecanismo de adición Lic. Raúl Hernández M. 33

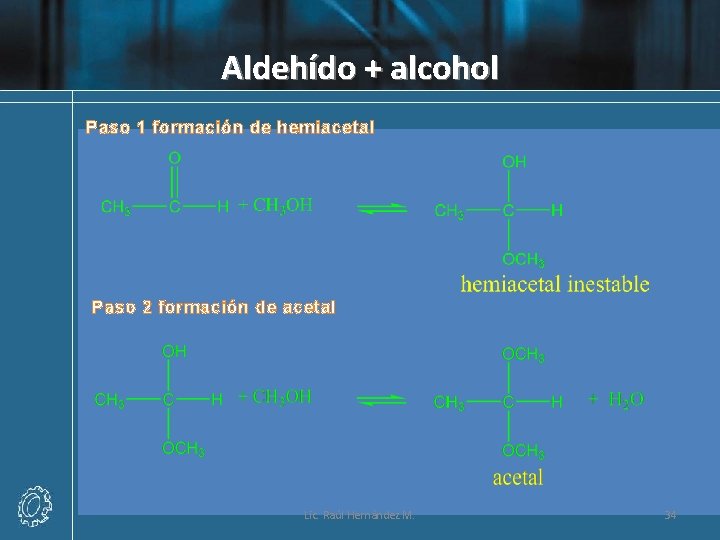
Aldehído + alcohol Paso 1 formación de hemiacetal Paso 2 formación de acetal Lic. Raúl Hernández M. 34

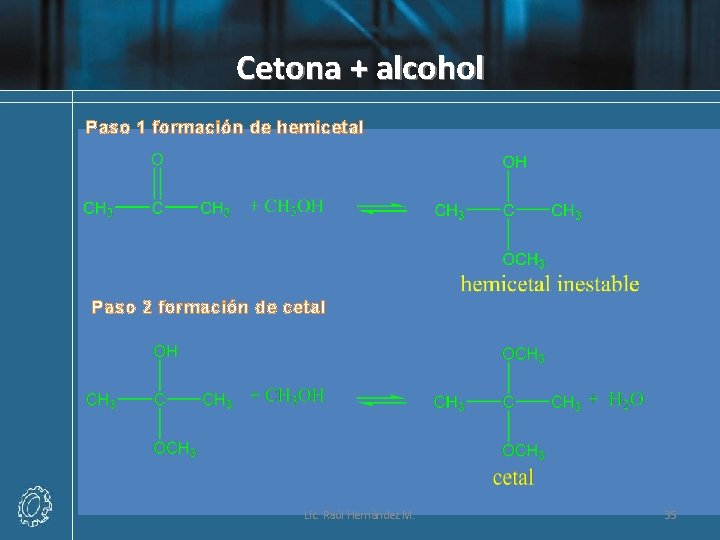
Cetona + alcohol Paso 1 formación de hemicetal Paso 2 formación de cetal Lic. Raúl Hernández M. 35

Oxidación En los aldehídos y cetonas el estado de oxidación formal del carbono carbonílico es +1 y +2, respectivamente. En los ácidos carboxílicos y sus derivados es +3 por lo que un aldehído o cetona puede oxidarse para dar un ácido carboxílico o derivado. Lic. Raúl Hernández M. 36

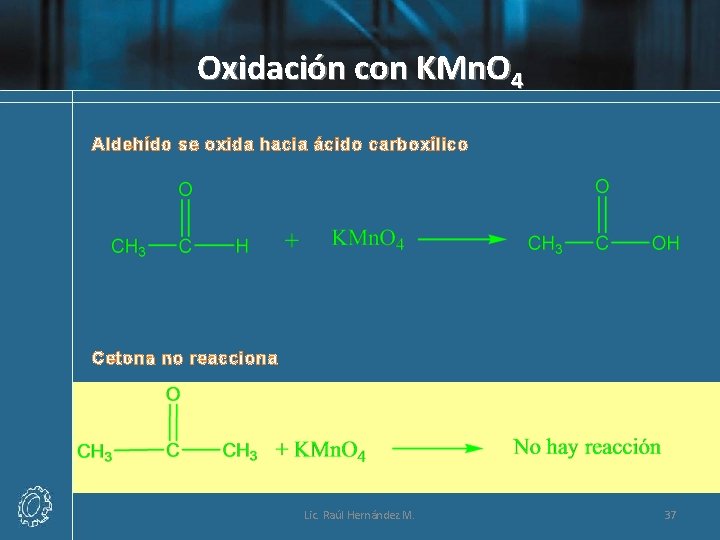
Oxidación con KMn. O 4 Aldehído se oxida hacia ácido carboxílico Cetona no reacciona Lic. Raúl Hernández M. 37

Oxidación con Reactivo de Tollens Los aldehídos se oxidan y producen un espejo de plata Cetonas no reaccionan con Tollens Lic. Raúl Hernández M. 38

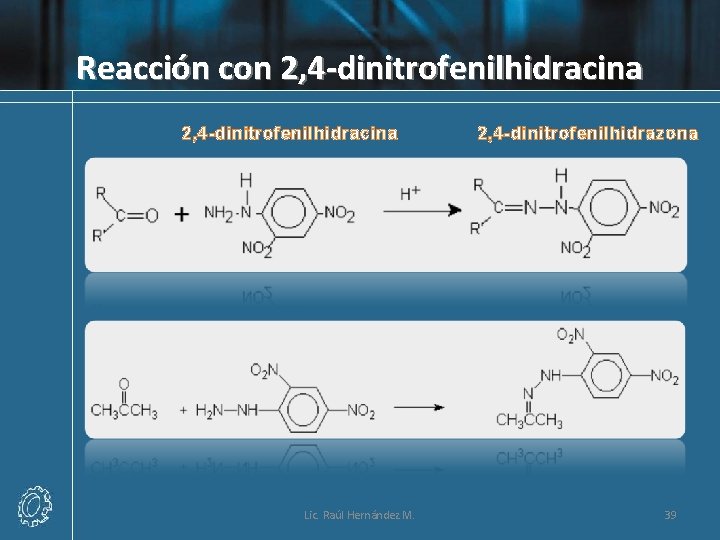
Reacción con 2, 4 -dinitrofenilhidracina Lic. Raúl Hernández M. 2, 4 -dinitrofenilhidrazona 39

Usos de aldehídos • Los usos principales de los aldehídos son: la fabricación de resinas, plásticos, solventes, tinturas, perfumes y esencias. • Los dos efectos más importantes de los aldehídos son: narcotizantes e irritantes. • El glutaraldehído se usa como: desinfectante en frío y el curtido de pieles. Es causante de dermatitis alérgicas. • El formaldehido se usa en: a) Fabricación de plásticos y resinas. b) Industria fotográfica, explosivos y colorantes c) Como antiséptico y preservador. Lic. Raúl Hernández M. 40

Usos de las cetonas • Como disolventes para: lacas, barnices, plásticos, caucho, seda artificial, colodión, etc. • Las cetonas (ácido betahidroxibutírico, ácido acetoacético y acetona) son los productos finales del metabolismo rápido o excesivo de los ácidos grasos. Como sucede con la glucosa, las cetonas están presentes en la orina cuando los niveles sanguíneos sobrepasan cierto umbral. Lic. Raúl Hernández M. 41
 Miguel hernndez
Miguel hernndez Mario hernndez
Mario hernndez Miguel hernndez
Miguel hernndez Induccin
Induccin Introduccin
Introduccin Introduccin
Introduccin Introduccin
Introduccin Introduccin
Introduccin Introduccin
Introduccin Dialquilcuprato de litio
Dialquilcuprato de litio Cetonas alonso formula
Cetonas alonso formula Ester grupo funcional
Ester grupo funcional Isopropilmetilcetona
Isopropilmetilcetona 15 carbonos
15 carbonos Cómo se nombran las cetonas
Cómo se nombran las cetonas Propiedades físicas de cetonas
Propiedades físicas de cetonas Propiedades de las cetonas
Propiedades de las cetonas Usos de las cetonas
Usos de las cetonas Reacción de esterificación de fischer
Reacción de esterificación de fischer Formula del carbonilo
Formula del carbonilo Propiedades físicas de las cetonas
Propiedades físicas de las cetonas Isopropilmetilcetona
Isopropilmetilcetona Características de las cetonas
Características de las cetonas Split plot rak
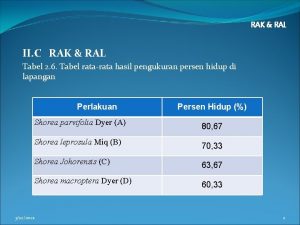
Split plot rak 26000 ral
26000 ral Ral project manager
Ral project manager Ral medicina
Ral medicina Uji bnt ral faktorial
Uji bnt ral faktorial Tabel ral
Tabel ral 112 yanık vaka örnekleri
112 yanık vaka örnekleri Ian ral
Ian ral Dr. ral
Dr. ral Tabel ral
Tabel ral Tuber sufl sesi
Tuber sufl sesi Webral
Webral Isis
Isis Cp ral
Cp ral Zimbra orsay
Zimbra orsay Cloud ral
Cloud ral Varianza poblacional
Varianza poblacional Ral project manager
Ral project manager Teknofest logo png
Teknofest logo png