60 Termoqumica O calor e os processos Qumicos























- Slides: 34

60 Termoquímica: O calor e os processos Químicos Disciplina: Química Professor: Rubens Barreto IV Unidade

A Termoquímica estuda as transferências de calor associadas a uma reação química ou mudanças de estado físico de uma substância

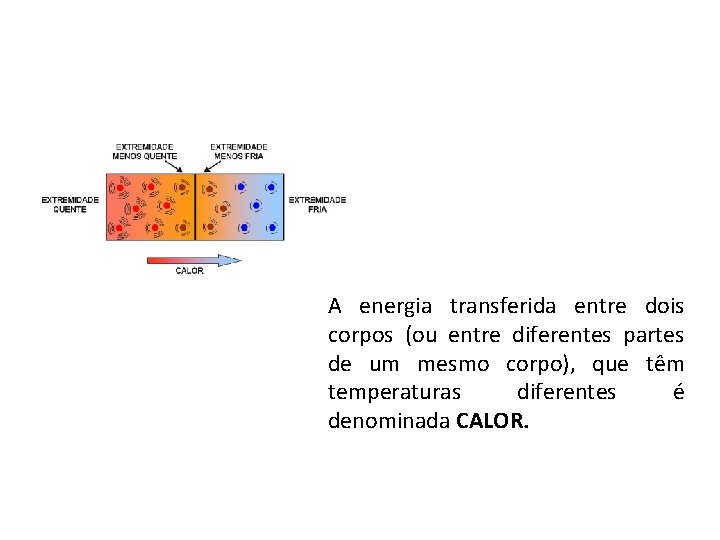
A energia transferida entre dois corpos (ou entre diferentes partes de um mesmo corpo), que têm temperaturas diferentes é denominada CALOR.

Liberam calor para o meio ambiente Absorvem calor do meio ambiente

Medidas de quantidade de calor 1 CALORIA é a quantidade de energia necessária para aumentar de 1 °C a temperatura de 1 g de água. JOULE é a quantidade de energia necessária para deslocar uma massa de 1 kg, inicialmente em repouso, fazendo percurso de 1 metro em 1 segundo. 1 cal = 4, 18 J 1 kcal = 1000 cal 1 k. J = 1000 J

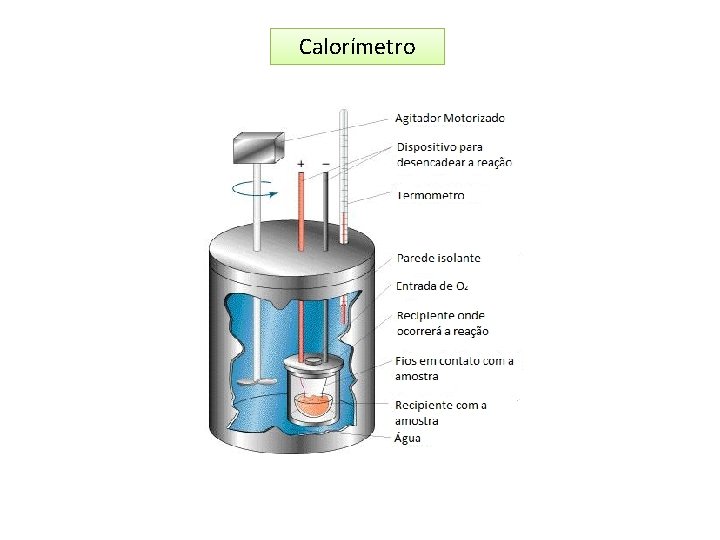
Calorímetro

Exemplos: Transforme 105 cal em J: 1 cal – 4, 184 J 105 cal – x x = 439, 3 J Transforme 80 k. J em kcal: 1 kcal – 4, 184 k. J y – 80 k. J y = 19, 1 kcal

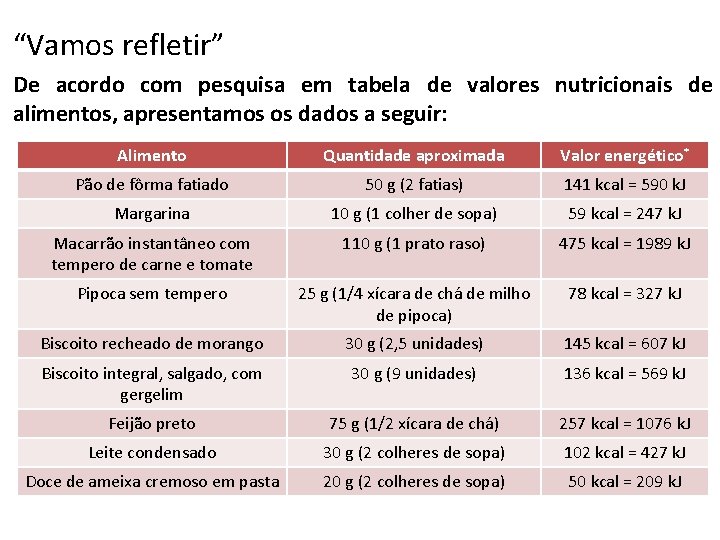
“Vamos refletir” De acordo com pesquisa em tabela de valores nutricionais de alimentos, apresentamos os dados a seguir: Alimento Quantidade aproximada Valor energético* Pão de fôrma fatiado 50 g (2 fatias) 141 kcal = 590 k. J Margarina 10 g (1 colher de sopa) 59 kcal = 247 k. J Macarrão instantâneo com tempero de carne e tomate 110 g (1 prato raso) 475 kcal = 1989 k. J Pipoca sem tempero 25 g (1/4 xícara de chá de milho de pipoca) 78 kcal = 327 k. J Biscoito recheado de morango 30 g (2, 5 unidades) 145 kcal = 607 k. J Biscoito integral, salgado, com gergelim 30 g (9 unidades) 136 kcal = 569 k. J Feijão preto 75 g (1/2 xícara de chá) 257 kcal = 1076 k. J Leite condensado 30 g (2 colheres de sopa) 102 kcal = 427 k. J Doce de ameixa cremoso em pasta 20 g (2 colheres de sopa) 50 kcal = 209 k. J

Com base na tabela anterior, responda: Qual o alimento que libera a maior quantidade de energia por grama? • Pão de fôrma: 141 kcal / 50 g = 2, 82 kcal/g • Margarina: 59 kcal / 10 g = 5, 9 kcal/g • Macarrão instantâneo: 475 kcal / 110 g = 4, 32 kcal/g • Pipoca: 78 kcal / 25 g = 3, 12 kcal/g • Biscoito de morango: 145 kcal / 30 g = 4, 83 kcal/g • Biscoito salgado: 136 kcal / 30 g = 4, 53 kcal/g • Feijão preto: 257 kcal / 75 g = 3, 43 kcal/g • Leite condensado: 102 kcal / 30 g = 3, 40 kcal/g • Doce de ameixa: 50 kcal / 20 g = 2, 5 kcal/g

Entalpia e Variação de Entalpia (∆H) Toda espécie química possui uma energia, que quando medida à pressão constante, é chamada de: ENTALPIA (H) Não é possível calcular a entalpia de um sistema, e sim a sua variação ( ΔH ) ΔH = H final –H inicial

Importância de se conhecer os valores de ∆H - Poder comparar combustíveis quanto à energia que fornecem por unidade de massa ou volume; - Realizar previsões sobre quanto se deve fornecer de energia para que certos processos ocorram; - Avaliar a necessidade de manter certos sistemas refrigerados durante reações exotérmicas para que o calor liberado não cause acidentes, etc.

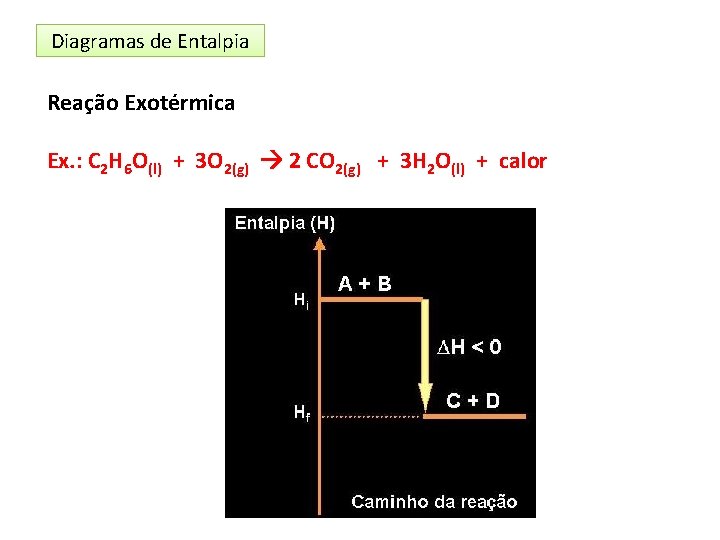
Diagramas de Entalpia Reação Exotérmica Ex. : C 2 H 6 O(l) + 3 O 2(g) 2 CO 2(g) + 3 H 2 O(l) + calor

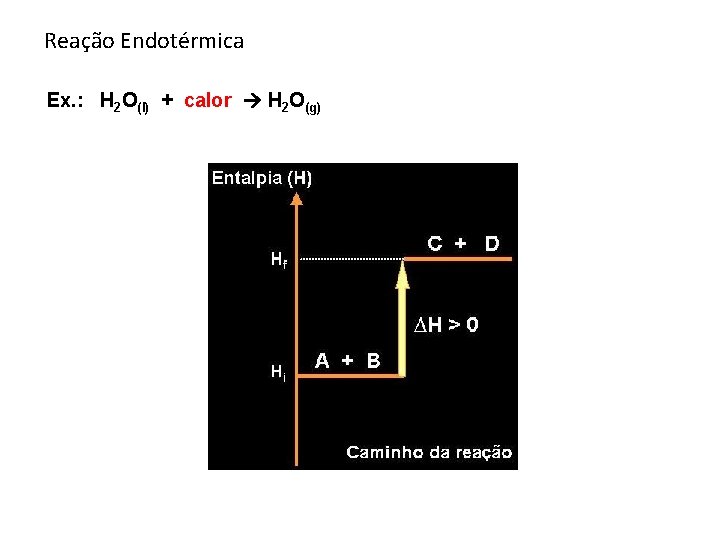
Reação Endotérmica Ex. : H 2 O(l) + calor H 2 O(g)

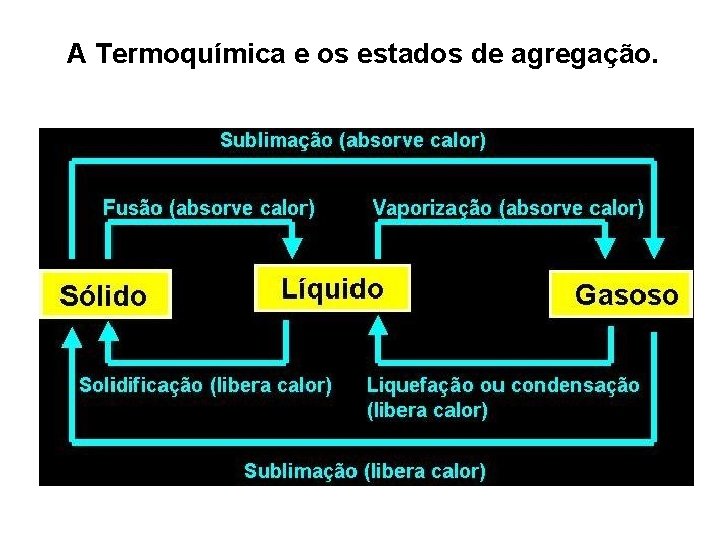
A Termoquímica e os estados de agregação.

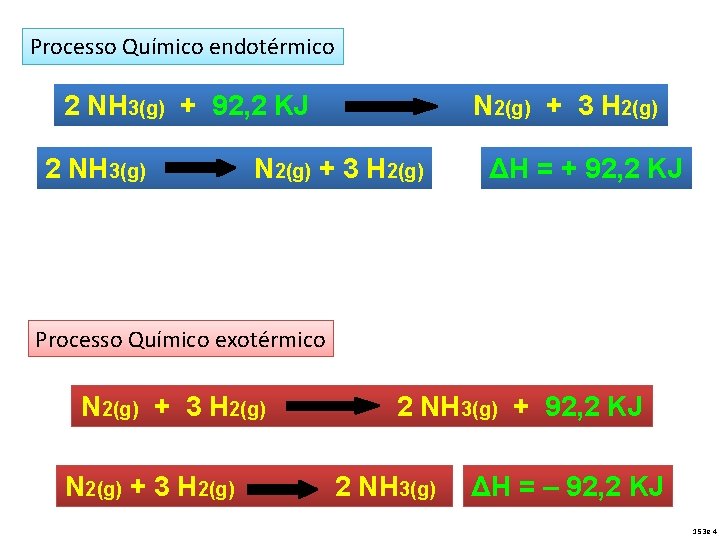
Processo Químico endotérmico 2 NH 3(g) + 92, 2 KJ 2 NH 3(g) N 2(g) + 3 H 2(g) ΔH = + 92, 2 KJ Processo Químico exotérmico N 2(g) + 3 H 2(g) 2 NH 3(g) + 92, 2 KJ 2 NH 3(g) ΔH = – 92, 2 KJ 153 e 4

Equações termoquímicas Para que uma equação termoquímica possa representar de modo completo dados obtidos em laboratório, devem estar presentes as seguintes informações: * Coeficiente estequiométrico de todos os reagentes e produtos * O estado físico * O estado alotrópico * A temperatura (e a Pressão) à qual está submetido o sistema * O ∆H do processo

A lei de Hess permite que se calcule variação de entalpia de reações difíceis de serem efetuadas experimentalmente, no calorímetro. Assim o seu ∆H é determinado indiretamente, por meio da soma adequada de suas equações intermediárias e respectivas entalpias

Considere a reação de combustão de carbono grafite produzindo monóxido de carbono: C(grafite) + ½ O 2(g) → CO(g) ∆H = ? Difícil realização, uma parte do carbono pode ser transformar em CO 2 e a outra ficar sem reagir. Difícil de se determinar o ∆H! Podemos medir no calorímetro, porém, o ∆H das seguintes reações: I) C(grafite) + O 2(g) → CO 2(g) II) CO(g) + ½ O 2(g) → CO 2(g) ∆H = - 393, 5 k. J/mol ∆H = - 283, 0 k. J/mol

invertendo a segunda equação temos que: III) CO 2(g) → CO(g) + ½ O 2(g) ∆H = + 283, 0 k. J/mol Somando as reações I e III temos: C(grafite) + O 2(g) → CO 2(g) ∆H = - 393, 5 k. J/mol CO 2(g) → CO(g) + ½ O 2(g) ∆H = + 283, 0 k. J/mol _____________________ C(grafite) + ½ O 2 (g) → CO(g) ∆H = - 110, 5 k. J/mol ∆Htotal = ∆H 1 + ∆H 2

A variação de entalpia para qualquer processo depende somente da natureza dos reagentes e dos produtos e independe do número de etapas do processo ou da maneira como é realizada a reação.

O Estado-Padrão O estado-padrão de uma substância corresponde a essa substância, em sua forma pura, na pressão de 100 k. Pa e numa temperatura de interesse, geralmente sendo 25°C Quando um valor de ∆H se refere a reagentes e produtos no estado-padrão, esse valor é denominado variação de entalpia-padrão: ∆H°.

Entalpia-Padrão de combustão* variação de entalpia liberada na combustão de um mol de substância, estando todos os participantes no estado padrão – (∆H°c), expresso em k. J/mol. O ∆H°c também é chamado de “calor de combustão” CH 4 (g) + 2 O 2 (g)→ CO 2 (g) + 2 H 2 O (l) ∆H°c = - 890, 8 k. J/mol H 2(g) + ½ O 2(g) H 2 O(l) ∆H°c = - 285, 8 kcal/mol C 2 H 5 OH(l) + 3 O 2(g) 2 CO 2(g) + 3 H 2 O(l) ∆H°c = – 325 kcal/mol

Os valores de ∆H°c são usados juntamente com a Lei de Hess, para determinar o ∆H° de outras reações. C 2 H 4 (g) + H 2 (g) → C 2 H 6 (g) H° = ? Utilizando as seguintes entalpias-padrão de combustão: C 2 H 4(g) + 3 O 2(g) → 2 CO 2 (g) + 2 H 2 O(l) H 2 (g) + ½ O 2 (g) → H 2 O(l) HC° = -1411, 2 k. J/mol HC° = - 285, 8 k. J/mol C 2 H 6(g) + 7/2 O 2(g) → 2 CO 2 (g) + 3 H 2 O(l) HC° = -1560, 7 k. J/mol

Aplicando a Lei de Hess, soma-se as três equações, tomando o cuidado de inverter a terceira C 2 H 4(g) + 3 O 2(g) → 2 CO 2 (g) + 2 H 2 O(l) H 2 (g) + ½ O 2 (g) → H 2 O(l) H 1° = -1411, 2 k. J/mol H 2° = - 285, 8 k. J/mol 2 CO 2 (g) + 3 H 2 O(l) → C 2 H 6(g) + 7/2 O 2(g) H 3° = +1560, 7 k. J/mol _____________________________ C 2 H 4 (g) + H 2 (g) → C 2 H 6 (g) H° = H 1° + H 2° + H 3° H° = -136, 3 Kj/mol. H° = H°

Entalpia-Padrão de formação O H° para a formação de uma substância exclusivamente a partir de reagentes que sejam substâncias simples - todas no estado padrão, no estado físico e na variedade alotrópica mais estáveis - é denominado Entalpia-Padrão de formação ( Hf°) da substância, geralmente expressão em k. J/mol (ela também é chamada de calor de formação). 2 C (graf. ) + 3 H 2(g)+ ½ de O 2(g) → C 2 H 6 O (l) Hf° = -277, 6 k. J/mol A entalpia-padrão de formação de algumas substâncias é nula*. Enquanto que a transformação de uma forma alotrópica em outra o valor de Hf° 0. 69

De posse dos valores de Hf° dos participantes de uma reação, pode-se determinar o H° dessa reação. C 2 H 4 (g) + H 2 (g) → C 2 H 6 (g) H° = ? Sendo conhecidos os seguintes valores de Hf°: 2 C (graf. ) + 2 H 2(g) → C 2 H 4 (g) H 2(g) → H 2 (g) 2 C (graf. ) + 3 H 2(g) → C 2 H 6 (g) Hf°= + 52, 4 k. J/mol Hf°= 0 Hf°= - 84, 0 k. J/mol Invertendo a primeira equação e somando à terceira chegamos à equação problema:

C 2 H 4 (g) → 2 C (graf. ) + 2 H 2(g) Hf°= - 52, 4 k. J/mol 2 C (graf. ) + 3 H 2(g) → C 2 H 6 (g) Hf°= - 84, 0 k. J/mol _______________________ C 2 H 4 (g) + H 2 (g) → C 2 H 6 (g) H° = - 136, 4 k. J/mol H° = n. H(produtos) – n. H(reagentes) n= coeficiente estequiométrico

Energia média de ligação – Criado para realizar estimativas de H É a energia média necessária para romper um mol de ligação de uma substância no estado gasoso. Ex. Para romper um de ligação H – O são necessárias 110 kcal. Para romper um de ligação H – C são necessárias 100 kcal. Para romper um de ligação O = O são necessárias 118 kcal. A quebra de uma ligação é um processo endotérmico. A formação de uma ligação é um processo exotérmico. 71

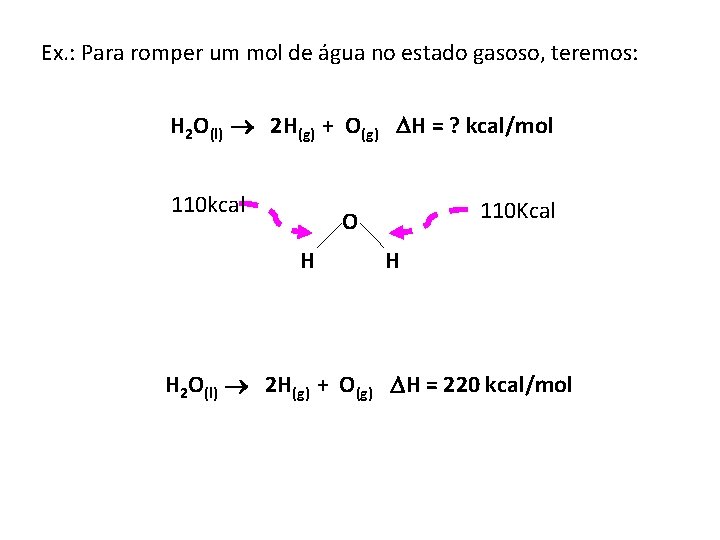
Ex. : Para romper um mol de água no estado gasoso, teremos: H 2 O(l) 2 H(g) + O(g) H = ? kcal/mol 110 kcal 110 Kcal O H H H 2 O(l) 2 H(g) + O(g) H = 220 kcal/mol

Observe a reação em que todos os participantes estão no estado gasoso: H | H— C — O — H + 3/2 O 2 O = C = O + 2 H 2 O | H Para romper as ligações atômicas do metanol e do oxigênio, serão absorvidos, para: 1 mol de O — H +464, 0 kj 1 mol de C — O +330, 0 kj 3 mols de C — H 3 (+413, 0 kj) 3/2 mols de O = O 3/2 (+493, 0 kj) TOTAL ABSORVIDO + 464, 0 k. J + 330, 0 k. J + 1239, 0 k. J + 739, 5 k. J + 2772, 5 k. J

Cômputo dos produtos: H | H— C— O — H + 3/2 O 2 | H O = C = O + 2 H 2 O Para formar as ligações do CO 2 e da água, serão liberadas: 2 mols de C = O 2 (-7444, 0 kj) 2 mols de H — O 2 ( - 464, 0 kj) TOTAL LIBERADO -1 488, 0 k. J - 928, 0 k. J -2 416, 0 k. J

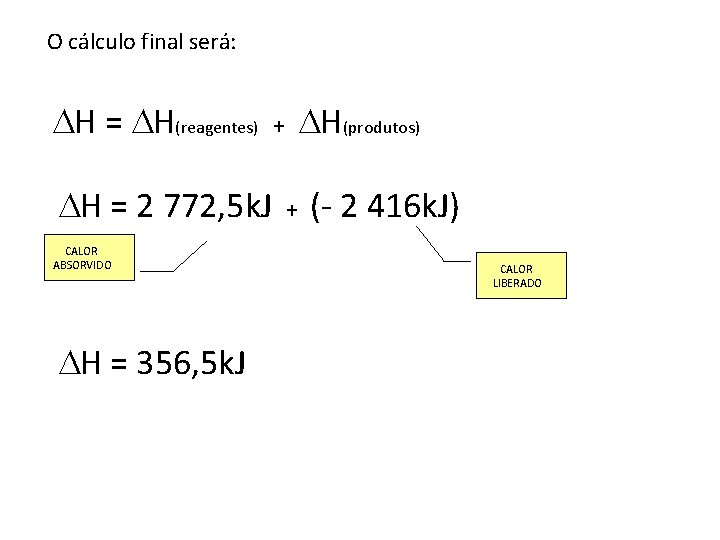
O cálculo final será: H = H(reagentes) H = 2 772, 5 k. J CALOR ABSORVIDO H = 356, 5 k. J + H(produtos) + (- 2 416 k. J) CALOR LIBERADO

Aspectos estequiométricos da termoquímica Exemplo: A entalpia-padrão de combustão do etanol (C 2 H 6 O) líquido é -1367 k. J/mol e sua densidade é 0, 80 g/m. L. Qual a energia liberada na queima de 1, 0 L de etanol? C 2 H 6 O (l) + 3 O 2 (g) → 2 CO 2(g) + H 2 O (l) H = - 1367 k. J/mol Massa energia liberada 46 g ------------------1367 k. J 800 g ----------------- x X = 2, 38. 104 k. J por litro.

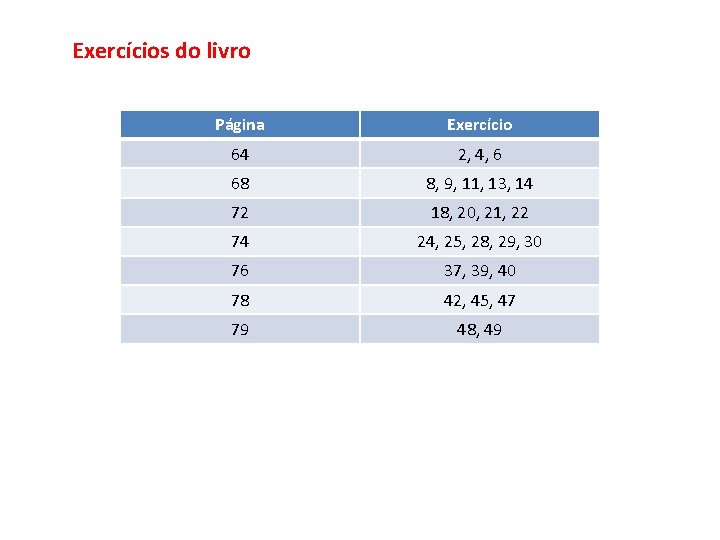
Exercícios do livro Página Exercício 64 2, 4, 6 68 8, 9, 11, 13, 14 72 18, 20, 21, 22 74 24, 25, 28, 29, 30 76 37, 39, 40 78 42, 45, 47 79 48, 49