ZELTLER VE ZNRLK ZELT VE TRLER zeltiler fiziksel


























- Slides: 29

ÇÖZELTİLER VE ÇÖZÜNÜRLÜK

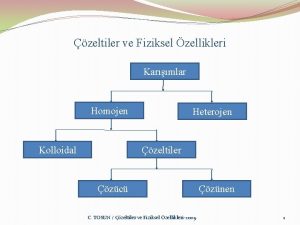
ÇÖZELTİ VE TÜRLERİ Çözeltiler, fiziksel özellikleri her yerinde aynı olan homojen karışımlardır. Bir çözeltide en az iki bileşen vardır. Çözelti içinde miktarı çok olan bileşene "çözücü", miktarı az olan bileşene ise "çözünen“ denir.

Çözücü ve çözünen; katı, sıvı veya gaz olabilir. Buna göre çeşitli çözeltiler hazırlanabilir. Diğer bir ifadeyle, katı, sıvı ve gaz bir maddenin katı, sıvı ve gaz bir madde içerisinde homojen olarak dağılmasıyla çözeltiler oluşur.

ÖRNEKLER Çözücü Çözünen Örnek Çözelti Sıvı Alkollü su (suda alkolün çözünmesi) Sıvı Katı Tuzlu su (suda tuz çözünmesi) Sıvı Gaz Amonyaklı su (suda amonyağın çözünmesi) Katı Sıvı Amalgam (gümüşte civanın çözünmesi) Katı Alaşımlar: Pirinç (bakırda çinkonun çözünmesi) Katı Gaz Palladyumda hidrojenin çözünmesi Gaz Hava: Azotta oksijenin çözünmesi Analitik kimyada genellikle sıvı-sıvı, katı-sıvı ve gaz sıvı çöz. Kullanılır.

ÇÖZELTİ ÇEŞİTLERİ A. DERİŞİME GÖRE ÇÖZELTİLER: 1. Seyreltik Çözeltiler: Çözüneni çok az, çözücüsü fazla olan çözeltilere denir. 2. Derişik Çözeltiler: Çözüneni fazla, çözücüsü az olan çözeltilere denir.

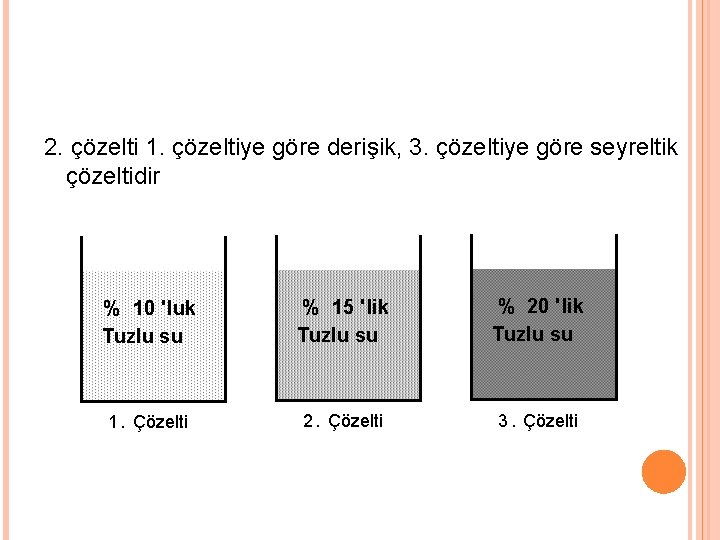
2. çözelti 1. çözeltiye göre derişik, 3. çözeltiye göre seyreltik çözeltidir % 10 'luk Tuzlu su % 15 'lik Tuzlu su % 20 'lik Tuzlu su 1. Çözelti 2. Çözelti 3. Çözelti

B-DOYGUNLUĞA GÖRE ÇÖZELTİLER: 1. Doymuş Çözeltiler: Belli şartlarda, bir çözücüde, çözüne bilen kadar madde çözünmüş ise bu tip çözeltilere Doymuş Çözeltiler denir. 2. Doymamış Çözeltiler: Belli şartlarda, bir çözücüde, çözüne bilenden daha az madde çözünmüş ise bu tip çözeltilere Doymamış Çözeltiler denir. 3. Aşırı Doymuş Çözeltiler: Şartlar değiştirilerek, bir çözücüde çözüne bilenden daha fazla madde çözünmüş ise bu tip çözeltilere Aşırı Doymuş Çözeltiler denir. Aşırı doygunluk hali kararsız hal olup çözeltiyi aşırı doygun hale getiren faktörler ortadan kaldırılırsa, (fazla madde çöker yada uçar) çözelti tekrar doygun hale döner.

AŞIRI DOYMUŞ ÇÖZELTİ NASIL HAZIRLANIR

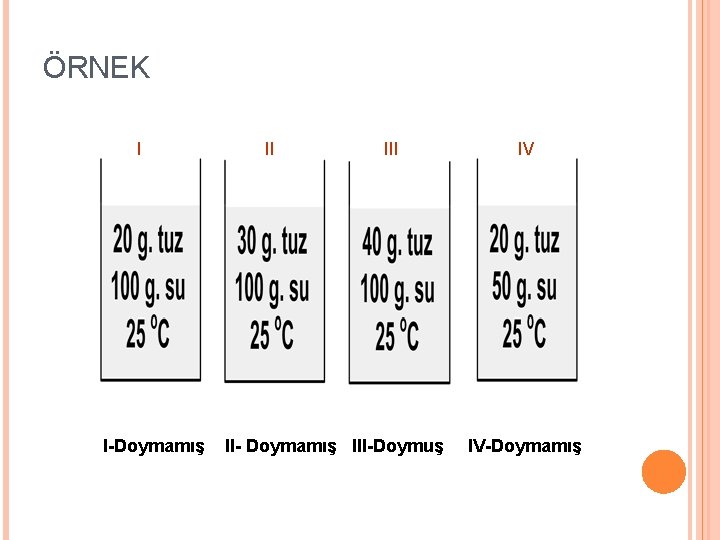
ÖRNEK I I-Doymamış II II- Doymamış III-Doymuş IV IV-Doymamış

C. İLETKENLİĞİNE GÖRE ÇÖZELTİLER: 1. Elektrolit Çözeltiler: Elektrik akımını ileten çözeltilere Elektrolit Çözeltiler denir. Elektrik akımını iyi iletenlere; Kuvvetli Elektrolitler, kötü iletenlere Zayıf Elektrolitler denir.

2. Elektrolit olmayan Çözeltiler: Elektrik akımını iletmeyen çözeltilere Elektrolit Olmayan Çözeltiler denir. ÖRNEK: Şeker suda çözündüğünde moleküler olarak çözünür. Bu sebeple moleküler çözeltiler elektrik akımını iletmezler. Bu tür çözeltilere elektrolit olmayan çözeltiler denir.

DERİŞİM VE BİRİMLERİ Derişimi düşük olan çözeltiler seyreltik çözelti, derişimi yüksek olan çözeltiler ise derişik çözelti olarak bilinir. Ancak bir çözeltide çözünen madde miktarının bilinmesi gerekir.

DERİŞİM Birim hacimde (1 m. L, 100 m. L, 1000 m. L yada 1 Litre) çözünen madde miktarına DERİŞİM (KONSATRASYON) denir. (C) ile sembolize edilir.

Çözünen madde miktarı(m) Derişim = -----------------(C) Çözeltinin Hacmi (V) C = m/V olur. Çözeltideki madde miktarı(m)= C. V Şeklinde hesaplanır.

Bir çözeltide çözünen madde miktarını nasıl ifade ederiz? Bir çözeltide çözünen madde miktarı, kütle, hacim, mol terimlerini içeren çeşitli derişim birimleri ile belirtilir. En çok kullanılan derişim birimleri, yüzde derişim, mol kesri, molarite, normalite, molalite, ppm ve ppb'dir. Şimdi bu birimleri görelim.

YÜZDE DERİŞİM

STANDART ÇÖZELTİLER Derişimi bilinen çözeltilere denir. Bunlar; a)Molar Çözeltiler (M) b)Molal “ (m) c)Normal “ (N) d)Formal “ (F) şeklinde incelenir.

MOLARİTE (M) Bir litre çözeltide çözünen maddenin mol sayısına molarite denir. M ile gösterilir. 1 molar çözelti, 1 litresinde 1 mol çözünen madde içermektedir.

ÖRNEK: 250 ML’SİNDE 5 GR NAOH BULUNAN ÇÖZELTİNİN MOLARİTESİ NEDİR? (NAOH’İN MOL KÜT = 40 GR/MOL) Çözüm: 5 gr Na. OH kaç mol ? n=5/40= 0. 125 mol M=n n = m/Ma dan /V =0. 125 mol / 0. 25 Lt= 0. 5 M (mol/L)

ÖRNEK 2 M 1 litre, 0. 1 M Cu. SO 4 çözeltisini nasıl hazırlarsınız? (Ma Cu. SO 4. 5 H 2 O= 249. 6 gr/mol) Çözüm: Kaç M=n mol Cu. SO 4 eder? / V 0. 1 =n/1 n=X/Ma Cu. SO 4 n=0. 1 mol Cu. SO 4 0. 1=X/159. 6 X=15. 96 gr

MOLALİTE

ÇÖZELTİLERİN SEYRELTİLMESİ

Bir çözeltiye çözücü ilave etmek suretiyle konsantrasyonunu düşürme işlemine seyreltme (dilüsyon) denir. Çözücü ilavesi çözeltinin hacmini değiştirir, çözünmüş madde miktarı değişmez.

SEYRELTME İŞLEMİ NASIL YAPILIR? C 1 x V 1 = C 2 x V 2 eşitliğinden yararlanılır. C 1 : İlk konsantrasyon (seyrelmeden önceki) V 1 : İlk hacim C 2 : Seyrelmeden sonraki konsantrasyon V 2 : Seyrelmeden sonraki hacim (çözelti + çözücü)

SORU: 15 M’lık stok HCl çözeltisinden 50 ml 0. 1 M HCl çözeltisi nasıl hazırlanır ÇÖZÜM: C 1 x V 1 = C 2 x V 2 15 M x ? = 0. 1 M x 50 ml V 1= 0. 33 ml

SORU: 100 m. L 0. 5 N H 2 SO 4 çözeltisine 400 m. L su ilave edildiğinde konsantrasyon ne olur? ÇÖZÜM: C 1 x V 1 = C 2 x V 2 0. 5 N x 100 = ? N x 500 ml C 2= 0. 1 N

ÇÖZÜNME: Bir maddenin bir çözücü (su) içersinde en küçük birimlerine ayrışacak şekilde dağılması işlemine çözünme denir. İyonik yapılı maddeler suda çözündüklerinde iyonlarına kadar ayrışırlar. Na. Cl ----> Na+ + Cl Ca. Cl 2 ----> Ca+2 + 2 Cl- Al. Cl 3 ----> Al+3 + 3 Cl-

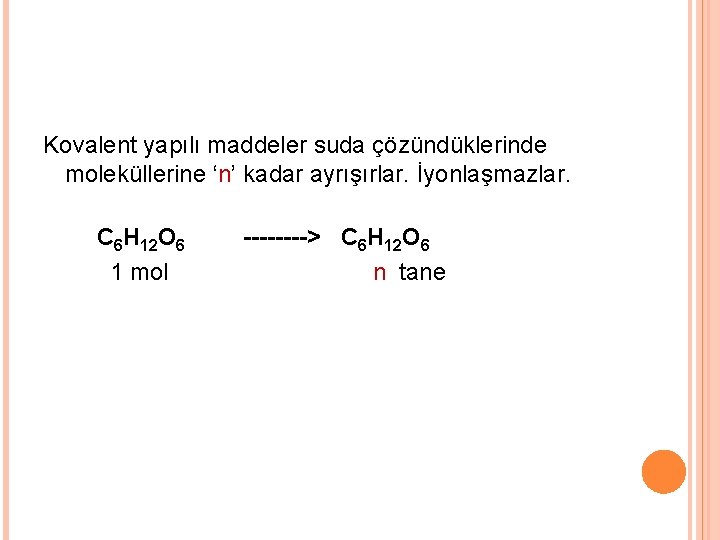
Kovalent yapılı maddeler suda çözündüklerinde moleküllerine ‘n’ kadar ayrışırlar. İyonlaşmazlar. C 6 H 12 O 6 1 mol ----> C 6 H 12 O 6 n tane

ÇÖZÜNME HIZINA ETKİ EDEN FAKTÖRLER: 1. Çözücü Çözünenin Cinsi: Genel olarak benzer maddeler biri içinde daha iyi çözünürler. 2. Temas Yüzeyi: Temas yüzeyinin artırılması çözünme hızını artırır. 3. Karıştırmak: Çözeltinin karıştırılması çözünme hızını artırır. 4. Sıcaklık: Çözeltinin sıcaklığının artırılması maddelerin çözünme hızlarını artırır. Katı ve sıvıların sudaki çözünürlüklerini de artırır. Basınç: Çözeltinin basıncının artırılması gazların hem çözünme hızını, hem de çözünürlüğünü artırır.
 Zelt jelentése
Zelt jelentése Bmh hesaplama formülleri
Bmh hesaplama formülleri Fiziksel risk etmenleri
Fiziksel risk etmenleri Ziraa4
Ziraa4 Kimyasal kirlenme örnekleri
Kimyasal kirlenme örnekleri Fiziksel yanık çeşitleri
Fiziksel yanık çeşitleri Mesleki dermatozlar içinde en sık görüleni
Mesleki dermatozlar içinde en sık görüleni Evrendeki yasalar örnekler
Evrendeki yasalar örnekler Fiziksel zorbalık slogan
Fiziksel zorbalık slogan Slide todoc
Slide todoc Duyum ve algı
Duyum ve algı Fiziksel özellikler
Fiziksel özellikler Zflv ergonomik ayak
Zflv ergonomik ayak Sarı fiziksel etkinlik kartları
Sarı fiziksel etkinlik kartları Lokalize aydınlatma
Lokalize aydınlatma Fiziksel uygunluk ders notları
Fiziksel uygunluk ders notları Fiziksel değişim örnekleri
Fiziksel değişim örnekleri Dosya ve klasörlerin saklanabileceği fiziksel aygıt
Dosya ve klasörlerin saklanabileceği fiziksel aygıt Bürolarda estetik ve fiziksel koşullar
Bürolarda estetik ve fiziksel koşullar Kalıcı dipol
Kalıcı dipol Orta şiddette fiziksel aktivite
Orta şiddette fiziksel aktivite Fiziksel özellik nedir
Fiziksel özellik nedir Ilgi ve yeteneklerimiz fiziksel özelliklerimizdendir
Ilgi ve yeteneklerimiz fiziksel özelliklerimizdendir Allah'ın kulu ve elçisi
Allah'ın kulu ve elçisi Fiziksel aktivite par değerleri
Fiziksel aktivite par değerleri Fiziksel istismar
Fiziksel istismar çözeltilerin fiziksel özellikleri
çözeltilerin fiziksel özellikleri