ZELT ZNME ZELTLER KARIIMLAR ZNME znme olaynda znen














- Slides: 22

ÇÖZELTİ ÇÖZÜNME ÇÖZELTİLER KARIŞIMLAR

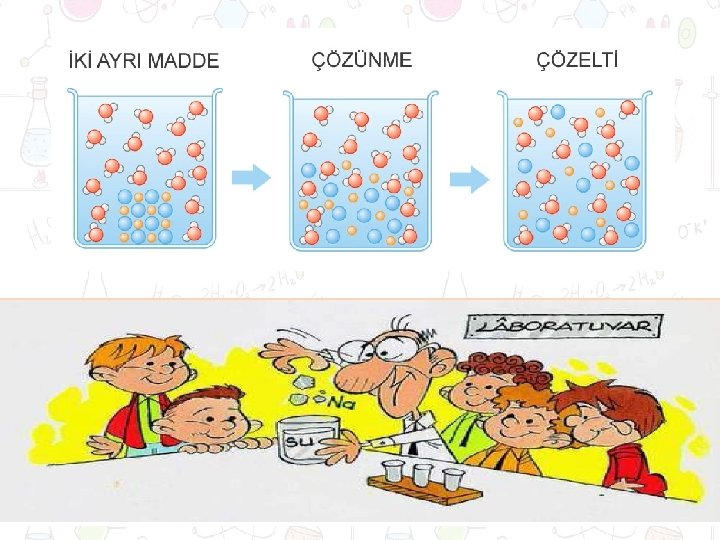
ÇÖZÜNME • Çözünme olayında çözünen ve çözücü olmak üzere iki bileşen vardır. ØÇözünme , bir maddenin bir ortamda atomlar, iyonlar ya da moleküler şeklinde dağılmasına denir.

Gazlı içecekler=gaz+sıvı Hava=gaz+gaz ÇÖZELTİ ü Bir maddenin başka bir madde içerisinde tane boyutu 1 nm’den küçük olacak şekilde dağılması sonucu oluşan karışımdır. Suda Na. Cl çözeltisi Na. Cl(aq)=katı+sıvı Pd içinde H 2(g)=gaz+katı


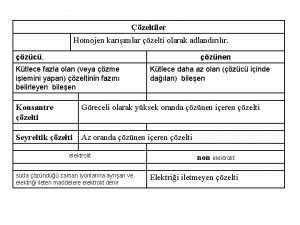
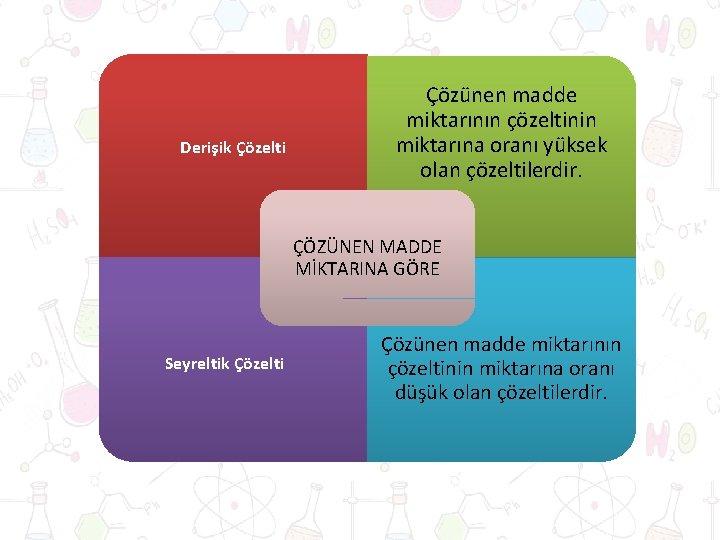
ÇÖZELTİLER ÇÖZÜNEN MADDE MİKTARINA GÖRE ÇÖZÜNÜRLÜĞE GÖRE ELEKTRİK İLETKENLİĞİNE GÖRE

Derişik Çözelti Çözünen madde miktarının çözeltinin miktarına oranı yüksek olan çözeltilerdir. ÇÖZÜNEN MADDE MİKTARINA GÖRE Seyreltik Çözelti Çözünen madde miktarının çözeltinin miktarına oranı düşük olan çözeltilerdir.


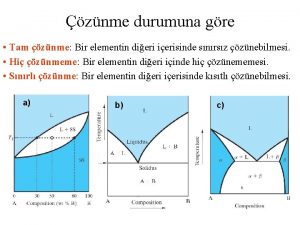
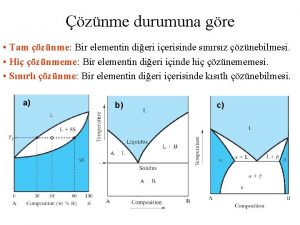
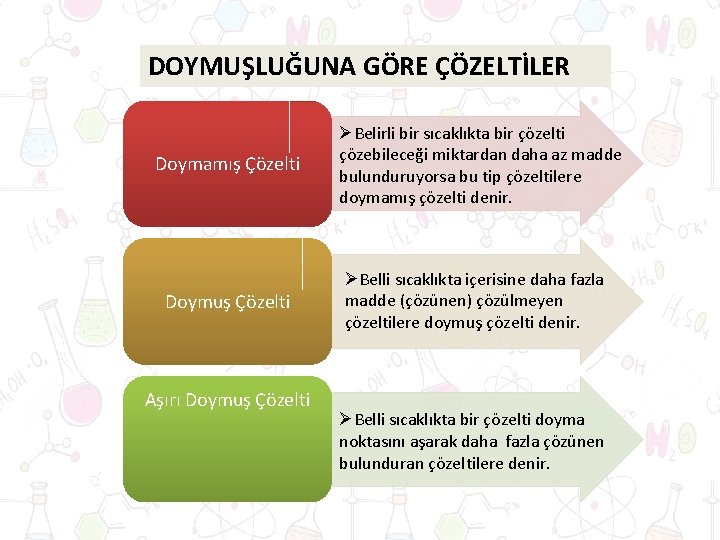
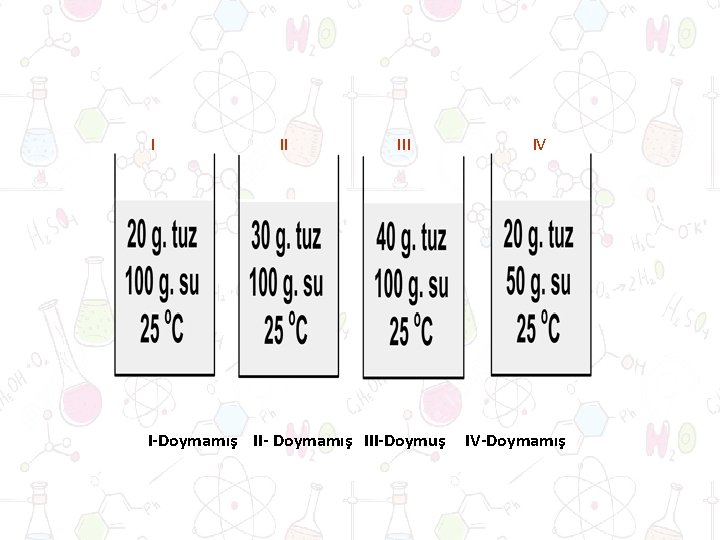
DOYMUŞLUĞUNA GÖRE ÇÖZELTİLER Doymamış Çözelti Doymuş Çözelti Aşırı Doymuş Çözelti ØBelirli bir sıcaklıkta bir çözelti çözebileceği miktardan daha az madde bulunduruyorsa bu tip çözeltilere doymamış çözelti denir. ØBelli sıcaklıkta içerisine daha fazla madde (çözünen) çözülmeyen çözeltilere doymuş çözelti denir. ØBelli sıcaklıkta bir çözelti doyma noktasını aşarak daha fazla çözünen bulunduran çözeltilere denir.

I II I-Doymamış II- Doymamış III-Doymuş IV IV-Doymamış

ELEKTRİK İLETKENLİĞİNE GÖRE Elektrolit Çözeltiler Suda çözününce kısmen veya tamamen iyonlarına ayrışarak elektriği ileten çözeltilere denir. Tuzlar, asitler ve bazların sulu çözeltileri elektrik akımını iletir. Elektrolit Olmayan Çözeltiler Suda çözününce iyonlarına ayrılmayan çözeltilerdir. Şekerli su , alkollü su.

ÇÖZÜNÜRLÜK Belli sıcaklık ve basınçta doymuş çözelti hazırlamak için 100 g suda çözünebilen madde miktarıdır. Doymamış bir çözeltiye doyma noktasına kadar çözünen madde eklenebilir. Aşırı doygun çözeltiler kararsızdır. Bekletildikleri zaman çözeltideki fazla olan madde kristallenerek dibe çöker.

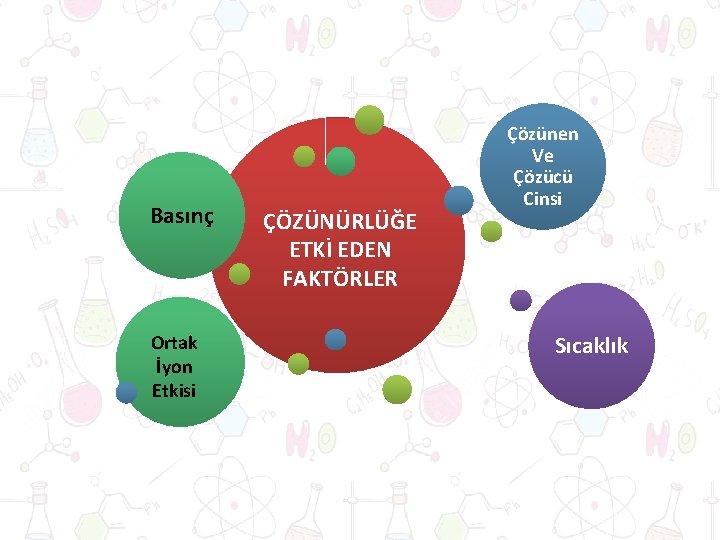
Basınç Ortak İyon Etkisi ÇÖZÜNÜRLÜĞE ETKİ EDEN FAKTÖRLER Çözünen Ve Çözücü Cinsi Sıcaklık

ÇÖZÜCÜ VE ÇÖZÜNEN MADDELERİN CİNSİ Bir çözücüde farklı maddeler ya da bir madde farklı çözücülerde çözülürse çözünürlükleri farklı olur. Bir çözücü molekül yapısı ve elektriksel özellikleri bakımından kendisine benzeyen maddeleri iyi çözer. Su polar bir madde olduğundan polar maddeler için (asit , baz , tuz , alkol …)iyi bir çözücüdür. Apolar yapıdaki N 2 , H 2, CH 4 gibi apolar çözücü olan benzende iyi çözünür.

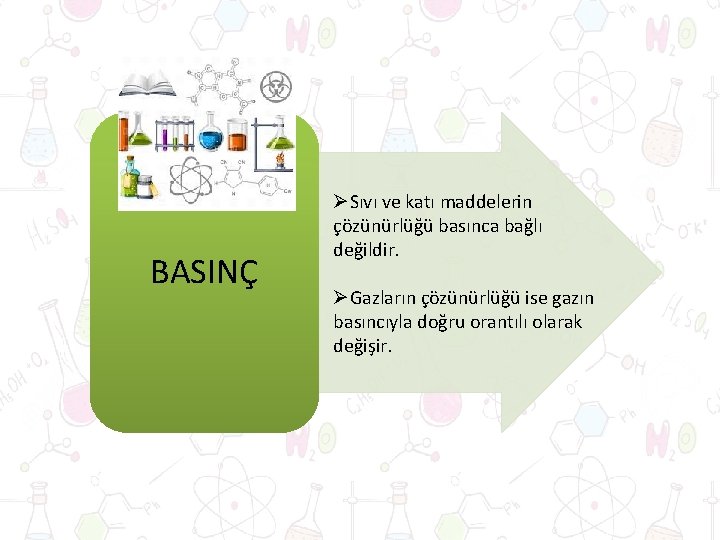
BASINÇ ØSıvı ve katı maddelerin çözünürlüğü basınca bağlı değildir. ØGazların çözünürlüğü ise gazın basıncıyla doğru orantılı olarak değişir.

ORTAK İYON ETKİSİ ØBir madde saf su yerine yapısındaki iyonlardan içeren bir çözeltide çözülürse , çözünürlüğü saf sudakinden az olur. Bu tür çözeltilerde ortak iyon derişimi arttıkça çözünürlük azalır.

ÇÖZÜNME HIZI • Temas yüzeyi arttıkça çözünme hızı artar. • Sıcaklık arttıkça çözünme hızını artar. • Karıştırmak çözünme hızını arttırır.

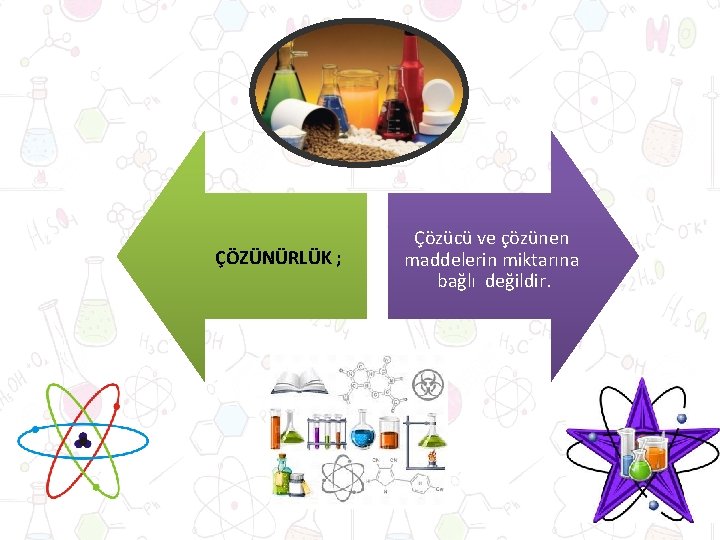
ÇÖZÜNÜRLÜK ; Çözücü ve çözünen maddelerin miktarına bağlı değildir.

ÇÖZÜMLÜ SORULAR 1) 250 m. L’sinde 5 g Na. OH bulunan çözeltinin molaritesi nedir? (Na. OH’in mol küt = 40 g/mol) Çözüm: • 5 g Na. OH kaç mol ? n = m/Ma ‘dan n=5/40= 0. 125 mol • M=n / V =0. 125 mol / 0. 25 L= 0. 5 M (mol/L)

2) 1 litre, 0. 1 M Cu. SO 4 çözeltisini nasıl hazırlarsınız? (Ma Cu. SO 4. 5 H 2 O= 249. 6 g/mol) Çözüm: Kaç mol Cu. SO 4 eder? M=n / V 0. 1 =n/1 n=0. 1 mol Cu. SO 4 n=X/Ma 0. 1=X/159. 6 X=15. 96 g Cu. SO 4

3) 15 M’lık stok HCl çözeltisinden 50 m. L 0. 1 M HCl çözeltisi nasıl hazırlanır? Çözüm: • C 1 * V 1 = C 2 * V 2 • 15 M * ? = 0. 1 M*50 m. L • V 1= 0. 33 m. L

4) 100 m. L 0. 5 N H 2 SO 4 çözeltisine 400 m. L su ilave edildiğinde konsantrasyon ne olur? Çözüm: C 1 * V 1 = C 2 * V 2 0. 5 N * 100 = ? N * 500 m. L C 2= 0. 1 N

TEŞEKKÜRLER NURŞAH DUR