13 ZELTLER zeltilerin zellikleri znme olgusu znme ss







































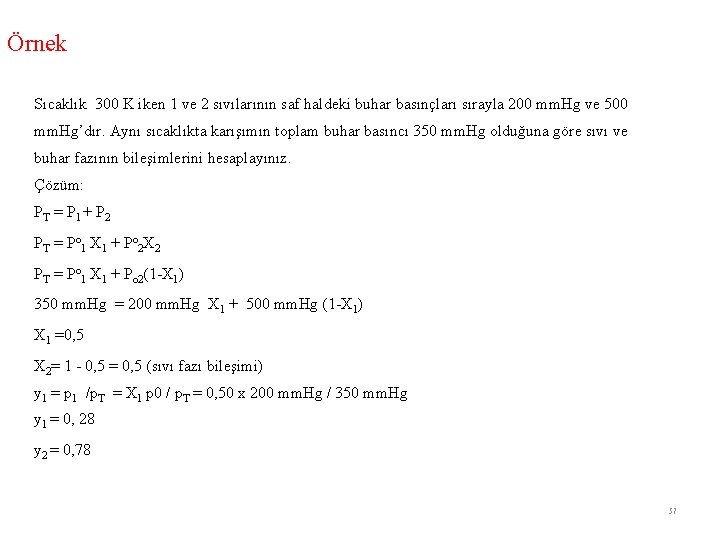


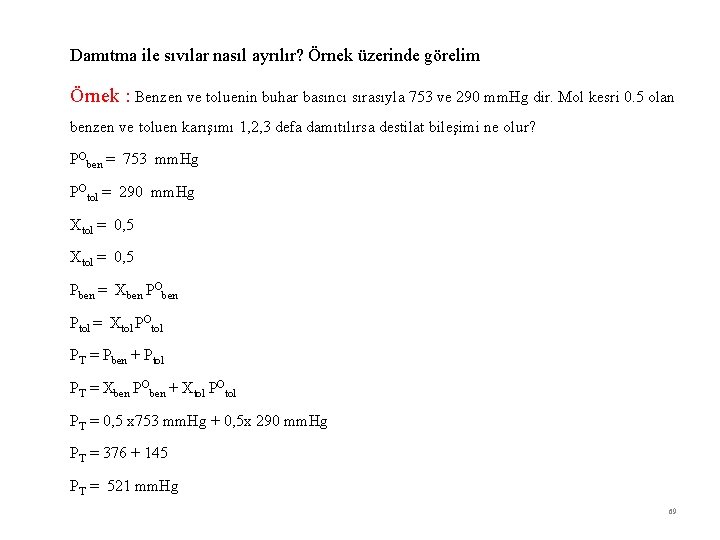















- Slides: 90

13 - ÇÖZELTİLER Çözeltilerin özellikleri, Çözünme olgusu, Çözünme ısısı, Çözünürlük üzerine basıncın etkisi, Çözelti derişimleri; molarite molalite, normalite, çözeltilerin buhar basınçları, raoult yasası, çözeltilerin donma ve kaynama noktaları

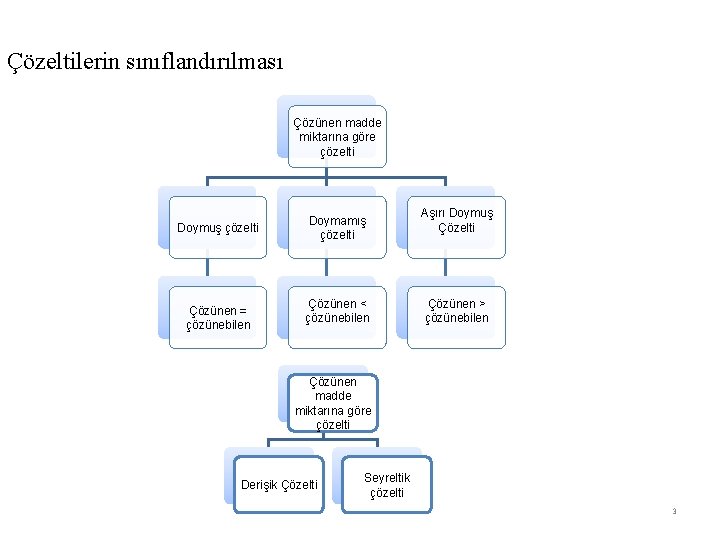
Çözelti ile ilgili bazı kavramlar Çözelti: çözeltiler, fiziksel özellikleri her yerinde aynı olan homojen karışımlardır. Bir çözeltide en az iki bileşen vardır. Çözücü: Çözelti içinde miktarı çok olan bileşene "çözücü", miktarı az olan bileşene ise "çözünen" denir. (Su daima çözücüdür) Çözücü ve çözünen; katı, sıvı veya gaz olabilir. Buna göre çeşitli çözeltiler hazırlanabilir. Çözünürlük: Belli şartlarda belli bir miktar çözeltide (veya çözücüde) en çok çözünebilen madde miktarıdır Derişim: Konsantrasyon, Çözeltideki çözünen maddenin miktarı Derişim Birimleri: Derişimin niteliği, Molarite, narmalite, yüzde, mol kesri vs. Doymuş çözelti : Çözünen = çözünebilen Doymamış çözelti: Çözünen < çözünebilen Aşırı Doymuş Çözelti: Çözünen > çözünebilen 2

Çözeltilerin sınıflandırılması Çözünen madde miktarına göre çözelti Doymuş çözelti Çözünen = çözünebilen Doymamış çözelti Çözünen < çözünebilen Aşırı Doymuş Çözelti Çözünen > çözünebilen Çözünen madde miktarına göre çözelti Derişik Çözelti Seyreltik çözelti 3

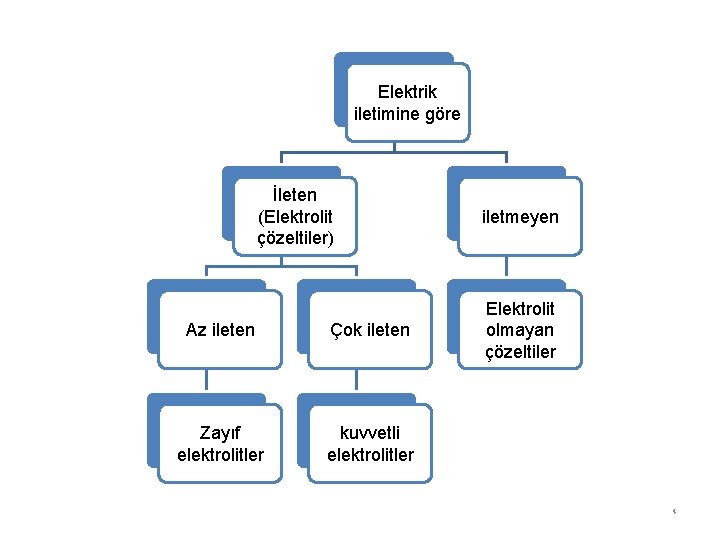
Elektrik iletimine göre İleten (Elektrolit çözeltiler) Az ileten Çok ileten Zayıf elektrolitler kuvvetli elektrolitler iletmeyen Elektrolit olmayan çözeltiler 4

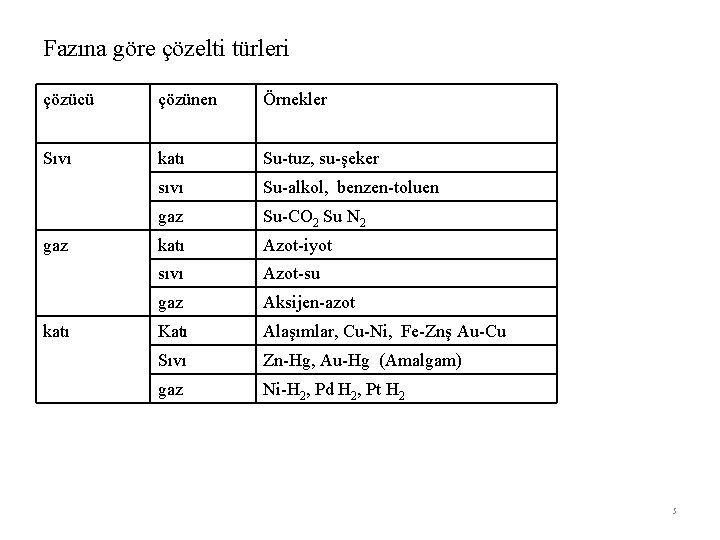
Fazına göre çözelti türleri çözücü çözünen Örnekler Sıvı katı Su-tuz, su-şeker sıvı Su-alkol, benzen-toluen gaz Su-CO 2 Su N 2 katı Azot-iyot sıvı Azot-su gaz Aksijen-azot Katı Alaşımlar, Cu-Ni, Fe-Znş Au-Cu Sıvı Zn-Hg, Au-Hg (Amalgam) gaz Ni-H 2, Pd H 2, Pt H 2 gaz katı 5

Derişimler En çok kullanılan derişim birimleri Molarite : 1000 ml çözeltide çözünen maddenin mol sayısı Normalite: 1000 ml çözeltide çözünen maddenin eşdeğer gram sayısı Formalite: 1000 ml çözeltide çözünen maddenin formül gram sayısı Molalite: 1000 g çözücüde çözünen maddenin mol sayısı Mol kesri: mol sayısının toplam mol sayısına oranı Yüzde (Ağırlıkça W/W) Yüzde (Hacimce V/V) Yüzde (Ağırlık/hacim W/V) Milyonda (ppm) Milyarda (ppb) 6

Molarite SI sistemine göre madde miktarı mol olduğu için derişim olarak da molarite kullanılır Molarite : 1000 m. L çözeltide çözünen maddenin mol sayısıdır. M=n/V M : molarite n : mol sayısı V : hacim (litre olarak) 7

Molar çözeltilerin hazırlanması Saf katı maddelerden Belli yüzdede katı maddelerden Kristal su içeren katı maddelerden Saf sıvılardan Belli yüzdede sıvı maddelerden Derişik çözeltiden Seyreltik çözeltiden İki çözelti karışımından 8

Saf katı maddelerden çözelti hazırlama Soru: 0, 1 M 500 m. L KNO 3 çözeltisi nasıl hazırlanır? M=n/V 0, 1 mol / L = n / 0, 5 L n = 0, 05 mol Mol olarak ölçüm (tartma veya hacim) imkansız O halde grama çevirmeliyiz 1 mol KNO 3 101 g ise 0, 05 mol X ---------------X = 5, 05 g tartılır 500 m. L çözelti hazırlanır. 9

Saf katı maddelerden çözelti hazırlama Önce temiz bir kağıt (köşeleri katlanmış) terazi üzerine konur ve darası alınır. (madde kağıtla etkileşirse beher veya saat camı kullanılır) Daha sonra katı madde spatül ile alınarak 5, 050 g tartılır. Katı madde 500 m. L lik balon jojeye aktarılır (huni veya kağıttan) Üzerine çözünene kadar piset ile destile su eklenir ve karıştırılır. Çözünme tamamlandıktan sonra işaret çizgisine yaklaşınca su ilavesi kesilir. Damlalıkla azar çizgi hizasından bakarak tamamlanır. 10

Belli yüzdede katı maddelerden çözelti hazırlama Soru: 0, 4 M 100 m. L KOH çözeltisi % 85 lik KOH katısından nasıl hazırlanır? M=n/V 0, 4 mol / L = n / 0, 1 L n = 0, 04 mol 1 mol KOH 56 g ise 0, 04 mol X ---------------X = 2, 24 g tartılır 100 g içinde 85 g KOH varsa X g 2, 24 g ----------------X = 2, 65 g tartılır ve 100 m. L çözeltide çözülür. 11

Kristal su içeren katı maddelerden çözelti hazırlama Soru: 0, 2 M 500 m. L Cu. SO 4 çözeltisini Cu. SO 45 H 2 O katısından nasıl hazırlanır? M=n/V 0, 2 mol / L = n / 0, 5 L n = 0, 1 mol Cu. SO 4 1 mol Cu. SO 45 H 2 O içinde vardır. 1 mol Cu. SO 45 H 2 O g ise 249, 5 g 0, 1 mol X ---------------X = 24, 9 g tartılır 500 m. L çözeltide çözülür. 12

Saf sıvılardan çözelti hazırlama Soru: 1 M 100 m. L CH 3 COOH çözeltisi, yoğunluğu 1, 0698 g/m. L olan % 100 lük CH 3 COOH sıvısından nasıl hazırlanır? M=n/V 1 mol / L = n / 0, 1 L n = 0, 1 mol CH 3 COOH 60 g ise 0, 1 mol X ---------------X = 6, 0 g tartılması gerekir ancak sıvılar hacim ölçülerek alınır d=m/V V = m / d = 6, 0 g / 1, 0698 g/m. L = 5, 6 m. L alınır Balona önce az miktarda su konur üzerine asit katılarak çözünür ve 100 m. L ye tamamlanır. Asitin üstüne su dökülmez !!!! 13

Belli yüzdedeki sıvılardan çözelti hazırlama Soru: 1 M 100 m. L HCl çözeltisi, yoğunluğu 1, 18 g/m. L olan % 37 lik (ağırlıkça) HCl kullanılarak nasıl hazırlanır? M=n/V 1 mol / L = n / 0, 1 L n = 0, 1 mol HCl 0, 1 mol 36, 5 g ise X ---------------X = 3, 65 g tartılması gerekir % 100 değil 100 g içinde 37 g HCl varsa Xg 3, 65 g ------------------X = 9, 86 g alınmalı sıvı olduğu için hacim ölçülerek alınır d=m/V V = m / d = 9, 86 g / 1, 18 g/m. L = 8, 36 m. L alınır ve 100 m. L çözeltide çözülür 14

Derişik çözeltiden seyreltik çözelti hazırlama Soru: 2 M HCl çözeltisi kullanarak 0, 5 M 100 m. L çözelti nasıl hazırlanır? M=n/V 0, 5 mol / L = n 1 / 0, 1 L n 1 = 0, 05 mol derişik çözeltiden alınacak miktar n 2 mol n 1 = n 2 olduğundan molarite eşitliğinden n 1 = n 2 M 1 x V 1 = M 2 x V 2 olur 2 M x V 1 = 0, 5 M x 100 m. L V 1 = 25 m. L 2 M HCl alınıp 100 m. L ye tamamlanır. 15

Soru: 6 M 100 m. L HCl çözeltisi, yoğunluğu 1, 18 g/m. L olan % 37 lik (ağırlıkça) HCl kullanılarak nasıl hazırlanır? % 37 lik (ağırlıkça) HCl çözeltisi derişik çözelti kabul edilirse bu çözeltinin derişimi? d = m / V dan 1000 m. L çözelti 1180 g 100 g içinde 37 g HCl varsa 1180 g Xg ------------------X = 436, 6 g alınmalı 1 mol HCl X 36, 5 g ise 636, 6 g HCl ---------------X = 11, 96 mol HCl (1 L çözeltide) o halde M = 11, 96 mol/L 16

M = 11, 96 mol/L M 1 x V 1 = M 2 x V 2 olur 11, 96 x V 1 = 6 M x 100 m. L V 1 = 5, 016 m. L 2 M HCl alınıp 100 m. L ye tamamlanır. 17

İki çözelti karışımından çözelti hazırlama Soru : 0, 5 M Na. Cl ve 0, 1 M Na. Cl çözeltileri kullanılarak 200 m. L 0, 4 M Na. Cl çözeltisi nasıl hazırlanır? 1 çözeltiden n 1 ikinci çözeltiden n 2 mol aldığımızı farzedelim. Bunların toplamı nt = n 1 + n 2 olur molarite denkleminden Mt x Vt = M 1 x V 1 + M 2 x V 2 olur 0, 4 M x 200 m. L = 0, 5 M x V 1 m. L + 0, 1 x (200 –V 1) 80 = 0, 5 V 1 + ( 20 – 0, 1 V 1) 60 = 0, 5 V 1 - 0, 1 V 1 60 = 0, 4 V 1 150 m. L = V 1 V 2 = 50 m. L 18

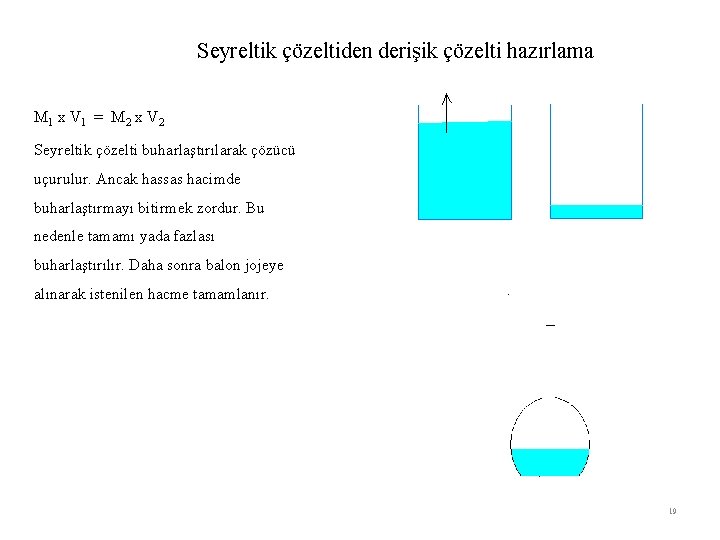
Seyreltik çözeltiden derişik çözelti hazırlama M 1 x V 1 = M 2 x V 2 Seyreltik çözelti buharlaştırılarak çözücü uçurulur. Ancak hassas hacimde buharlaştırmayı bitirmek zordur. Bu nedenle tamamı yada fazlası buharlaştırılır. Daha sonra balon jojeye alınarak istenilen hacme tamamlanır. 19

Normalite: 1000 ml çözeltide çözünen maddenin eşdeğer gram sayısı N = eşdgs / V Eşdgs = g / eşdg Eşdg = molekül kütlesi / tesir değ N = M x Td 20

Tesir değerliği (etki değerliği) Asitlerde: iyonlaşabilen hidrojen iyonu sayısı HCl : 1 H 2 SO 4 : 2 H 3 PO 4 : 3 CH 3 COOH : 1 Bazlarda : iyonlaşabilen hidroksil iyonu sayısı Na. OH : 1 Ca(OH)2 : 2 İyonik bileşiklerde: iyon yükü Na+ : 1 Al 3+ : 3 SO 42 - : 2 Yükseltgenme indirgenme tepkimelerinde: alınan veya verilen elektron sayısı 5 Fe 2+(aq) + Mn. O 4 -(aq) + 8 H+(aq) → 5 Fe 3+(aq) + Mn 2+(aq) + 4 H 2 O Fe 2+(aq) + e → Fe 3+(aq) Td : 1 Mn. O 4 -(aq) + 5 e → + Mn 2+(aq) Td: 5 21

Örnek 500 m. L çözeldide 4, 9 g H 2 SO 4 olacak şekilde hazırlanan çözeltinin normalitesi ve molaritesi nedir? 1 mol H 2 SO 4 : 98 g Td : 2 1 eşdeğergram H 2 SO 4 : 98 g / 2 = 49 g Eşdeğer gram sayısı; 49 g H 2 SO 4 1 eşdeğer gram ise 4, 9 g X ------------------- X = 0, 1 eşdeğer gram Normalitenin tanımından, 500 m. L de 0, 1 eşdeğer gram varsa 1000 m. L X ----------------- X = 0, 2 normal 22

1 mol H 2 SO 4 : 98 g X mol 4, 9 g ---------------- X = 0, 05 mol M = n / V = 0, 05 mol/ 0, 5 L = 0, 1 molar Buradan, N = Td x M olduğu görülür 23

Formalite: 1000 ml çözeltide çözünen maddenin formül gram sayısı F = n / Formül ağırlığı = Molekül kütlesi İyonik katılarda, iyonlaşan çözeltilerde Molarite yerine Formalite kullanılır 1 M Na. Cl çözeltisi 1 M Na+ ve Cl- iyonlarından oluşur (Na. Cl yoktur) o halde 1 F Na. Cl çözeltisi demek daha doğrudur. İyonik katılarda (iyonik ağ örgüsünde) molekül kütlesi anlamsızdır Bunun yerine formül kütlesi kullanılır. 24

Molalite: 1000 g çözücüde çözünen maddenin mol sayısı Molalite sıcaklık değişimine karşı değişmeden kalır. m = n / Kg (çözücü) Soru : 200 g suya 10 g Na. Cl eklenerek hazırlanan çözeltinin molalitesi nedir? 1 mol Na. Cl 58, 5 g X mol 10 g --------------X = 0, 172 200 g çözücüde (suda) 0, 172 mol çözünmüşse 1000 g X ----------------------X =0, 86 m 25

Mol kesri: mol sayısının toplam mol sayısına oranı Soru % 5 lik Glikoz çözeltisinde Glikoz ve suyun mol kesri nedir? 5 g Glikoz + 95 g su C 6 H 12 O 6 : 180 g/mol ng = 5/180 = 0, 028 mol H 2 O : 18 g/mol n. Su = 95 / 18 = 5, 28 mol n. T = 5, 28 + 0, 028 = 0, 11 mol n. T = 5, 56 Xg = ng / ∑n = 0, 028 / 5, 56 = 0, 05 Xsu = nsu / ∑n = 5, 28 / 5, 56 = 0, 95 Bir çözeltide Xa + Xc +… = 1 olur 26

Yüzde çözeltiler Yüze (Ağırlıkça W/W): 100 g çözeltideki çözünen maddenin g miktarı Yüze (Hacimce V/V) : 100 m. L çözeltideki çözünen maddenin m. L miktarı Yüzde (Ağırlık/hacim W/V): 100 m. L çözeltideki çözünen maddenin g miktarı Soru : 200 g % 10 luk Cu. SO 4 çözeltisini Cu. SO 4 5 H 2 O kullanarak nasıl hazırlarsınız? 100 g çözeltide 10 g çözünen olacak (% 10) 200 g X --------------X = 20 g Cu. SO 4 5 H 2 O Cu. SO 4 249, 5 g 159, 5 X 20 g ---------------------X = 31, 28 g Cu. SO 4 5 H 2 O Su = 168, 72 g su 27

ppm ve ppb ppm : Milyonda bir. 1000 g çözeltide çözünen maddenin mg sayısı Çözelti su ise ppm çok seyreltik olduğu için ve dsu = 1 alınarak ppm : 1000 m. L çözeltide çözünen maddenin mg sayısı ppb : milyarda bir. 1000 g çözeltide çözünen maddenin μg sayısı Çözelti su ise ppb : 1000 m. L çözeltide çözünen maddenin μg sayısı 28

Örnek 500 m. L 25 ppm Cu(II) çözeltisi Cu. SO 4 5 H 2 O kullanılarak nasıl hazırlanır? ppm tanımından, 25 ppm demek 1000 m. L de 25 mg Cu(II) var demektir. O halde 500 m. L X -------------- X = 12, 5 mg = 12, 5 10 -3 g Cu(II) Cu. SO 4 5 H 2 O Cu 249, 5 g 63, 5 g X 12, 5 10 -3 g -------------------X = 0, 049 g Cu. SO 4 5 H 2 O g tartılır ve 500 m. L çözeltide çözülür. 29

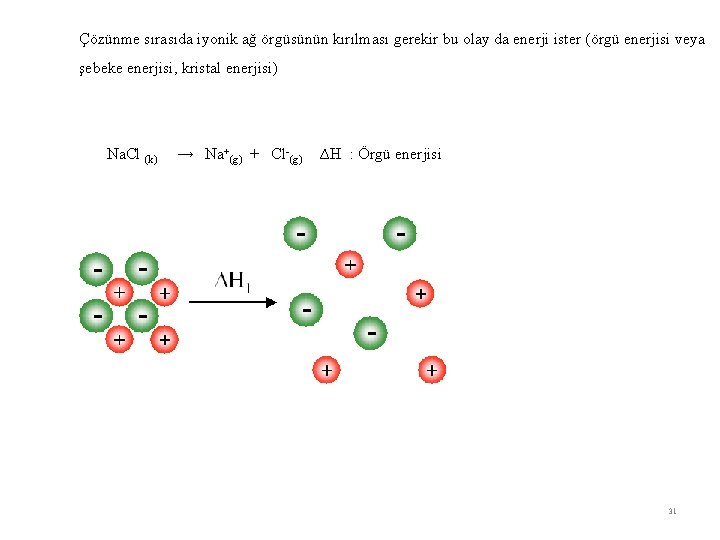
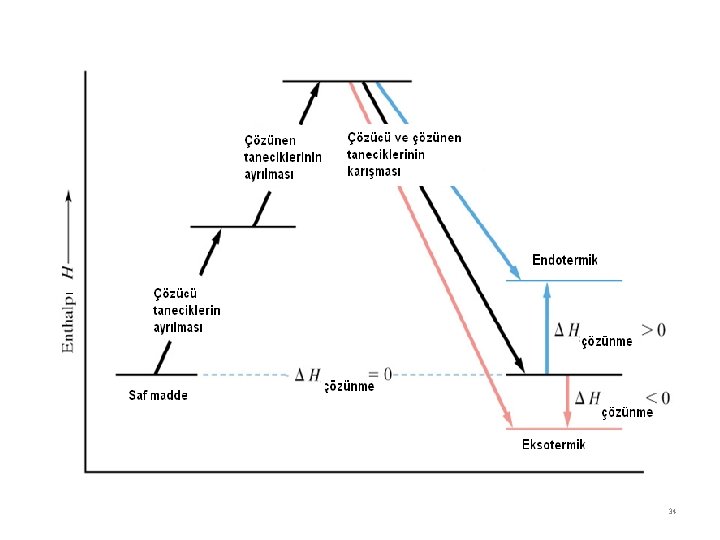
Çözünme ve enerji Çözünme tanecikler arası kuvvetlerle ilgilidir. Enerji açısından çözünme olayında iki faktör söz konusudur 1 - Çözünme sırasında enerji gerektiren olaylar Katı taneciklerin ayrılması Çözücü taneciklerin yer açması 2 - Çözünme sırasında enerji açığa çıkaran olaylar Çözücü taneciklerinin çözünen tanecikler etrafını sarması İyonik bir maddenin suda çözülmesini örnek vererek açıklayalım. Na. Cl, KCl, Li. F gibi maddelerin katıları iyonik ağ örgüsüne sahiptir. 30

Çözünme sırasıda iyonik ağ örgüsünün kırılması gerekir bu olay da enerji ister (örgü enerjisi veya şebeke enerjisi, kristal enerjisi) Na. Cl (k) → Na+(g) + Cl-(g) ∆H : Örgü enerjisi 31

Diğer taraftan çözücü (H 2 O) moleküllerinin içinde iyonik katı çözünmesi için taneciklerin yer açması gerekir. 32

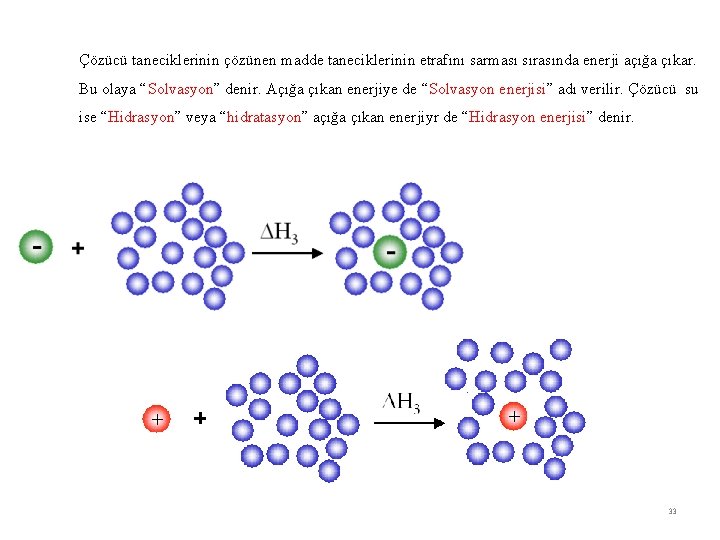
Çözücü taneciklerinin çözünen madde taneciklerinin etrafını sarması sırasında enerji açığa çıkar. Bu olaya “Solvasyon” denir. Açığa çıkan enerjiye de “Solvasyon enerjisi” adı verilir. Çözücü su ise “Hidrasyon” veya “hidratasyon” açığa çıkan enerjiyr de “Hidrasyon enerjisi” denir. 33

34

Isı veren çözünme (ekzotermik) 35

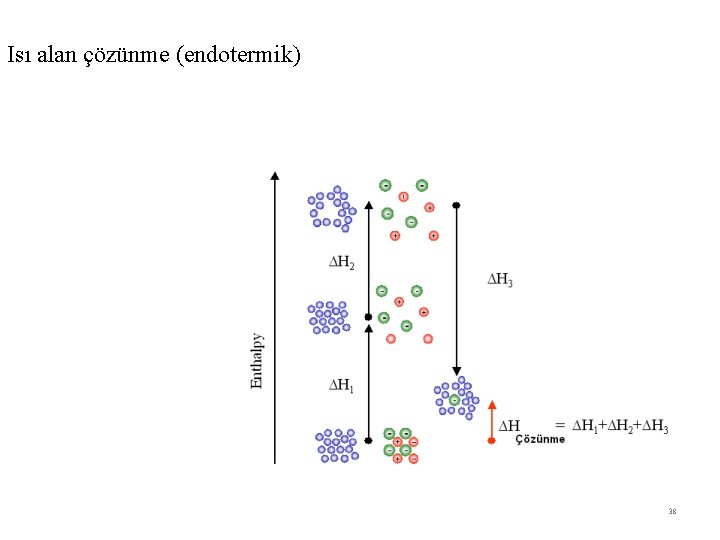
Örnek : 1 Ag. F(k)’ ün suda çözünmesi sırasındaki enerji değişimini inceleyelim Ag. F(k) → Ag+(suda) + F-(suda) ∆H Çözünme Bu olayı iki basamakta aşağıdaki şekilde yazabiliriz Ag. F(k) → Ag+(g) + F-(g) → ∆H Şebeke = 910, 9 kj/mol Ag+(suda) + F-(suda) ∆H Solvasyon = - 931, 4 kj/mol ------------------------------------------------Ag. F(k) → Ag+(suda) + F-(suda) ∆H Çözünme = ∆H Şebeke + ∆H Çözünme ∆H Solvasyon ∆H Çözünme = 910, 9 kj/mol + (- 931, 4 kj/mol) ∆H Çözünme = - 20, 5 kj/mol ∆H 3 > ∆H 1 + ∆H 2 olduğundan çözünme olur 36

Isı alışverişi olmayan çözünme ∆H 3 = ∆H 1 + ∆H 2 ise de çözünme olur Çözeltideki moleküller arasındaki kuvvetler birbirine eşit veya çok yakınsa moleküller her oranda karışır ve homojen hale gelir. Sıvı hidrokarbon karışımları gibi. Benzen –toluen hekzan-heptan Çözeltideki moleküller arasındaki kuvvetler birbirine eşit ise böyle çözeltilere ideal çözeltiler denir. 37

Isı alan çözünme (endotermik) 38

Örnek : 2 Benzer şekilde KCl(k)’ ün suda çözünmesi sırasındaki enerji değişimini inceleyelim KCl(k) → K+(suda) + Cl-(suda) ∆H Çözünme Bu olayı iki basamakta aşağıdaki şekilde yazabiliriz KCl(k) → K+(g) + Cl-(g) → ∆H Şebeke = 701, 2 kj/mol K+(suda) + Cl-(suda) ∆H Solvasyon = - 684, 1 kj/mol -------------------------------------------------KCl(k) → K+(suda) + Cl-(suda) ∆H Çözünme = ∆H Şebeke + ∆H Çözünme ∆H Solvasyon ∆H Çözünme = 701, 2 kj/mol + (- 684, 1 kj/mol) ∆H Çözünme = 17, 1 kj/mol ∆H 3 < ∆H 1 + ∆H 2 ise de çözünme olur. Neden? 39

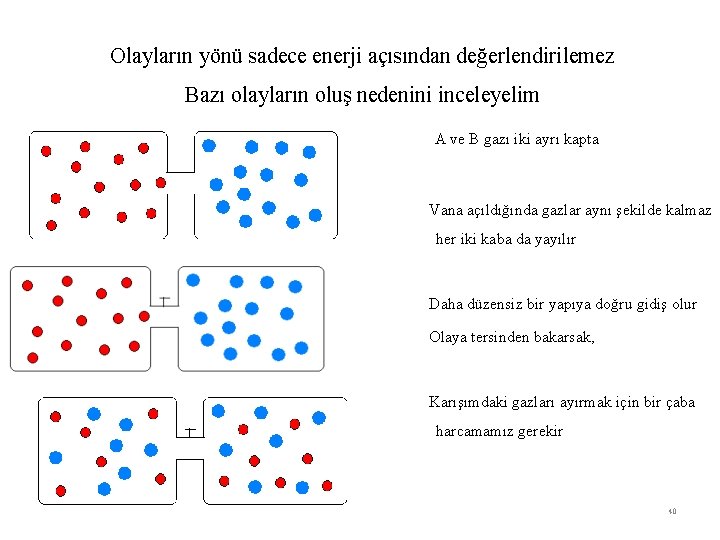
Olayların yönü sadece enerji açısından değerlendirilemez Bazı olayların oluş nedenini inceleyelim A ve B gazı iki ayrı kapta Vana açıldığında gazlar aynı şekilde kalmaz her iki kaba da yayılır Daha düzensiz bir yapıya doğru gidiş olur Olaya tersinden bakarsak, Karışımdaki gazları ayırmak için bir çaba harcamamız gerekir 40

Su bulunan bir behere mürekkep damlatıldığında (karıştırmadan) mürekkep her tarafa yayılır. Olaya tersinden bakarsak, su ve mürekkep karışımında suyu ve mürekkebi ayrı bir yerde tutmak çaba gerektirir 41

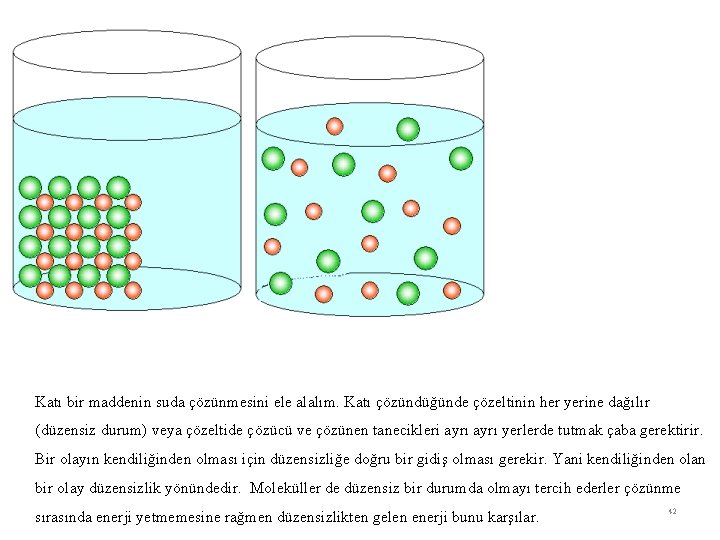
Katı bir maddenin suda çözünmesini ele alalım. Katı çözündüğünde çözeltinin her yerine dağılır (düzensiz durum) veya çözeltide çözücü ve çözünen tanecikleri ayrı yerlerde tutmak çaba gerektirir. Bir olayın kendiliğinden olması için düzensizliğe doğru bir gidiş olması gerekir. Yani kendiliğinden olan bir olay düzensizlik yönündedir. Moleküller de düzensiz bir durumda olmayı tercih ederler çözünme sırasında enerji yetmemesine rağmen düzensizlikten gelen enerji bunu karşılar. 42

Düzensizliğin ifadesi entropi dir. Bir olayın kendiliğinden olması için Düşük enerjili durum (minimum enerji) Düzensiz durum (maksimum düzensizlik) Düşük enerjili durum “Entalpi” (∆H) Maksimum düzensizlik “Entropi” (∆S )ile ifade edilir Bir olayın kendiliğinden olması için; ∆H ↘ mümkün olduğu kadar küçük ∆S ↗ mümkün olduğu kadar büyük olmalı 43

Entalpi (∆H) ve Entropi (∆S ) nin birlikte değerlendirildiği hal fonksiyonu Serbest Enerji (∆G) ile ifade edilir ∆G = ∆H - T∆S T : mutlak sıcaklık ∆G < 0 ise olay kendiliğin olur ∆G = 0 ise dengede ∆G > 0 ise kendiliğinden olmaz, olayın tersi olur Çözünme olaylarında da ∆G < 0 olmalıdır. Yani ∆Gçöz < 0 ise çözünme olur Bu da tanecikler arası etkileşim (kuvvetler) ile ilgilidir. Çözünme olayında genel bir kural, benzeri çözer 44

Gazların çözünürlüğü Gazların sıvılardaki çözünürlüğü sıvı üzerindeki gazın basıncı ile doğru orantılıdır. (Henry kanunu) C = k. Pgaz C : bir gazın bir sıvı içinde belli sıcaklıktaki çözünürlüğü k : orantı katsayısı P gaz : gazın basıncı Sıcaklığın etkisi: Gazların sıvılardaki çözünürlüğü sıcaklıkla ters orantılıdır. Sıcaklık arttıkça çözünürlük azalır. 45

Çözeltilerin Buhar Basınçları Buharlaşma Herhangi bir sıcaklıkta sıvı halden gaz hale geçme 46

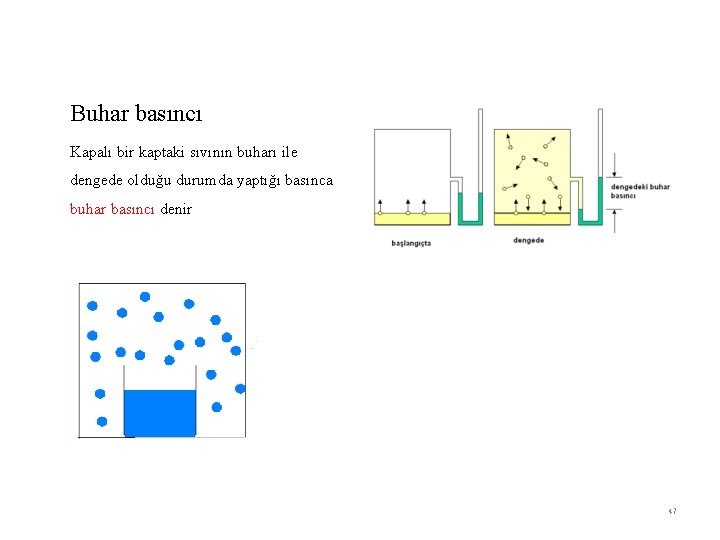
Buhar basıncı Kapalı bir kaptaki sıvının buharı ile dengede olduğu durumda yaptığı basınca buhar basıncı denir 47

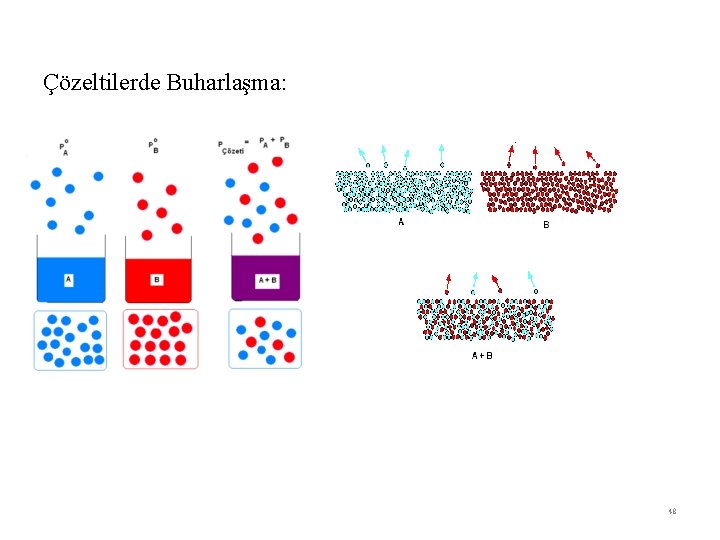
Çözeltilerde Buharlaşma: 48

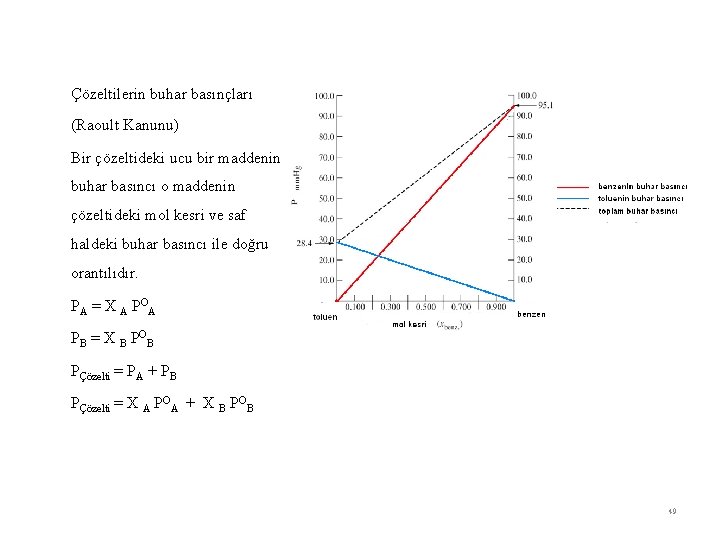
Çözeltilerin buhar basınçları (Raoult Kanunu) Bir çözeltideki ucu bir maddenin buhar basıncı o maddenin çözeltideki mol kesri ve saf haldeki buhar basıncı ile doğru orantılıdır. P A = X A P OA P B = X B P OB PÇözelti = PA + PB PÇözelti = X A POA + X B POB 49

Örnek : Benzen ve Toluenin mol kesirleri 0, 5 olan çözeltide benzenin ve toluenin buhar basıncı nedir? Pobenzen= 95, 1 torr, Po. Toluen= 28, 4 mm. Hg dir. Pben = 0, 5 x 95, 1 = 47, 6 mm. Hg PTo l= 0, 5 x 28, 4 = 14, 2 mm. Hg PTop= 47, 6 + 14, 2 = 61, 8 mm. Hg 50

Çözeltilerin buhar fazında gaz kanunları geçerlidir. Buhar bileşimi: Dalton kısmi basınçlar kanunundan PT = PA + PB ve X’ buhar fazındaki mol kesri olmak üzere PA = X’A PT PB = X’B PT X’A = PA / PT 51

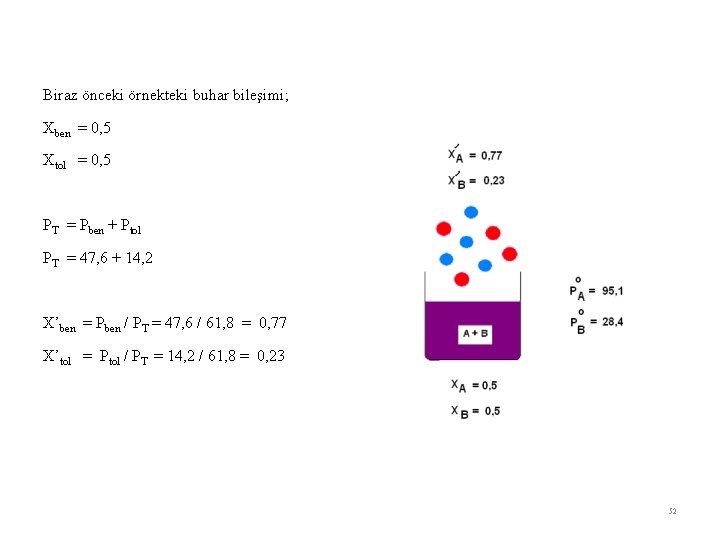
Biraz önceki örnekteki buhar bileşimi; Xben = 0, 5 Xtol = 0, 5 PT = Pben + Ptol PT = 47, 6 + 14, 2 X’ben = Pben / PT = 47, 6 / 61, 8 = 0, 77 X’tol = Ptol / PT = 14, 2 / 61, 8 = 0, 23 52

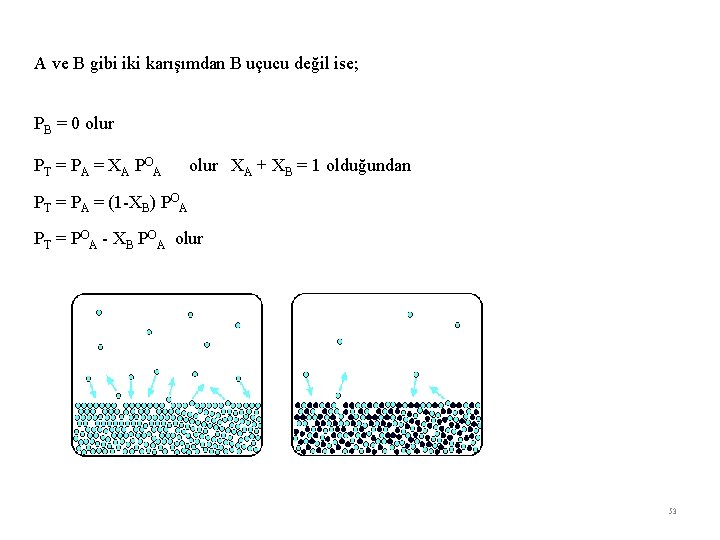
A ve B gibi iki karışımdan B uçucu değil ise; PB = 0 olur PT = P A = X A PO A olur XA + XB = 1 olduğundan PT = PA = (1 -XB) POA PT = POA - XB POA olur 53

Örnek: Heptan ve oktan 40 OC de ideal çözelti oluştururlar. Bu sıcaklıkta heptanın buhar basıncı 0, 121 atm ve oktanın buhar basıncı ise 0, 026 atm dir. 3 mol heptan ve 5 mol oktandan oluşan bir çözeltinin aynı sıcaklıkta buhar basıncı ne olur? Pohep= 0, 121 atm, Pook = 0, 026 atm nhep = 3 mol nok = 5 mol 54

Örnek : Sıcaklıkları 300 C olan saf eter ve saf asetonun buhar basınçları sırayla 646 mm. Hg ve 283 mm. Hg olarak verilmektedir. Sıvı fazda eterin mol kesri 0. 5 ise; a) Herbir bileşenin kısmi basıncını, b) Toplam basıncı, c) Buhar fazının bileşimini bulunuz. Çözüm: a)Etil eteri 1, asetonu ise 2 ile indisleyerek hesaplamaları yapalım: P 1 = X 1 P O 1 P 2 = X 2 P O 2 p 1=0. 50 x (646 mm. Hg) =323 mm. Hg p 2=0. 50 x (283 mm. Hg) =142 mm. Hg b) p=p 1+p 2=323 mm. Hg +142 mm. Hg =465 mm. Hg c) y 1=p 1/p =323 mm. Hg /465 mm. Hg =0. 70 y 2=p 2/p =142 mm. Hg /465 mm. Hg =0. 30 55

Örnek Suyun 50 C’deki buhar basıncı 0. 122 atm’dir. Aynı sıcaklıkta uçucu olmayan bir bileşenin 1. 00 molal sulu çözeltisinin buhar basıncını hesaplayınız. çözüm: Çözeltinin derişiminin 1. 00 m olması 1000 gr suda 1 mol uçucu olmayan bileşenin çözünmesi demektir. Buna göre çözeltinin buhar basıncı p = p 1= p 01 X 1= (0. 122 atm). (1000 gr/ 18 gr mol-1)/{(1000 gr/18 gr mol-1)+(1 mol)} p = (0. 122 atm). 0, 982= 0. 120 atm 56
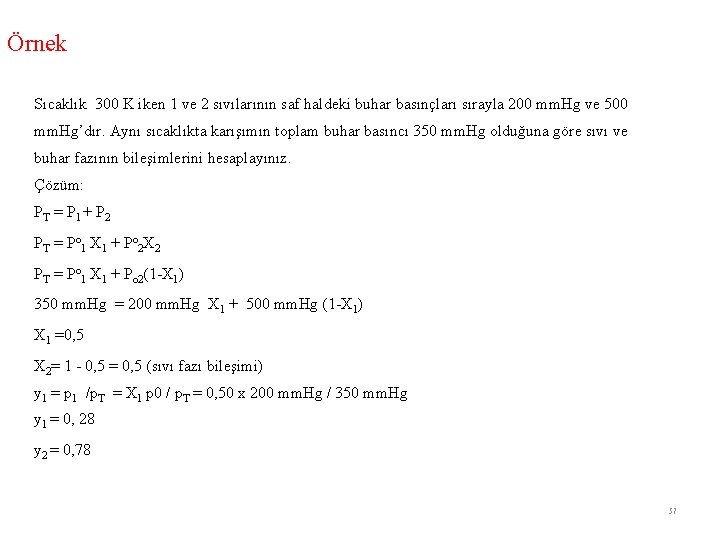
Örnek Sıcaklık 300 K iken 1 ve 2 sıvılarının saf haldeki buhar basınçları sırayla 200 mm. Hg ve 500 mm. Hg’dır. Aynı sıcaklıkta karışımın toplam buhar basıncı 350 mm. Hg olduğuna göre sıvı ve buhar fazının bileşimlerini hesaplayınız. Çözüm: PT = P 1 + P 2 PT = Po 1 X 1 + Po 2 X 2 PT = Po 1 X 1 + Po 2(1 -X 1) 350 mm. Hg = 200 mm. Hg X 1 + 500 mm. Hg (1 -X 1) X 1 =0, 5 X 2= 1 - 0, 5 = 0, 5 (sıvı fazı bileşimi) y 1 = p 1 /p. T = X 1 p 0 / p. T = 0, 50 x 200 mm. Hg / 350 mm. Hg y 1 = 0, 28 y 2 = 0, 78 57

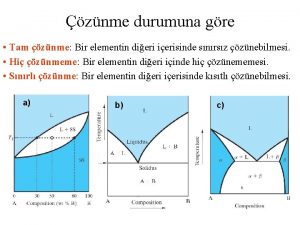
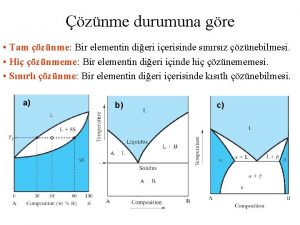
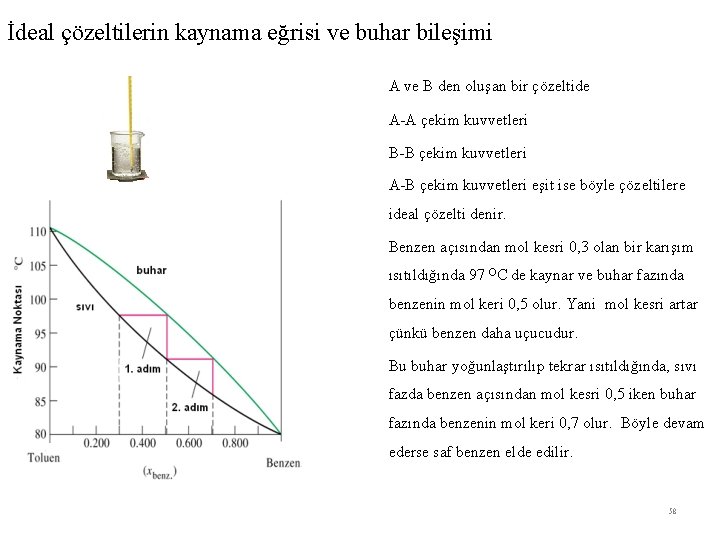
İdeal çözeltilerin kaynama eğrisi ve buhar bileşimi A ve B den oluşan bir çözeltide A-A çekim kuvvetleri B-B çekim kuvvetleri A-B çekim kuvvetleri eşit ise böyle çözeltilere ideal çözelti denir. Benzen açısından mol kesri 0, 3 olan bir karışım ısıtıldığında 97 OC de kaynar ve buhar fazında benzenin mol keri 0, 5 olur. Yani mol kesri artar çünkü benzen daha uçucudur. Bu buhar yoğunlaştırılıp tekrar ısıtıldığında, sıvı fazda benzen açısından mol kesri 0, 5 iken buhar fazında benzenin mol keri 0, 7 olur. Böyle devam ederse saf benzen elde edilir. 58

Raoult Yasasından Sapmalar Bazı çözeltiler Raoult yasasından artı bazıları ise eksi sapmalar gösterirler. İdeal çözeltilerde, A-A = A-B B-B Karışma sırasında ısı alışverişi olmaz Hacim değişimi gözlenmez. Buhar basıncı değişmez Raoult yasasından pozitif (artı) sapma; A-A > A-B B-B A ve B moleküllerinin birbirini iter. Karışma dışarıdan ısı alınır (karışma endotermiktir). Hacim büyür. Buhar basıncı artar 59

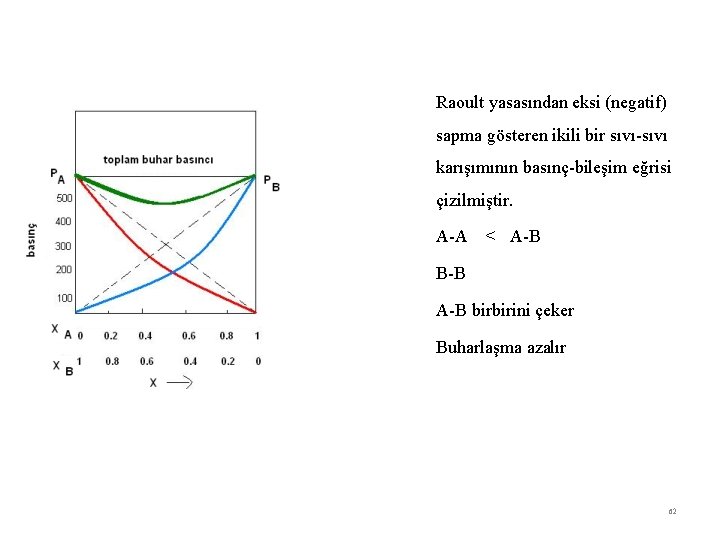
Raoult yasasından negatif (eksi) sapma; A-A < A-B B-B A ve B moleküllerinin birbirini çeker. Karışma dışarı ısı verir (karışma ekzotermik). Hacim küçülür. Buhar basıncı azalır

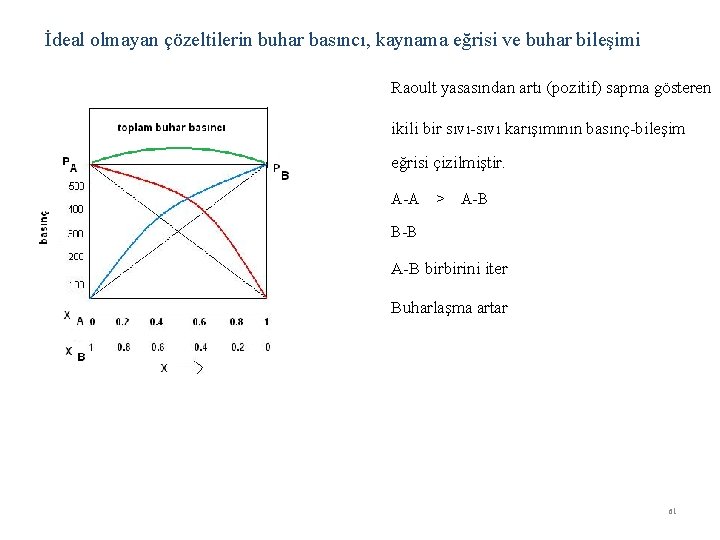
İdeal olmayan çözeltilerin buhar basıncı, kaynama eğrisi ve buhar bileşimi Raoult yasasından artı (pozitif) sapma gösteren ikili bir sıvı-sıvı karışımının basınç-bileşim eğrisi çizilmiştir. A-A > A-B B-B A-B birbirini iter Buharlaşma artar 61

Raoult yasasından eksi (negatif) sapma gösteren ikili bir sıvı-sıvı karışımının basınç-bileşim eğrisi çizilmiştir. A-A < A-B B-B A-B birbirini çeker Buharlaşma azalır 62

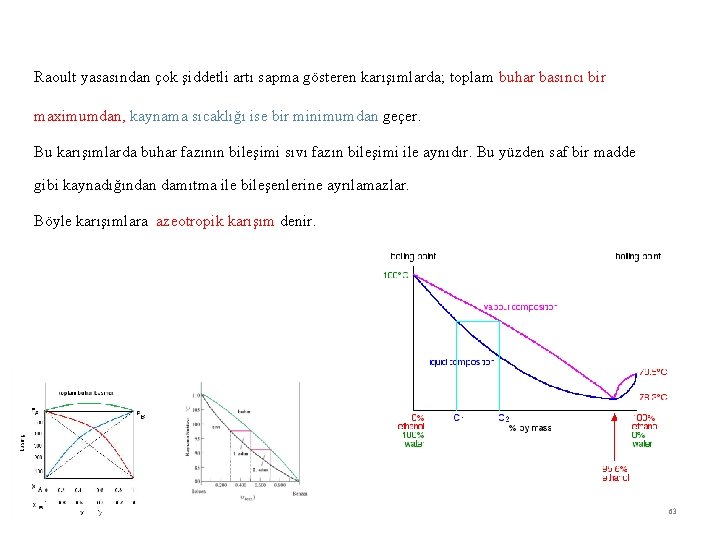
Raoult yasasından çok şiddetli artı sapma gösteren karışımlarda; toplam buhar basıncı bir maximumdan, kaynama sıcaklığı ise bir minimumdan geçer. Bu karışımlarda buhar fazının bileşimi sıvı fazın bileşimi ile aynıdır. Bu yüzden saf bir madde gibi kaynadığından damıtma ile bileşenlerine ayrılamazlar. Böyle karışımlara azeotropik karışım denir. 63

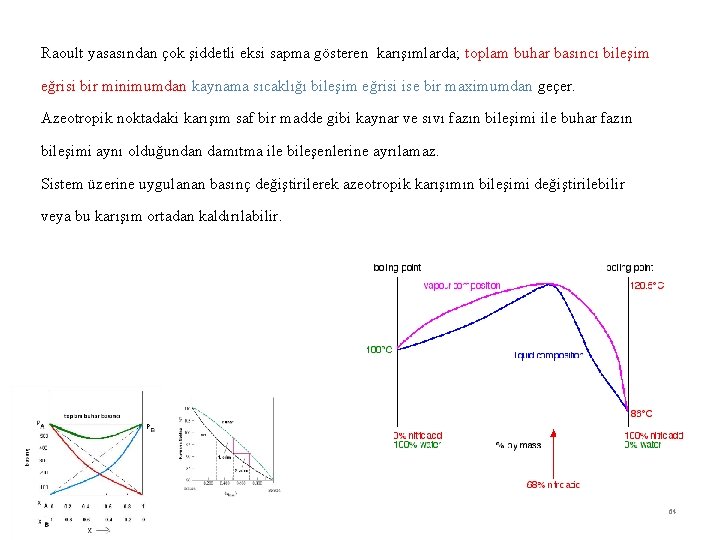
Raoult yasasından çok şiddetli eksi sapma gösteren karışımlarda; toplam buhar basıncı bileşim eğrisi bir minimumdan kaynama sıcaklığı bileşim eğrisi ise bir maximumdan geçer. Azeotropik noktadaki karışım saf bir madde gibi kaynar ve sıvı fazın bileşimi ile buhar fazın bileşimi aynı olduğundan damıtma ile bileşenlerine ayrılamaz. Sistem üzerine uygulanan basınç değiştirilerek azeotropik karışımın bileşimi değiştirilebilir veya bu karışım ortadan kaldırılabilir. 64

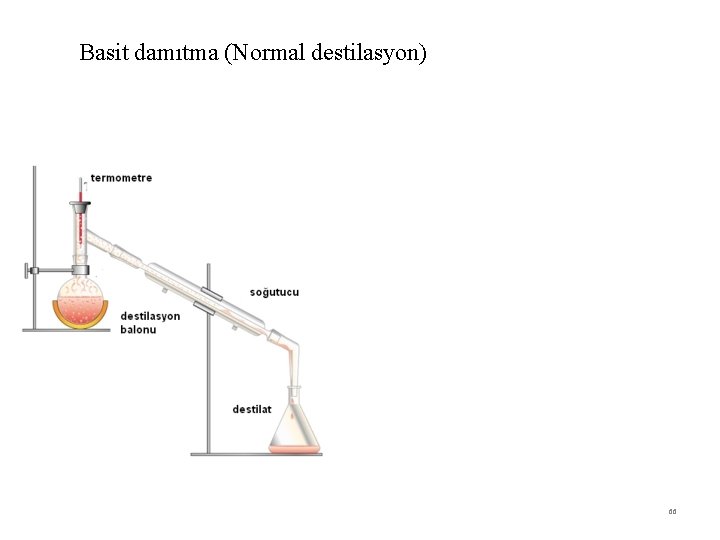
Damıtma ve damıtma çeşitleri 1. Basit Damıtma: Uçucu olmayan maddeler içeren bir sıvının ısıtılması ve buharlarının yoğunlaştırılarak ayrılması Kaynama noktaları çok farklı olan sıvıların ısıtılması ve ayrılması 2. Çok Aşamalı Buharlaştırma: (Fraksiyonlu) normal damıtma düzeneğine fraksiyon kolonu eklenmesi ile oluşur 3. Buhar Damıtması: (su buharı): Ayrılacak karışıma buhar gönderilir ve buharla birlikte sürüklenir. Damıtma, normal kaynama noktasından küçük sıcaklıklarda gerçekleşir. 4. Kuru Damıtma: Katı-Sıvı-Ggaz halinde ürünler veren organik cisimlerin havasız bir yerde ısıtılarak parçalanması işlemidir. (taş kömürünün damıtılması) 65

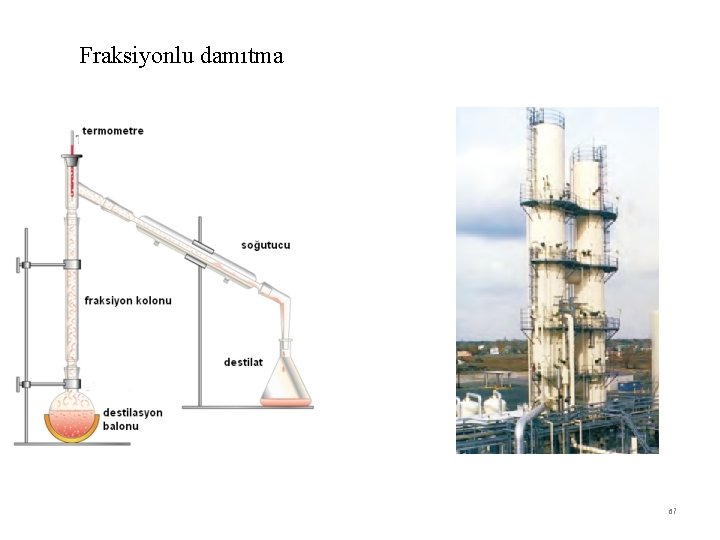
Basit damıtma (Normal destilasyon) 66

Fraksiyonlu damıtma 67

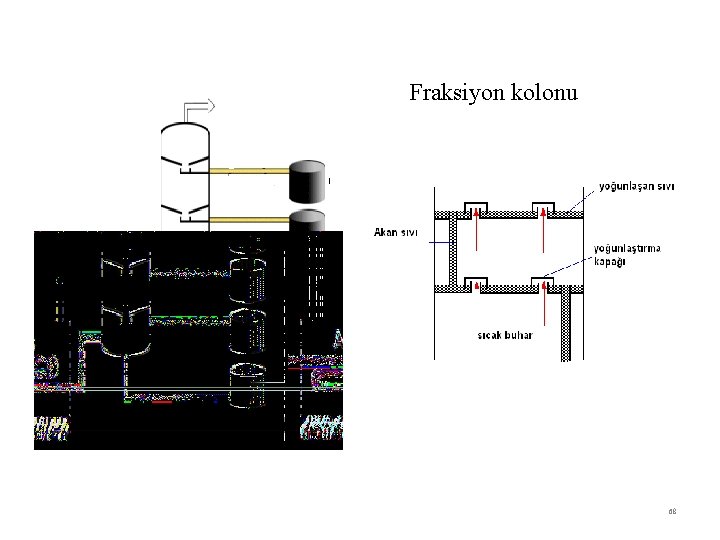
Fraksiyon kolonu 68
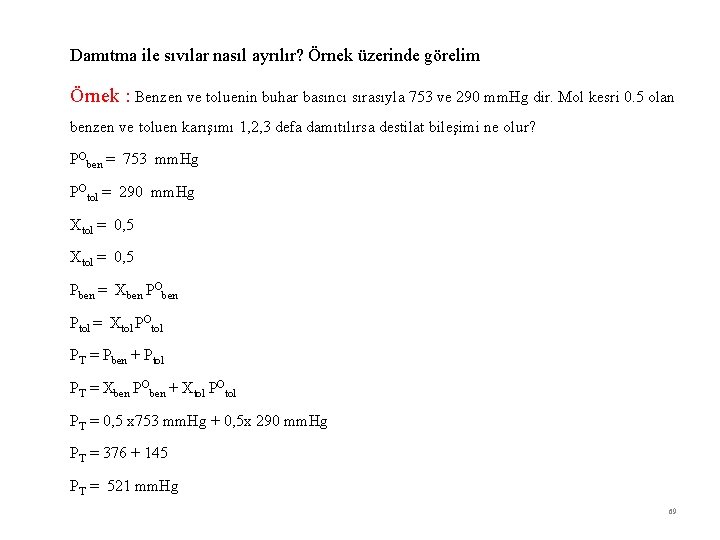
Damıtma ile sıvılar nasıl ayrılır? Örnek üzerinde görelim Örnek : Benzen ve toluenin buhar basıncı sırasıyla 753 ve 290 mm. Hg dir. Mol kesri 0. 5 olan benzen ve toluen karışımı 1, 2, 3 defa damıtılırsa destilat bileşimi ne olur? POben = 753 mm. Hg POtol = 290 mm. Hg Xtol = 0, 5 Pben = Xben POben Ptol = Xtol POtol PT = Pben + Ptol PT = Xben POben + Xtol POtol PT = 0, 5 x 753 mm. Hg + 0, 5 x 290 mm. Hg PT = 376 + 145 PT = 521 mm. Hg 69

Gaz fazı bileşimi Dalton kanunundan; Pi = X'i PT X'i = Pi / PT X'ben = 376 / 521 = 0, 72 X'tol = 145 / 521 = 0, 28 70

İkinci damıtmada; Xben = 0, 72 Xtol = 0, 28 3. Damıtmada; X'ben = 0, 95 X'tol = 0, 05 PT = Pben + Ptol PT = Xben POben + Xtol POtol PT = 0, 72 x 753 mm. Hg + 0, 28 x 290 mm. Hg PT = 542, 1 + 81, 2= 623, 3 mm. Hg Gaz fazı bileşimi Dalton kanunundan; Pi = X'i PT X'i = Pi / PT X'ben = 542, 1 / 623, 3 = 0, 87 X'tol = 81, 2 / 623, 3 = 0, 13 71

A ve B gibi ikili karışımın fraksiyonlu destilasyonunda; α = POA / POB olmak üzere (Uçucu / az uçucu) XAn / 1 - XAn = αn(XA / 1 - XA) eşitliği vardır α : bağıl buharlaşma XAn : n damıtma sonucu destilatın mol kesri XA: Başlangıçtaki çözeltideki mol kesri 72

Örnek Soru : 138 OC de % 25 (mol yüzdesi) p-ksilen ve o-ksilen karışımını % 99, 9 luk yapmak için kaç defa destile edilmelidir? Veya fraksiyon kolonunda kaç tabaka olmalıdır? POp-ksilen = 760 mm. Hg POo-ksilen = 637 mm. Hg XAn / 1 - XAn = αn(XA / 1 - XA) 0, 999 / 1 - 0, 999 = (760/637) n (0, 25 / 1 - 0, 25) 999 = (1, 19) n 0, 333 3000 = 1, 19 n log 3000 = log 1, 19 n log 3000 = nlog 1, 19 3, 47 = n 0, 075 n = 46 damıtma 73

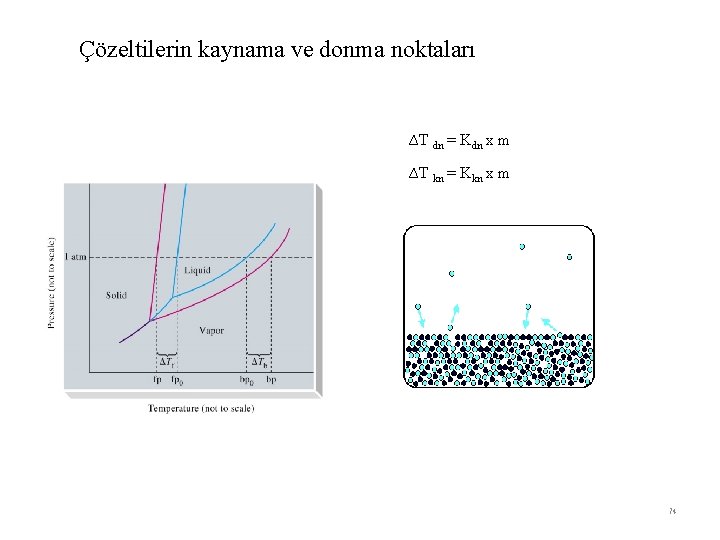
Çözeltilerin kaynama ve donma noktaları ∆T dn = Kdn x m ∆T kn = Kkn x m 74

Kaynama Noktası Yükselmesi Bir çözücüde, uçucu olmayan bir maddenin çözünmesi, onun buhar basıncını düşürür. Çünkü; çözünen madde tanecikleri birim yüzeydeki çözücü taneciklerinin sayısını azaltır. Bu durum çözücünün zor buharlaşmasına neden olur. Buhar basıncının düşmesi de kaynama noktasının yükselmesine sebep olur. . Kaynama noktasındaki yükselme çözeltideki çözünenin derişimi ile orantılıdır. Aşağıdaki bağıntı bu ilişkiyi ifade etmektedir. ∆T kn = Kkn x m m: molalite Kkn : molal kaynama noktası yükselmesi sabiti 75

Donma noktası Alçalması: Donma noktasında katı ve sıvının buhar basıncı eşittir. Sıvı çözücü ile katı çözücünün buhar basıncı eğrileri çözeltinin donma noktasında kesişir. Ancak bu sıcaklıkta çözeltinin buhar basıncı saf çözücünün denge buhar basıncından daha düşüktür. Çözeltinin buhar basıncı eğrisi, katı çözücünün buhar basıncı eğrisini daha düşük bir sıcaklıkta keser. Bu nedenle, çözeltinin donma noktası, saf çözücününkinden daha düşüktür. Aşağıdaki bağıntı bu ilişkiyi ifade etmektedir. ∆T dn = Kdn x m m molalite Kdn molal donma noktası düşmesi sabiti Çözeltilerde kaynama noktası yükselmesi ve donma noktası düşmesi maddenin türüne bağlı değildir. molekül- iyon sayısına bağlıdır. Çözelti içindeki tanecik sayısı toplamı arttıkça kaynama noktası yükselir, donma noktası düşer. Otomobil radyatörlerinin suyuna eklenen C 2 H 4(OH)2 suyun donma noktasını düşürür. Bu da kışın otomobil motorlarının içlerinde donan su ile çatlamasını önler böyle donma noktasını düşürerek donmayı geciktiren maddelere antifiriz denir. 76

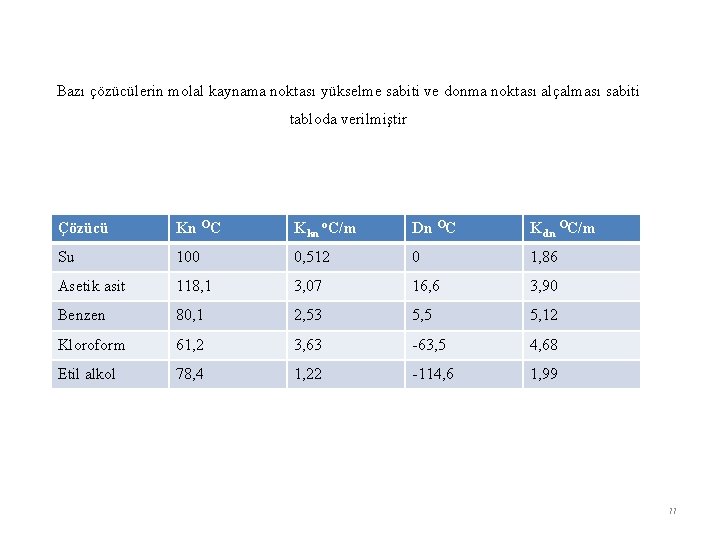
Bazı çözücülerin molal kaynama noktası yükselme sabiti ve donma noktası alçalması sabiti tabloda verilmiştir Çözücü Kn OC Kkn o. C/m Dn OC Kdn OC/m Su 100 0, 512 0 1, 86 Asetik asit 118, 1 3, 07 16, 6 3, 90 Benzen 80, 1 2, 53 5, 5 5, 12 Kloroform 61, 2 3, 63 -63, 5 4, 68 Etil alkol 78, 4 1, 22 -114, 6 1, 99 77

Örnek Soru: bir çözelti 800 g su ve 5 g üre 5 g glikoz içermektedir. Çözeltinin donma noktasını hesaplayınız. ∆T dn = Kdn x m C 6 H 12 O 6 : 180 g/mol ng = 5/180 = 0, 028 mol CN 2 OH 4 : 60 g /mol nÜ = 5/60 = 0, 083 mol H 2 O : 18 g/mol n. T = 0, 083 + 0, 028 = 0, 11 mol m = 0, 11 / 08 Kg (su) = 0, 14 m ∆T dn = Kdn x m ∆T dn = 1, 86 x 0, 14 = 0, 26 Donma noktası 0, 26 OC azalır Çözeltinin donma noktası = 0 – 0, 26 = -0, 26 OC olur 78

Örnek Soru: 200 g benzende 3, 00 g bir madde çözülerek hazırlanan çözelti 4, 98 OC de donmuştur. Çözünen maddenin mol kütlesi nedir? DN(ben) = 5, 5 1000 g çözücüde 0, 101 mol çözünen var 200 g X ---------------X = 0, 0203 mol OC Kdn(ben) = 5, 12 OC/m ∆T dn = 5, 5 – 4, 98 = 0, 52 OC ∆T dn = Kdn x m 3 g çözünen 0, 0203 mol X 1 mol ---------------X = 147, 78 g 0, 52 = 5, 12 x m m = 0, 101 molalitenin tanımından 79

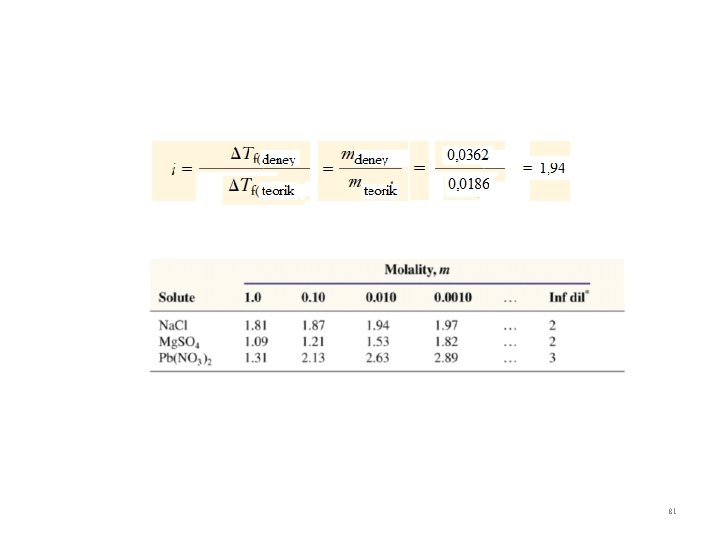
Elektrolit çözeltilerin Kn ve Dn ları Kn yükselmesi ve Dn alçalması maddenin türüne değil sayısına bağlı bir özelliktir. Elektrolit çözeltilerinde tanecik sayısının koligatif özelliklere etkisini bir örnekle inceleyelim. Örnek : 0. 0100 m üre ve 0. 0100 m Na. Cl’ ün sulu çözeltilerinin donma noktaları nedir? ΔTDN = KDN x m = 1. 86°C m-1 x 0. 0100 m = 0. 0186°C İkisi için de -0. 0186°C dir. Ancak deneysel olarak gözlenen Üre için = -0. 0186°C, Na. Cl için = -0. 0361°C dir. Neden? Na. Cl(k) → Na+(suda) + Cl-(suda) Na. Cl suda çözündüğünde iki iyon oluşturur O halde neden iki katı değil? Ölçülen donma noktası ve beklenen donma noktası oranı İ olmak üzere İ = van’t Hoff Faktörü olarak tanımlanır ve İyonlaşma Derecesini ifade eder İ = 1 Elektrolit olmayan Çözeltiler (Üre , Şeker) İ ≠ 1 Elektrolit Çözeltiler 80

81

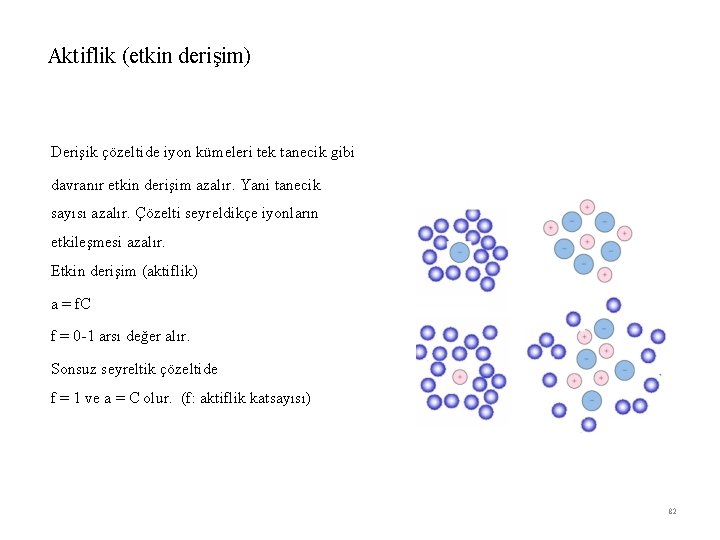
Aktiflik (etkin derişim) Derişik çözeltide iyon kümeleri tek tanecik gibi davranır etkin derişim azalır. Yani tanecik sayısı azalır. Çözelti seyreldikçe iyonların etkileşmesi azalır. Etkin derişim (aktiflik) a = f. C f = 0 -1 arsı değer alır. Sonsuz seyreltik çözeltide f = 1 ve a = C olur. (f: aktiflik katsayısı) 82

Örnek Soru : 0, 02 m HA zayıf asit çözeltisinin donma noktası – 0, 0385 OC dir. Bu asitin iyonlaşma yüzdesi nedir? ∆T teorik = Kdn x m = 1, 86 x 0, 02 = 0, 0372 OC ∆T deney = 0, 0385 OC i = ∆T deney / ∆T teorik = 1, 035 (i toplam iyon sayısını ifade eder) HA == H+ + A- 1 mol HA x kadar iyonlaşırsa toplam iyon 1 -x x + x i = 1 -x + x +x = 1 + x = 1, 035 x = 0, 035 1 mol HA dan 0, 035 iyonlaşırsa 100 X -------------X = % 3, 5 83

Örnek Soru : 0, 125 m ve % 4 iyonlaşabilen HA zayıf asit çözeltisinin donma noktası nedir? % 4 iyonlaşma 1 molekülde 0, 04 olur HA 1 -0, 04 == H+ + A- 1 mol HA x kadar iyonlaşırsa toplam iyon 0, 04 toplam iyon = i = 1 + 0, 04 = 1, 04 olur ∆T teorik = i x m. Kdn = 1, 04 x 0, 125 x 1, 86 OC/m = 0, 2418 OC düşer Dn = 0 – 0 -2418 = - 0, 2418 OC 84

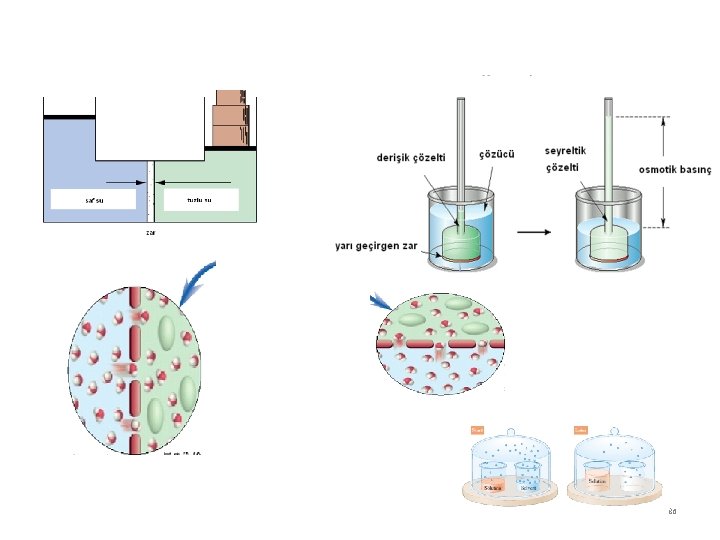
Osmotik basınç Sıvılar, deri, parşömen, polivinilklorür gibi zarlardan sızabilirler (difüzlenirler). Sadece bazı moleküllerin geçmesine izin veren bazı moleküllerin geçmesine izin vermeyen zarlara yarı geçirgen zar adı verilir. Seyreltik bir çözeltiden çözücünün yarı geçirgen zar içinden daha derişik bir çözeltiye geçişine osmoz adı verilir. Osmotik basınç, osmoz olayına zıt ve onu durdurmaya eşit bir dış basınçtır. Burada seviye farkı kadar çözeltinin kütlesi, osmoz olayını durduran dış basınç yani osmotik basınca eşit olur. 85

86

Bir A maddesinin seyrettik bir çözeltinin osmotik basıncı şu şeilde belirtilir. π = MRT =(n/V)RT P = osmotik basınç, atm M: Çözeltinin derişim , mol/L R: Gaz Sabiti, 0. 082 Latm/Kmol T: Mutlak sıcaklık, K n: mol sayısı, mol V: Çözeltinin hacmi, litre Buna göre 0 OC de 1 M çözeltinin osmotik basıncı π = MRT =(n/V)RT = 1 mol/L x 0. 082 atm L /mol K x 273 K = 22, 4 atm Osmotik basınç da koligatif bir özelliktir 87

Ters osmoz ile saf su üretimi

Örnek 100 ml sinde 10 g şeker bulunan bir çözeltinin osmotik basıncı 25 OC de 13, 6 atm gelmektedir. Buna göre şeker molekülünün kütlesi nedir? π = MRT =(n/V)RT = (g/ MA) RT/V 13, 6 atm = (10 g/MA) 0. 082 atm L/mol. K 298 K / 0, 1 L MA = 179, 8 g / mol 89

Kolloit (asıltı) çözeltiler Gözle görülmeyen Bir çok taneciğin bir araya gelmesiboyutları 10 -1000 nm arasında değişen taneciklerin oluşturduğu çözeltilerdir. Çözelti ortamında dayanıklıdır, Normal süzgeç kağıtlarından geçerler Kum 50000 - 200000 nm Koli basili 1500 Grip virüsü 120 Kolloidal kükürt 50 - 500 Hemoglabin 2, 8 Oksijen 0, 16 Kolloitler, Metal: Au, Pd, As, Ametal: S, C, Oksit: Fe 2 O 3 Al 2 O 3 H 2 O, Tuz: Ag. Cl, Ba. SO 4, As 2 S 3 olabilir. 90