Maddenin Yaps ve zellikleri Madde ve zellikleri Ktlesi




































- Slides: 40

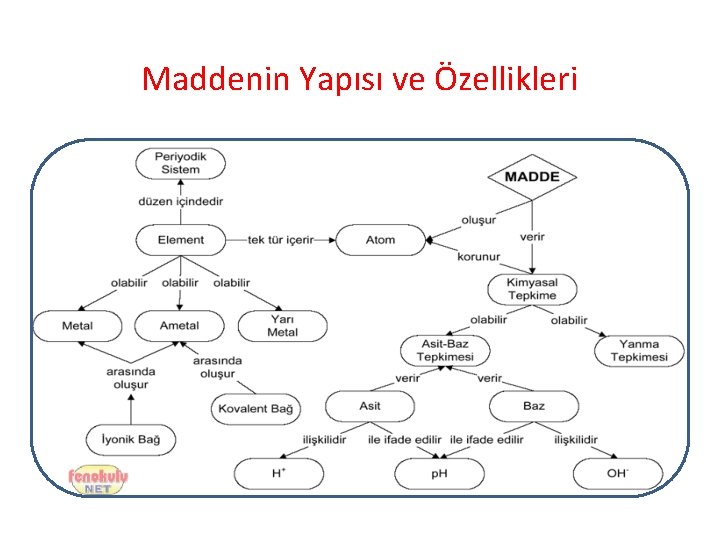
Maddenin Yapısı ve Özellikleri

Madde ve Özellikleri • • Kütlesi hacmi ve eylemsizliği olan her şeye madde denir. Maddenin şekil almış haline cisim denir. Cam bir madde iken cam bardak bir cisimdir. Maddeler doğada katı sıvı gaz halinde bulunabilir.

Madde ve Özellikleri Maddenin Ölçülebilir Özellikleri – Hacim, – Kütle, – Ağırlıktır.

Madde ve Özellikleri Maddenin Görülebilir Özellikleri – – – Yumuşaklık Sertlik Parlaklık Matlık Saydamlık Opaklık • Düzgünlük • Pürüzlülük • Renk • Koku • Tat

Madde ve Özellikleri Maddenin Halleri – Katı maddeler: taş, demir, bakır, altın vb. – Sıvı maddeler: su, petrol, mazot, gaz yağı vb. – Gaz maddeler: su buharı, oksijen, vb.

Madde ve Özellikleri Maddenin Hal Değiştirmesi – Erime – Donma – Buharlaşma – Kaynama – Yoğunlaşma

Madde ve Özellikleri Maddenin Ortak Özellikleri – Kütle – Hacim – Eylemsizlik – Elektrikli yapı Bu Özellikler Madde Miktarına Göre Değişirler

Madde ve Özellikleri • Maddenin Ayırt Edici Özellikleri

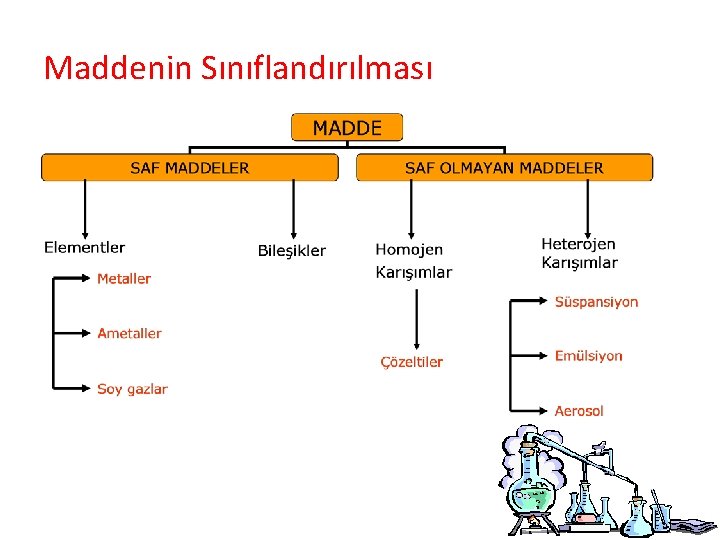
Maddenin Sınıflandırılması

Elementler ve Özellikleri • . . . Aynı. . cins atomlardan oluşan ve herhangi bir yöntemle başka maddelere ayrıştırılamayan maddelere element denir. – Saf maddelerdir. –. Semboller. . . . ile gösterilir. – En küçük yapı taşı, . . . atomdur. . . . – Erime ve kaynama noktaları. . sabittir. . . . – Fiziksel yada kimyasal yöntemlerle daha basit maddelere ayrıştırılamazlar.

Elementler ve Özellikleri • Metallerin özellikleri: 1. Isı ve elektrik akımını iletirler. 2. Oda sıcaklığında katıdır. (Hg hariç). 3. Yüzeyleri parlaktır. 4. Tel ve levha haline getirilebilirler.

Elementler ve Özellikleri • Ametallerin Özellikleri – Elektrik akımını iletmez. – Oda sıcaklığında üç halde de bulunur. – Yüzeyleri mattır. – Kırılgandır. Tel ve levha haline getirilemez.

Elementler ve Özellikleri • Soygazların Özellikleri – Kimyasal reaksiyona girme istekleri yok gibidir. – Hepsi gaz halindedir. – Tabiatta tek atomlu olarak bulunurlar.

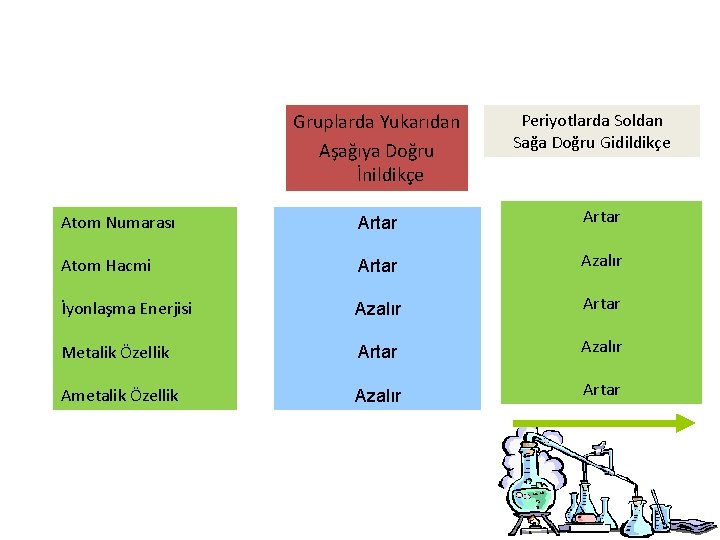
Gruplarda Yukarıdan Aşağıya Doğru İnildikçe Periyotlarda Soldan Sağa Doğru Gidildikçe Atom Numarası Artar Atom Hacmi Artar Azalır İyonlaşma Enerjisi Azalır Artar Metalik Özellik Artar Azalır Ametalik Özellik Azalır Artar


Atom Nedir? • Elementlerin tüm özelliğini gösteren en küçük parçasına atom denir. • Atom kelimesi Yunanca bölünemez anlamına gelen atomos kelimesinden gelir. • Atomlar küre şeklindedir.

Atomun Tarihçesi • DEMOCRİTUS : Maddenin küçük ve bölünemez parçacıklardan oluştuğu fikrini ortaya atan ilk kişi, Yunanlı filozof “Democritus”dur. Democritus’a göre bütün maddeler aynı tür (özdeş) atomlardan oluşuyordu. Maddelerin farklı görünmesinin sebebi, atomların farklı şekilde dizilmesiydi.

Atomun Tarihçesi • JOHN DALTON : İngiliz bilim adamı Dalton’a göre; maddenin en küçük yapı taşı atomdur. Atomlar bölünemez. Bir maddenin bütün atomları aynıdır. Farklı maddelerin atomları da farklıdır. • J. J. THOMSON : Atomun yapısında atomdan daha da küçük parçacıkların olduğunu keşfetti. Yaptığı çalışmalar sonucunda atomu, içinde erik parçacıkları bulunan bir pudinge benzetti.

Atomun Tarihçesi • ERNEST RUTHERFORD : Thomson’un bulduğu küçük parçacıkların atomun içinde değil atom merkezinin (çekirdek) etrafında dolaştığını ileri sürdü. Rutherford atom için geliştirdiği modeli, Güneş’in etrafında dönen gezegenlere benzetti. • NİELS BOHR : Danimarkalı bilim adamı Bohr, elektronların atomun çevresinde belirli yörüngeler izlediğini belirtti.

Atomun Tarihçesi Modern Atom Modeli: – Atomda belirli bir enerji düzeyi vardır. Elektron ancak bu düzeyden birinde bulunabilir. – Elektron bir enerji düzeyindeki hareketi sırasında çevreye ışık yaymazlar.

Atomun Tarihçesi – Atoma iki düzey arasındaki fark kadar enerji verilirse elektron daha yüksek enerji düzeyine geçer. – Atoma verilen enerji kesilirse elektron enerjili düzeyinde kalamaz daha düşük enerji düzeyinden birine geçer. Bu sırada iki düzey arasındaki fark kadar enerjiyi ışık şekline çevreye verir.

Atomun Yapısı • Atomu oluşturan parçacıklar farklı yüklere sahiptir. Atomda bulunan yükler; negatif yükler ve pozitif yüklerdir. • Atomu oluşturan parçacıklar: – Cisimden cisme elektrik yüklerini taşıyan negatif yüklü elektron, – Elektronların yükünü dengeleyen aynı sayıda ama pozitif yüklü olan proton, – Elektrik yükü taşımayan nötr parçacık nötron.

Atomun Yapısı Atom iki kısımdan oluşur : 1. Çekirdek (merkez) 2. Katmanlar (yörünge; enerji düzeyi) – Çekirdek, hacim olarak küçük olmasına karşın, atomun tüm kütlesini oluşturur. Çekirdekte proton ve nötronlar bulunur. Elektronlar ise çekirdek çevresindeki katmanlarda bulunur. – Elementlerin Çekirdekte bulunan protonlar, atomun ( o elementin) tüm kimyasal ve fiziksel özelliklerini belirler. – Proton sayısı atomlar (elementler) için ayırt edici özelliktir.

Atomun Yapısı • Nötr bir atom için; – elektron sayısı= proton sayısı – (Z) Atom numarası= proton sayısı – Çekirdek yükü= proton sayısı – İyon yükü= proton sayısı – elektron sayısı – (A) Kütle numarası= proton + nötron sayısı (Nükleon sayısı)(atom ağırlığı)

Elektronların Dizilimi • Elektronlar çekirdek çevresindeki yörüngelerde dönerek hareket ederler. Çekirdeğe en yakın yörünge 1 olmak üzere dışa doğru 2, 3, 4. . . olarak yörüngeler numaralandırılır.

Elektronların Dizilimi • Her katmanda bulunabilecek elektron sayısı bellidir. 1. Yörüngede en çok 2 elektron 2. Yörüngede en çok 8 elektron 3. Yörüngede en çok 18 elektron 4. Yörüngede en çok 32 elektron 5. Yörüngede en çok 32 elektron 6. Yörüngede en çok 18 elektron 7. Yörüngede en çok 8 elektron bulunur.


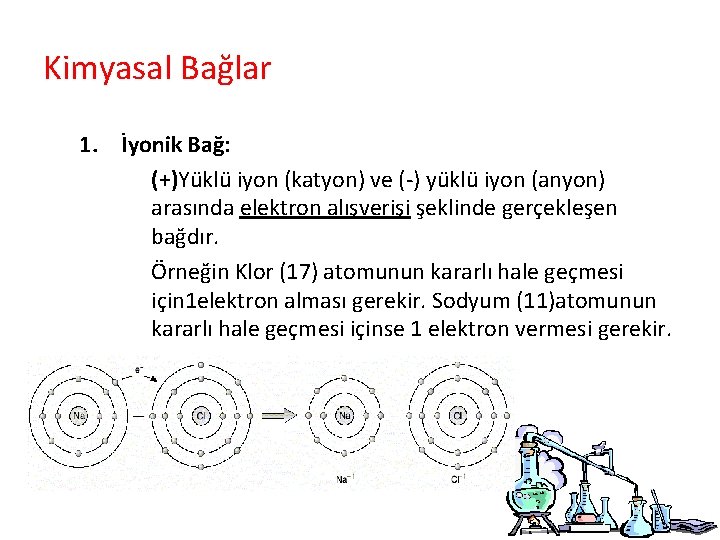
Kimyasal Bağlar Atomları birbirine bağlayan ve bir arada kalmalarını sağlayan kuvvetlere, kimyasal bağlar denir. Kimyasal bağlar, aslında atomları birbirine çeken elektriksel çekim kuvvetleridir. Başlıca iki türlüdür: 1. İyonik Bağ 2. Kovelent Bağ

Kimyasal Bağlar 1. İyonik Bağ: (+)Yüklü iyon (katyon) ve (-) yüklü iyon (anyon) arasında elektron alışverişi şeklinde gerçekleşen bağdır. Örneğin Klor (17) atomunun kararlı hale geçmesi için 1 elektron alması gerekir. Sodyum (11)atomunun kararlı hale geçmesi içinse 1 elektron vermesi gerekir.

Kimyasal Bağlar 2. Kovalent Bağ: Atomlar arasında, son katmanlarda yer alan elektronlardan bazılarının ortaklaşa kullanılmasıyla oluşan bağa denir. • Kovalent bağ aynı cins atomlar arasında oluyorsa apolar kovalent bağ adını alır. Örneğin: oksijen(8) atomları arasındaki bağ.

• Kovalent bağ farklı cins atomlar arasında oluyorsa polar kovalent bağ adını alır. Örneğin: Hidrojen (1) ve oksijen (8) atomları arasındaki bağ.

Bileşikler ve Özellikleri • . . Farklı. . cins atomlardan oluşan kimyasal yöntemlerle kendini oluşturan maddelere ayrıştırılabilen maddelere bileşik denir. • Saf maddelerdir. • . . Formüller. . . . ile gösterilir. • En küçük yapı taşı, . . . moleküller. . . .

Bileşikler ve Özellikleri – Erime ve kaynama noktaları. . . sabittir. . . . – Kimyasal yöntemlerle daha basit maddelere ayrıştırılabilirler. – Bileşiği oluşturan maddeler, . belli. . oranlarda birleşirler. – Bileşenlerinin özelliğini. . . taşımazlar. . .

Bileşikler ve Özellikleri • Bileşikler içerdikleri elementlere göre adlandırılır. • Bileşikleri göstermek için element sembollerini kullanırız. • Bir bileşik formülünde, o bileşiği oluşturan elementlerin sembolleri ve o elementin atomlarından kaç tane olduğu yazılır.

Bileşikler ve Özellikleri Örneğin: – CO de 1 karbon atomu, 2 oksijen atomu, – HCI’de 1 hidrojen atomu, 1 klor atomu, – C H O ‘da 6 karbon, 12 hidrojen, 6 oksijen atomu vardır.

Karışımlar ve Özellikleri • Birden fazla maddenin özelliklerini kaybetmeden oluşturdukları saf olmayan maddelere karışım denir. – Saf olmayan maddelerdir. – . . Sembol. . veya. . . . formüller. . . ile gösterilmezler. – . Homojen. . . veya. . heterojen. . . olabilirler. – Tanecikleri; farklı cins. . . atom. . . veya . . . moleküllerdir. .

Karışımlar ve Özellikleri –. . . Fiziksel. . . yöntemlerle, kendilerini oluşturan maddelere ayrılabilirler. – Karışımı oluşturan maddeler, . . . her. . . oranda karışabilir. – Karışımı oluşturan maddeler; özelliklerini . . . kaybetmezler. . . . . – Erime ve kaynama noktaları …sabit……… değildir.

Karışımlar ve Özellikleri 1. Heterojen karışım • Her tarafında farklı özellik gösteren tek bir madde gibi gözükmeyen karışımlardır. • Yer altından çıkarılan maden filizleri, kaya parçaları, odun parçaları, bir bitki yaprağı, sis, ayran, petrol su karışımı , beton parçası, toprak heterojen karışımlara örnek verilebilir.

Karışımlar ve Özellikleri – Heterojen karışım emülsiyon ve süspansiyon olmak üzere üçe ayrılır. 1. Emülsiyon: – Bir sıvıda çözünmeyen başka bir sıvının heterojen olarak bulanık bir şekilde dağılmış hâlidir. – Su–zeytinyağı karışımı, su–benzin karışımı, gibi.

1. Süspansiyon: – Bir sıvıda çözünmeyen katının heterojen olarak dağılmış şeklidir. – Su–kum karışımı, su–tebeşir tozu karışımı gibi. 2. Aeresoller: – Sıvı-gaz heterojen karışımlara denir. – Deodorant gibi.
 Zellikleri
Zellikleri Maddenin değişmeyen madde miktarına ne denir
Maddenin değişmeyen madde miktarına ne denir Saf madde saf olmayan madde
Saf madde saf olmayan madde Madde güçlük indeksi soruları
Madde güçlük indeksi soruları Turşu saf madde midir karışım mıdır
Turşu saf madde midir karışım mıdır Parlak ve mat maddeler
Parlak ve mat maddeler Ayırt edicilik formülü
Ayırt edicilik formülü Maddenin sahip olduğu ısı miktarı
Maddenin sahip olduğu ısı miktarı Genleşme olayının olumlu etkileri
Genleşme olayının olumlu etkileri Maddənin neçə halı var
Maddənin neçə halı var Maddenin bulunduğu ortamda kapladığı yere ne denir
Maddenin bulunduğu ortamda kapladığı yere ne denir Yoğunluk maddenin birim hacmindeki kütlesidir
Yoğunluk maddenin birim hacmindeki kütlesidir Madde ayırt edicilik
Madde ayırt edicilik Maddenin 5. hali
Maddenin 5. hali 6.sınıf fen maddenin tanecikli yapısı test
6.sınıf fen maddenin tanecikli yapısı test Hacim birimleri
Hacim birimleri Maddenin gaz ve plazma halinin ortak özellikleri
Maddenin gaz ve plazma halinin ortak özellikleri Maddelerin uzayda kapladığı yere ne denir
Maddelerin uzayda kapladığı yere ne denir Madde ayırt edicilik indeksi formülü
Madde ayırt edicilik indeksi formülü Sıvı maddenin soğutularak katı hale geçmesi
Sıvı maddenin soğutularak katı hale geçmesi Uzayda yer kaplayan kütlesi ve hacmi olan varlık nedir
Uzayda yer kaplayan kütlesi ve hacmi olan varlık nedir Maddenin doğru cevaplanma oranı
Maddenin doğru cevaplanma oranı Fahrenheit termometresi
Fahrenheit termometresi Katıların sınıflandırılması
Katıların sınıflandırılması Maddenin halleri animasyon
Maddenin halleri animasyon Sıvı maddenin soğutularak katı hale geçmesi
Sıvı maddenin soğutularak katı hale geçmesi Atomik yapılı element
Atomik yapılı element Luminaletten yan etkileri
Luminaletten yan etkileri Koligatif özellikler osmotik basınç
Koligatif özellikler osmotik basınç Hizlipasaj
Hizlipasaj Ergastik maddeler nelerdir
Ergastik maddeler nelerdir Berklik madde nedir
Berklik madde nedir Anayasa madde 51
Anayasa madde 51 Kronik maruziyet merkürializm
Kronik maruziyet merkürializm Kdv 9.madde
Kdv 9.madde 657 102 madde
657 102 madde Anayasa 42. madde
Anayasa 42. madde çkk 5. madde
çkk 5. madde Tacirin maliyeye karşı sorumlulukları
Tacirin maliyeye karşı sorumlulukları 4857 sayılı iş kanunu 17. madde
4857 sayılı iş kanunu 17. madde Kolay alevlenir madde
Kolay alevlenir madde