ZELTLER 1 GEREK ZELT znme znen maddenin zc















- Slides: 16

ÇÖZELTİLER

1. GERÇEK ÇÖZELTİ Çözünme: Çözünen maddenin çözücü içinde dağılması olayı Çözelti: İyon ve moleküllerin homojen karışımıdır. Çözünen: Çözeltilerde dağılan madde (İyon ve/veya molekül) Çözücü/Çözen: Çözeltilerde dağılma ortamına kısım (sıvı veya su) Ø Gerçek çözeltiler homojen (tek fazlı) karışımlardır.

GERÇEK ÇÖZELTİNİN ÖZELLİKLERİ Molekül veya iyonları çıplak gözle görmek mümkün değildir. Kinetik enerjileri fazladır. Sürekli hareket halindedirler. Yüksek ozmotik basınç gösterirler.

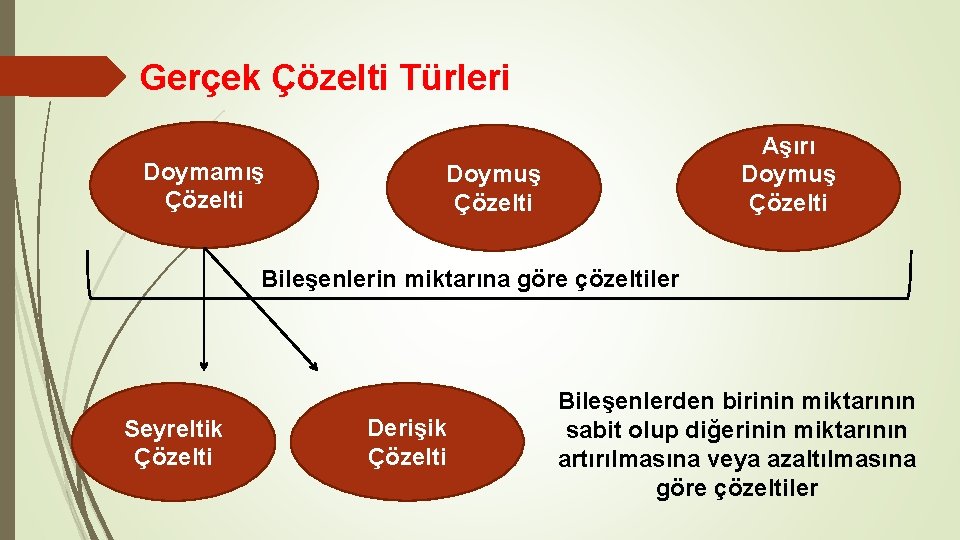
Gerçek Çözelti Türleri Doymamış Çözelti Aşırı Doymuş Çözelti Bileşenlerin miktarına göre çözeltiler Seyreltik Çözelti Derişik Çözelti Bileşenlerden birinin miktarının sabit olup diğerinin miktarının artırılmasına veya azaltılmasına göre çözeltiler

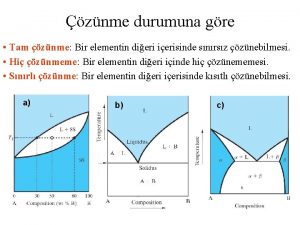
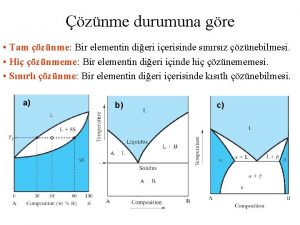
Gerçek Çözelti Türleri I. Doymamış Çözelti: Ø Derişik Çözelti: Ø Seyreltik Çözelti: II. Doymuş (Doygun) Çözelti : III. Aşırı Doymuş Çözelti:

1. GERÇEK ÇÖZELTİ OLUŞUM SÜRECİ Çözünen kısımda moleküller çok küçük ve çok fazla kinetik enerjiye sahiptir. Devamlı hareket halindedir. Bu nedenle su molekülleri arasında kendilerine yer bulabilirler. Suyun diğer maddeleri kendine çekme özelliği vardır. Moleküllerin ve iyonların kendi aralarındaki çekim kuvvetleri su içinde azalır. Molekül ve iyonlar birbirlerinden kopar, su içinde düzgün bir şekilde dağılır.

Eriyebilirlik (Çözünürlük) Çözünen maddenin belli bir sıcaklık ve basınçta belirli bir sıvı içinde çözünmesidir. ü Ortamın Sıcaklığı ü Çözünen maddenin cinsi benzeri çözer (hidrofilik/hidrofobik) ü Çözen sıvının cinsi ü Partiküllerin büyüklüğü ü Basınç ü Ortama başka maddelerin eklenmesi ü Mekanik etki

Gerçek Çözeltinin Özellikleri Herhangi madde diğer bir madde içinde çözündüğü zaman çözücünün özelliği değişir. Ø Çözen sıvının kaynama noktası artar Ø Çözen sıvının donma noktası düşer Ø Çözen sıvının buhar basıncı azalır Ø Çözen sıvının osmotik basıncı artar

Kaynama Noktası (KN): Buhar basıncının dış atmosfer basıncına eşit olduğu sıcaklığa kaynama sıcaklığı denir. Ø Atmosfer basıncı Sıvının KN

Donma Noktası: Serbest haldeki sıvı moleküllerinin belirli bir kristal şekli içinde düzgün bir yapıya dönmesidir. Bir sıvının DN; katı ve sıvı fazların dengede bulunduğu sıcaklık derecesidir. Donma noktası, çözelti içinde bulunan molekül veya iyon sayısına bağlıdır

Buhar Basıncı (BB): Doygun buharın sıvı üzerindeki sıcaklığa bağlı olan basınçtır. ü Herhangi bir sıvının üzerindeki gaz basıncıdır ve moleküllerin sıvı yüzeyinden buharlaşmasına bağlıdır ü Buharlaşan kısım sıvı üzerinde birikir ve sıvı üzerinde basınç yapar.

Osmoz: Konsantrasyonları farklı iki solüsyon arasına yarı geçirgen bir zar konulduğunda, konsantrasyonu az olandan çok olana doğru suyun geçişidir. Osmotik Basınç: Konsantrasyonu az olandan çok olan ortama sıvıyı iten kuvvettir.

Osmolarite: Bir çözeltide ozmotik olarak aktif partiküllerin derişimine denir. İzoosmotik: Aynı osmolariteye sahip çözeltiler (İzotonik) Hiperosmotik: Yüksek osmolariteli çözeltiler (Hipertonik) Hipoosmotik: Osmolaritesi düşük çözeltiler (Hipotonik)

Kristalizasyon Katı maddelerin gerçek çözelti içinde ayrılması olayına denir. I. Çözünen (katı) madde oranın fazla olması II. Ortamın ısısının yükselmesi Etkileyen faktörler: Viskozitenin yüksek olması (soğutma) Protein, yağ gibi büyük moleküller ile kristalizasyon daha düzgün olur Aynı yönde sürekli karıştırmak Glikoz ve fruktoz miktarını

2. SÜSPANSİYON Yüzme halinde bulunan katı ve çözülmeyen maddeleri içeren karışımlara denir. Örn; Nişastalı su Katı ve çözünmeyen maddeler sıvı içinde asılı kalır. Genel Özellikleri; ü Partiküller gözle ve mikroskopla görülebilir. ü Partiküller 0. 1 µ ‘dan büyüktür. ü Mekanik yolla alt yapılara parçalanırlar. ü Jel oluşturma özellikleri yoktur. (Fakat ısıl işlem uygulandığında bu durum değişir. ) ü Sıcak su ile kolloidal duruma geçebilir. ü Çok az hareketlilik var ve ölçülebilen osmotik basıncı yoktur. ü Genellikle opaktırlar

Adsorbsiyon v Moleküllerin, atomların ve iyonların katı veya sıvı maddelerin yüzeylerine yapışması (tutunması) olayına denir. v Yüzey zarında derişim azalmasına negatif adsorbsiyon, derişim artışında ise pozitif adsorbsiyon denir.
 Zelt jelentése
Zelt jelentése Neden istiklal marşı yazılmasına gerek duyuldu
Neden istiklal marşı yazılmasına gerek duyuldu Igor gerek
Igor gerek Znme
Znme Znme
Znme Aşırı doyma kristallenmesi
Aşırı doyma kristallenmesi 6.sınıf fen maddenin tanecikli yapısı test
6.sınıf fen maddenin tanecikli yapısı test Maddenin gaz ve plazma halinin ortak özellikleri
Maddenin gaz ve plazma halinin ortak özellikleri Bir maddenin değişmeyen madde miktarına ne denir
Bir maddenin değişmeyen madde miktarına ne denir Maddelerin uzayda kapladıkları yere kütle denir
Maddelerin uzayda kapladıkları yere kütle denir Madde güvenirlik indeksi formülü
Madde güvenirlik indeksi formülü Litre dönüşümleri
Litre dönüşümleri Maddenin 5. hali
Maddenin 5. hali Berklik madde nedir
Berklik madde nedir Ayırt edicilik hesaplama
Ayırt edicilik hesaplama Madde ayırt edicilik formülü
Madde ayırt edicilik formülü Kristallendirme
Kristallendirme