Zavdn inovativnch metod a vukovch materil do prodovdnch


























- Slides: 29

Zavádění inovativních metod a výukových materiálů do přírodovědných předmětů na Gymnáziu v Krnově Názvosloví anorganických sloučenin Mgr. Petr Štěpánek

Názvosloví anorganických sloučenin § § Základní pojmy Tvorba vzorce Tvorba názvu Příklady k procvičení

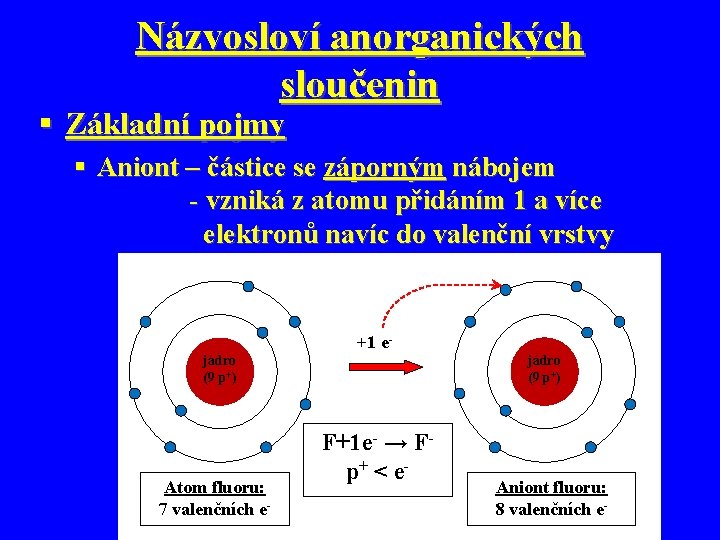
Názvosloví anorganických sloučenin § Základní pojmy § Aniont – částice se záporným nábojem - vzniká z atomu přidáním 1 a více elektronů navíc do valenční vrstvy +1 ejádro (9 p+) Atom fluoru: 7 valenčních e- F+1 e- → Fp+ < e - Aniont fluoru: 8 valenčních e-

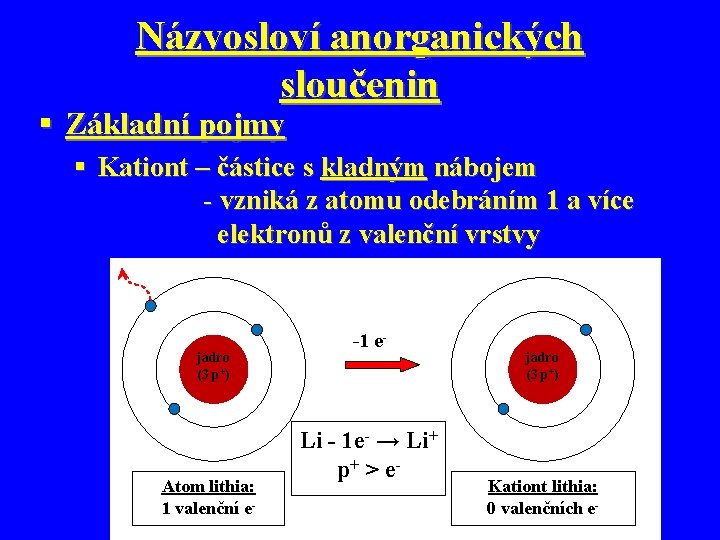
Názvosloví anorganických sloučenin § Základní pojmy § Kationt – částice s kladným nábojem - vzniká z atomu odebráním 1 a více elektronů z valenční vrstvy jádro (3 p+) Atom lithia: 1 valenční e- -1 e- Li - 1 e- → Li+ p+ > e - jádro (3 p+) Kationt lithia: 0 valenčních e-

Názvosloví anorganických sloučenin § Základní pojmy § Oxidační číslo – hypotetický náboj, který by byl přítomen na atomu daného prvku, pokud by elektrony všech vazeb které z něj vycházejí, byly přiděleny elektronegativnějšímu z vázaných atomů § myšlený náboj, který by vznikl na atomech ve sloučenině, pokud by se všechny vazby iontově rozštěpily (včetně vazeb polárních)

Názvosloví anorganických sloučenin § Základní pojmy: § Oxidační číslo: Př. H 2 vazba H-H: rozdíl elektronegativit nulový → nepolární vazba → oxidační čísla: 0 a 0 → H 0 - H 0 Př. Na. Cl vazba Na-Cl: rozdíl elektronegativit 2, 1 → iontová vazba → oxidační čísla: +1 a -1 → Na+I - Cl-I

Názvosloví anorganických sloučenin § Základní pojmy: § Oxidační číslo: Př. HCl vazba H-Cl: rozdíl elektronegativit 0, 8 → polární vazba → oxidační čísla: +1 a -1 → H+I - Cl-I → H+ICl-I Př. HI vazba H-I: rozdíl elektronegativit 0, 3 → nepolární vazba → oxidační čísla: +1 a -1 → H+I-I-I → H+II-I

Názvosloví anorganických sloučenin § Základní pojmy: § Názvoslovné koncovky oxidačních čísel: I. -ný sodný Na+ II. -natý vápenatý Ca+II III. -itý hlinitý Al+III IV. -ičitý uhličitý C+IV V. -ečný fosforečný P+V -ičný dusičný N+V VI. -ový sírový S+VI VII. -istý manganistý Mn+VII VIII. -ičelý osmičelý Os+VIII

Názvosloví anorganických sloučenin § Tvorba vzorce: § vzorec sloučeniny se skládá z kationtu a aniontu, které spolu vytvářejí sloučeninu § celkový součet jejich nábojů je roven NULE § KATIONT: Na+ ( sodný ) Ca+2 ( vápenatý ) Al+3 ( hlinitý ) § ANIONT: S-2 ( sulfid ) Cl-1 ( chlorid ) NO 3 -1 ( dusičnan ) SO 4 -2 ( síran )

Názvosloví anorganických sloučenin § Tvorba vzorce: § KATIONT: § jednoduchý - tvořen jediným prvkem - náboj viz. koncovka Na+ ( sodný ) Ca+2 ( vápenatý ) Al+3 ( hlinitý ) § složený - tvořen více prvky - náboj dán součtem oxidačních čísel NH 4+1 (amonný) N-IIIH 4+I → - 3 + 4 = +1

Názvosloví anorganických sloučenin § Tvorba vzorce: § ANIONT: § jednoduchý - tvořen jediným prvkem - koncovka -id - náboj viz. umístění v tabulce (číslo skupiny prvku mínus 8) S-2 (sulfid) O-2 (oxid) Cl-1 (chlorid) N-3 (nitrid)

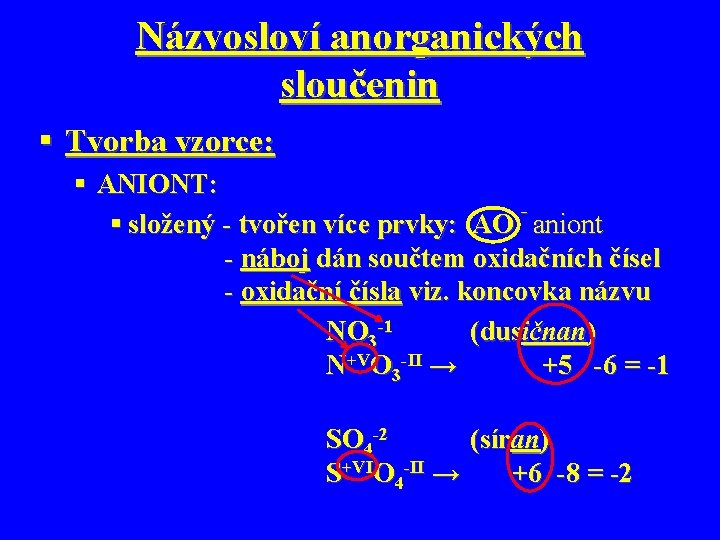
Názvosloví anorganických sloučenin § Tvorba vzorce: § ANIONT: § složený - tvořen více prvky: AO aniont - náboj dán součtem oxidačních čísel - oxidační čísla viz. koncovka názvu NO 3 -1 (dusičnan) N+VO 3 -II → +5 -6 = -1 SO 4 -2 (síran) S+VIO 4 -II → +6 -8 = -2

Názvosloví anorganických sloučenin § Tvorba vzorce - vytvoření vzorce z názvu: chlorid sodný (název aniontu + název kationtu) 1. chlorid → jednoduchý aniont → Cl-1 nebo náboj aniontu = počet vodíků které měla kyselina → HCl → -1 2. sodný → Na+1 3. vzorec: Na+1 Cl-1 křížové pravidlo: Na+I Cl-I → Na. Cl (vzorec: kationt + aniont)

Názvosloví anorganických sloučenin § Tvorba vzorce - vytvoření vzorce z názvu: oxid hlinitý (název aniontu + název kationtu) 1. oxid → jednoduchý aniont → O-2 2. hlinitý → Al+3 3. vzorec: Al+III O-II křížové pravidlo: Al 2+III O 3 -II → Al 2 O 3 (vzorec: kationt + aniont)

Názvosloví anorganických sloučenin § Tvorba vzorce - vytvoření vzorce z názvu: kyselina sírová (název podle aniontu) 1. kyselina - kationt je vždy vodíkový H+I 2. sírová → aniont sírový → složený aniont → obsahuje síru S+VI a kyslík O-II 3. H+I S+VI O-II 4. sudé ox. číslo S+VI → sudý počet vodíků (obvykle 2) → H 2+I S+VI O-II 5. počet kyslíků = vyrovnání náboje sloučeniny na nulu → H 2+I S+VI O 4 -II => H 2 SO 4 → +2 +6 -8 = 0

Názvosloví anorganických sloučenin § Tvorba vzorce - vytvoření vzorce z názvu: siřičitan hlinitý (název aniontu + název kationtu) 1. siřičitan → sůl kyseliny siřičité → H 2 SO 3 2. náboj aniontu = počet vodíků, které měla kyselina → -2 3. SO 3 -2 4. hlinitý → Al+3 5. vzorec: Al+3 SO 3 -2 křížové pravidlo: Al 2+III(SO 3)3 -2 → Al 2(SO 3)3 (vzorec: kationt + aniont)

Názvosloví anorganických sloučenin § Tvorba názvu: § název sloučeniny se skládá z názvu aniontu a názvu kationtu § KATIONT: sodný ( Na+ ) vápenatý ( Ca+2 ) hlinitý ( Al+3 ) § ANIONT: sulfid ( S-2 ) chlorid ( Cl-1 ) dusičnan ( NO 3 -1 ) síran ( SO 4 -2 )

Názvosloví anorganických sloučenin § Tvorba názvu: § KATIONT: § jednoduchý - tvořen jediným prvkem - koncovka viz. náboj iontu sodný ( Na+ ) vápenatý ( Ca+2 ) hlinitý ( Al+3 ) § složený - tvořen více prvky - nesystematický ustálený název NH 4+1 (amonný kationt) UO 2+2 (uranylový kationt)

Názvosloví anorganických sloučenin § Tvorba názvu: § ANIONT: § jednoduchý - tvořen jediným prvkem - koncovka vždy stejná S-2 (sulfid) O-2 (oxid) Cl-1 (chlorid) N-3 (nitrid) -id

Názvosloví anorganických sloučenin § Tvorba názvu: § ANIONT: centrální atom § složený - tvořen více prvky: AO aniont - název dán centrálním atomem a jeho oxidačním číslem NO 3 -1 (dusičnan) N+VO 3+II → +5 -6 = -1 SO 4 -2 (síran) S+VIO 4+II → +6 -8 = -2

Názvosloví anorganických sloučenin § Tvorba názvu - vytvoření názvu ze vzorce: Na. Cl (vzorec: kationt + aniont) 1. otočení křížového pravidla: Na+I Cl -I 2. Na+I → sodný (kationt) 3. Cl-I náboj aniontu = -1 (viz. umístění Cl v tabulce: skupina VII - 8 = -1) → jednoduchý aniont → chlorid 4. název: Na. Cl → chlorid sodný (název aniontu + název kationtu)

Názvosloví anorganických sloučenin § Tvorba názvu - vytvoření názvu ze vzorce: CO 2 (vzorec: kationt + aniont) 1. otočení křížového pravidla: C+II O 2 -I 2. C+II → uhelnatý (kationt) 3. O-I náboj aniontu = -1 (viz. umístění O v tabulce: skupina VI - 8 = -2) → náboj zjištěný otočením křížového pravidla je nesprávný → příčina: -počty atomů ve vzorci jsou pokráceny: 4. CO 2 → C 2 O 4 (nyní lze využít křížové pravidlo)

Názvosloví anorganických sloučenin § Tvorba názvu - vytvoření názvu ze vzorce: CO 2 (vzorec: kationt + aniont) 5. otočení křížového pravidla: C 2+IV O 4 -II 6. C+IV → uhličitý (kationt) 7. O-II náboj aniontu = -2 (viz. umístění O v tabulce: skupina VI - 8 = -2) → jednoduchý aniont → oxid 8. název: CO 2 → oxid uhličitý (název aniontu + název kationtu)

Názvosloví anorganických sloučenin § Tvorba názvu - vytvoření názvu ze vzorce: H 2 SO 4 (vzorec: kationt + aniont) 1. kationt vodíkový je vždy H+I → kyselina 2. kyslík vždy O-II : H 2+I S O 4 -II +2 +? -8 = 0 3. zjištění ox. čísla centrálního atomu (síry) 4. H 2+I S+VI O 4 -II +2 +6 -8 = 0 → S+VI → sírová 5. H 2 SO 4 => kyselina sírová

Názvosloví anorganických sloučenin § Tvorba názvu - vytvoření názvu ze vzorce: Ca 3(PO 4)2 (vzorec: kationt + aniont) 1. otočení křížového pravidla: Ca 3+II (PO 4)2 -3 2. Ca+II → vápenatý (kationt) 3. (PO 4)-3 náboj aniontu = -3 → počet vodíků které měla kyselina = 3 →H 3 PO 4 (k. fosforečná) 4. (P+VO 4 -II)-3 → fosforečnan 5. název: Ca+II (PO 4)-3 → fosforečnan vápenatý (název aniontu + název kationtu)

Názvosloví anorganických sloučenin § Příklady k procvičení: 1. 2. 3. 4. 5. 6. 7. 8. 9. Ca. CO 3 KMn. O 4 Ba(NO 3)2 Fe. Cl 3 Fe(Cl. O 3)2 Be. SO 4 Na 3 PO 4 Mg(NO 2)2 Zn(IO 4)2 10. Hg(Br. O 3)2 11. Ca. O 12. K 2 Mn. O 4 13. Be(NO 2)2 14. Al. F 3 15. Mg(Cl. O 2)2 16. Cu. SO 3 17. K 3 PO 3 18. Na. NO 2

Názvosloví anorganických sloučenin § Příklady k procvičení: 1. 2. 3. 4. 5. 6. 7. 8. 9. wolframan sodný uhličitan měďnatý chlornan barnatý síran železitý dusičnan rtuťnatý jodičnan nikelnatý bromistan barnatý siřičitan lithný fosforečnan hořečnatý 10. křemičitan draselný 11. oxid manganatý 12. chroman barnatý 13. dusičnan železitý 14. fosforitan železnatý 15. chloristan lithný 16. dusitan kobaltnatý 17. manganistan sodný 18. síran strontnatý

Názvosloví anorganických sloučenin Děkuji za pozornost

Literatura a použité zdroje: • Obrázky vytvořeny v programu Microsoft Word
 Materil
Materil Materil
Materil Materil
Materil Materil
Materil Materil
Materil Materil
Materil Materil
Materil Materil
Materil Materil
Materil Metoda schmigalli
Metoda schmigalli Cyril a metod 863
Cyril a metod 863 Kimyo o'qitish metodikasi
Kimyo o'qitish metodikasi Walidacja metod analitycznych
Walidacja metod analitycznych Fenomenografisk metod
Fenomenografisk metod Testimplikation
Testimplikation Og'zaki bayon qilish metodi
Og'zaki bayon qilish metodi Eksperiment metodi ppt
Eksperiment metodi ppt Omvårdnadsvetenskap
Omvårdnadsvetenskap Uporedni metod
Uporedni metod Mrten
Mrten Direct method presentation
Direct method presentation Matus kucera konstantin a metod
Matus kucera konstantin a metod Knjii
Knjii Kramerov metod
Kramerov metod 6 kapeluszy
6 kapeluszy Gap analys mall
Gap analys mall Toifalash jadvali
Toifalash jadvali Metod kengash ish rejasi
Metod kengash ish rejasi Tarbiya usullari va shakllari slayd
Tarbiya usullari va shakllari slayd Amaliy metodlar turlari va tavsifi
Amaliy metodlar turlari va tavsifi





















































