UTVRIVANJE STRUKTURE KOMPLEKSNIH JEDINJENJA Postojanje dva dela kompleksnog



![Utvrđivanje oblika u kome je prisutan sulfat u kompleksu rastvaranjem kompleksa [Co(NH 3)5 Br]SO Utvrđivanje oblika u kome je prisutan sulfat u kompleksu rastvaranjem kompleksa [Co(NH 3)5 Br]SO](https://slidetodoc.com/presentation_image_h2/271214120625277269199dc056dbc540/image-4.jpg)





- Slides: 13

UTVRĐIVANJE STRUKTURE KOMPLEKSNIH JEDINJENJA Postojanje dva dela kompleksnog jedinjenja u kompleksima tipa M [׳ MX 6], [ML 6]X 2 i drugih može se utvrditi jednostavnim analitičkim probama u rastvorima dobijenim selektivnim rastvaranjem kompleksnih jedinjenja u vodi i razblaženim mineralnim kiselinama, i primenom fizičko-hemijskih tehnika i metoda karakterizacije: kvalitativno: - uočavanjem različite boje jedinjenja, - identifikacijom anjona van unutrašnje koordinacione sfere, kvantitativnim određivanjem pojedinačnih komponenti, liganada i jona merenjem provodljivosti rastvora, snimanjem i analizom UV/VIS spektara, snimanjem i analizom IR i Ramanovih spektara, snimanjem i analizom ESR spektara, primenom specifičnih tehnika analize.

Vizuelno određivanje boje kompleksnog jedinjenja Na osnovu prethodnih znanja o kompleksima i iskustva u praktičnom laboratorijskom radu u kvalitativnoj analitičkoj i koordinacionoj hemiji mogu se vizuelnim posmatranjem boje kompleksa uočiti razlike kao posledica razlika u strukturi, jer pojedina kompleksna jedinjenja mogu imati istu bruto molekulsku formulu, a različitu boju. Različitost u bojama javlja se kao posledica različitog načina vezivanja liganada u komplesnom jedinjenju. U tabeli dati su primeri uticaja liganada na boju kompleksnih jedinjenja jona Cu 2+, Ni 2+, Cr 3+ i Fe 2+. Jon metala Cu 2+ Ni 2+ Cr 3+ Fe 2+ Kompleks Boja kompleksa Apsorpcija* [Cu. Cl 4]2 - zeleno-smeđ narandžastom [Cu(H 2 O)6]2+ plav žutom [Cu(NH 3)4]2+ plavo-ljubičast žuto-zelenom [Cu(CN)4]2 - bezbojan ultra-ljubičastom [Ni(H 2 O)6]2+ zelen crvenom [Ni(NH 3)6]2+ ljubičast zelenom [Ni(CN)4]2 - žut plavom [Cr(H 2 O)4 Cl 2]Cl zelen crvenom [Cr(H 2 O)6]Cl 3 svetlo-ljubičast zelenom [Cr(NH 3)6]3+ tamno-ljubičast zelenom [Fe(H 2 O)6]2+ svetlo-zelen infracrvenom [Fe(CN)6]4 - žut plavom

Kvalitativno dokazivanje liganada (jona) u rastvoru Utvrđivanje spoljašnje i unutrašnje sfere kompleksa date molekulske formule Postojanje dva dela koordinacione sfere kompleksa može se pokazati na primeru analize koordinacionog jedinjenja bruto formule Cr. Cl 3∙ 6 H 2 O: rastvaranjem kompleksa [Cr(H 2 O)6]Cl 3 (proba I) i [Cr(H 2 O)3 Cl 3] (proba II) u vodi, a zatim taloženjem hlorida pomoću Ag. NO 3 iz dobijenih rastvora. U prvoj probi se formira talog Ag. Cl, a u drugoj probi nema belog taloga Ag. Cl-a, što pokazuje da se u prvom slučaju Cl- joni nalaze u spoljašnjoj, a u drugom u unutrašnjoj koordinacionoj sferi. Ako se pak rastvaranje ovih dveju proba (kompleksnih jedinjenja) vrši u nekoj kiselini (najčešće razblažena HNO 3), taloženjem hlorida iz rastvora ove dve probe dobijaju se iste količine taloga jer kiselina razara kompleks u potpunosti i oslobađa jone koje taloži -jon.
![Utvrđivanje oblika u kome je prisutan sulfat u kompleksu rastvaranjem kompleksa CoNH 35 BrSO Utvrđivanje oblika u kome je prisutan sulfat u kompleksu rastvaranjem kompleksa [Co(NH 3)5 Br]SO](https://slidetodoc.com/presentation_image_h2/271214120625277269199dc056dbc540/image-4.jpg)
Utvrđivanje oblika u kome je prisutan sulfat u kompleksu rastvaranjem kompleksa [Co(NH 3)5 Br]SO 4 (proba I) i [Co(NH 3)5 SO 4]Br (proba II) u vodi, a zatim taloženjem sulfata pomoću Ba. Cl 2 iz dobijenih rastvora, u prvoj probi dolazi do formiranja taloga Ba. SO 4, dok se u drugoj probi ne formira talog. Ovaj rezultat pokazuje da se SO jon nalazi u različitim koordinacionim sferama ova dva kompleksna jedinjenja, spoljašnjoj (I) i unutrašnjoj (II). Rastvaranjem ova dva kompleksa u kiselini (najčešće razblažena HNO 3) dolazi do razaranja kompleksa u potpunosti i taloženja istih količina sulfata, po dodavanju taložnog reagensa koji sadrži Ba 2+ jone.

Gravimetrijsko taloženje je jedan od načina da se pokaže postojanje dva dela kompleksnog jedinjenja, spoljašnje i unutrašnje koordinacione sfere i odredi kvantitativni odnos između tih delova kompleksne čestice. Na primeru kompleksa [Cr(H 2 O)6]Cl 3 i [Cr(H 2 O)4 Cl 2]Cl∙ 2 H 2 O gravimetrijskim taloženjem hlorida sa Ag+ jonima dobijaju se raličite količine hlorida. Na isti način može se iz kompleksa [Co(NH 3)5 Br]SO 4 istaložiti slobodan SO 42 - anjon u obliku Ba. SO 4, ali ne i iz kompleksa [Co(NH 3)5 SO 4]Br i [Co(NH 3)5 SO 4 Br. Co(NH 3)5]Br 4, zato što se anjon nalazi u unutrašnjoj koordinacionoj sferi kao ligand vezan za centralni atom metala. Razaranjem kompleksa pri rastvaranju u razblaženoj HNO 3 može se istaložiti ista količina sulfata iz rastvora sva tri jedinjenja po odgovarajućem postupku za gravimetrijsko određivanje sulfata u obliku Ba. SO 4.

Merenje molarne provodljivosti Merenjem provodljivosti rastvora kompleksa i poređenjem sa poznatim vrednostima za određeni tip elektrolita utvrđuje se broj čestica na koje disosuje kompleksno jedinjenje. Rastvaranjem kompleksa [Cr(H 2 O)6]Cl 3 i [Cr(H 2 O)4 Cl 2]Cl ∙ 2 H 2 O u vodi i merenjem njihove molarne provodljivosti dobijaju se različite vrednosti zbog različitog broja čestica koje postoje u istoj količini ovih kompleksa. U tabeli 3. 2 dati su primeri disocijacije različitih kompleksa sa odgovarajućim primerom jakog elektrolita koji disosuje na isti broj čestica i ima istu provodljivost. jedinjenje ⇆ disocija Ag. Cl(s) [mol] Provodljivost slična elektrolitu [Co(NH 3)6]Cl 3 ⇆ [Co(NH 3)6]3+ + 3 Cl- 3 Al. Cl 3 [Co(NH 3)5 Cl]Cl 2 ⇆ [Co(NH 3)5 Cl]2 - + 2 Cl- 2 Co. Cl 2 [Co. Cl 2(NH 3)4]Cl ⇆ [Co. Cl 2(NH 3)4]+ + Cl- 1 Na. Cl Svi ovi kompleksi posle zagrevanja rastvora sa razblaženom kiselinom (HNO 3) koja razara komplekse, i dodavanjem Ag+ jona talože istu količinu Ag. Cl(s) jer sadrže istu ukupnu količinu hlorida, ali su joni Cl– vezani u različitim delovima kompleksnih čestica.

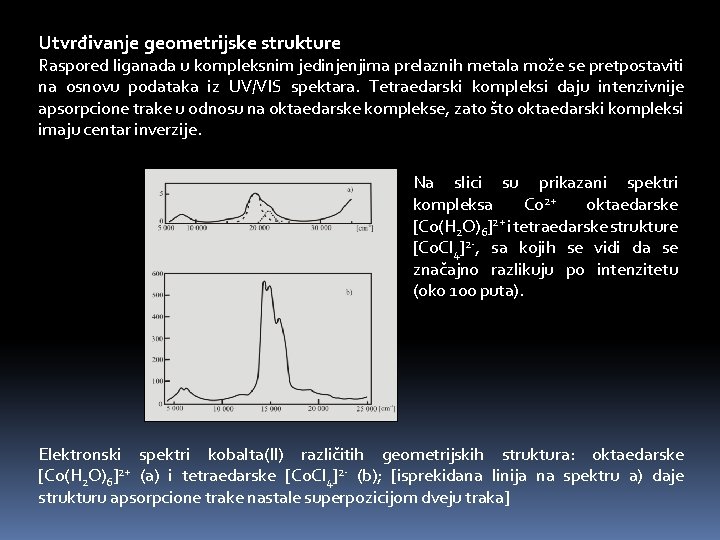
Utvrđivanje geometrijske strukture Raspored liganada u kompleksnim jedinjenjima prelaznih metala može se pretpostaviti na osnovu podataka iz UV/VIS spektara. Tetraedarski kompleksi daju intenzivnije apsorpcione trake u odnosu na oktaedarske komplekse, zato što oktaedarski kompleksi imaju centar inverzije. Na slici su prikazani spektri kompleksa Co 2+ oktaedarske [Co(H 2 O)6]2+ i tetraedarske strukture [Co. Cl 4]2 -, sa kojih se vidi da se značajno razlikuju po intenzitetu (oko 100 puta). Elektronski spektri kobalta(II) različitih geometrijskih struktura: oktaedarske [Co(H 2 O)6]2+ (a) i tetraedarske [Co. Cl 4]2 - (b); [isprekidana linija na spektru a) daje strukturu apsorpcione trake nastale superpozicijom dveju traka]

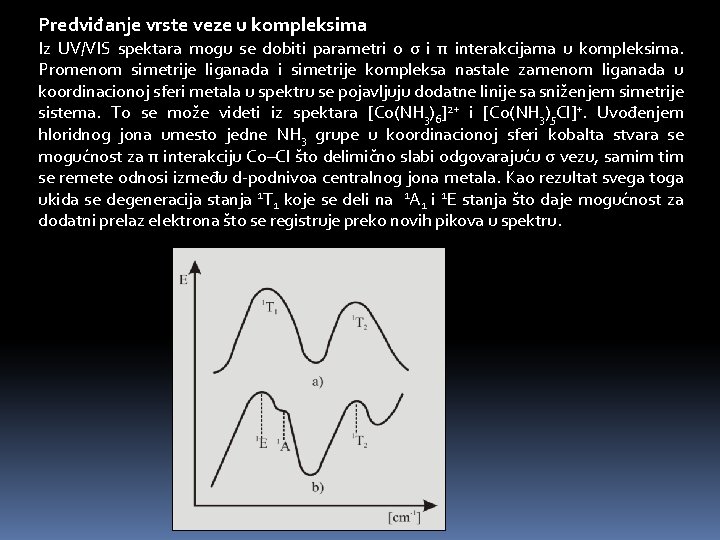
Predviđanje vrste veze u kompleksima Iz UV/VIS spektara mogu se dobiti parametri o σ i π interakcijama u kompleksima. Promenom simetrije liganada i simetrije kompleksa nastale zamenom liganada u koordinacionoj sferi metala u spektru se pojavljuju dodatne linije sa sniženjem simetrije sistema. To se može videti iz spektara [Co(NH 3)6]2+ i [Co(NH 3)5 Cl]+. Uvođenjem hloridnog jona umesto jedne NH 3 grupe u koordinacionoj sferi kobalta stvara se mogućnost za π interakciju Co–Cl što delimično slabi odgovarajuću σ vezu, samim tim se remete odnosi između d-podnivoa centralnog jona metala. Kao rezultat svega toga ukida se degeneracija stanja 1 T 1 koje se deli na 1 A 1 i 1 E stanja što daje mogućnost za dodatni prelaz elektrona što se registruje preko novih pikova u spektru.

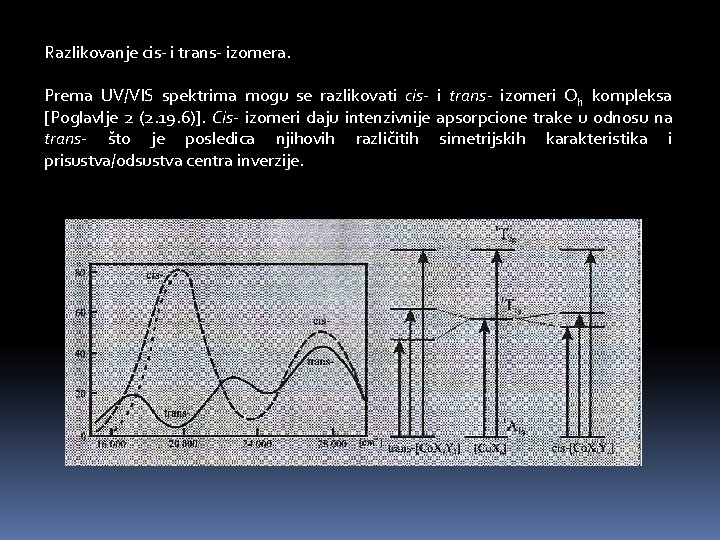
Razlikovanje cis- i trans- izomera. Prema UV/VIS spektrima mogu se razlikovati cis- i trans- izomeri Oh kompleksa [Poglavlje 2 (2. 19. 6)]. Cis- izomeri daju intenzivnije apsorpcione trake u odnosu na trans- što je posledica njihovih različitih simetrijskih karakteristika i prisustva/odsustva centra inverzije.

Primena IR spektroskopije Metodom IR spektroskopije dobijaju se značajniji podaci o kompleksnim jedinjenjima i to o: prisustvu vode u kompleksima i načinu vezivanja iste (u koordinacionoj sferi ili van koordinacione sfere) funkcionalnim grupama organskih liganada, načinu vezivanja poliatomskih anjonskih liganada i njihovim simetrijskim karakteristikama, koordinaciji metal-ligand. Na slici koja sledi date su oblasti IR spektara u kojima se javljaju trake za uobičajene anjone neorganskih kiselina i anjonske ligande u kompleksnim jedinjenjima. Relativni položaji apsorpcionih traka u IR spektru za uobičajene anjone neorganskih kiselina koji mogu biti anjonski ligandi ili anjonski deo jedinjenja sa kompleksnim katjonom

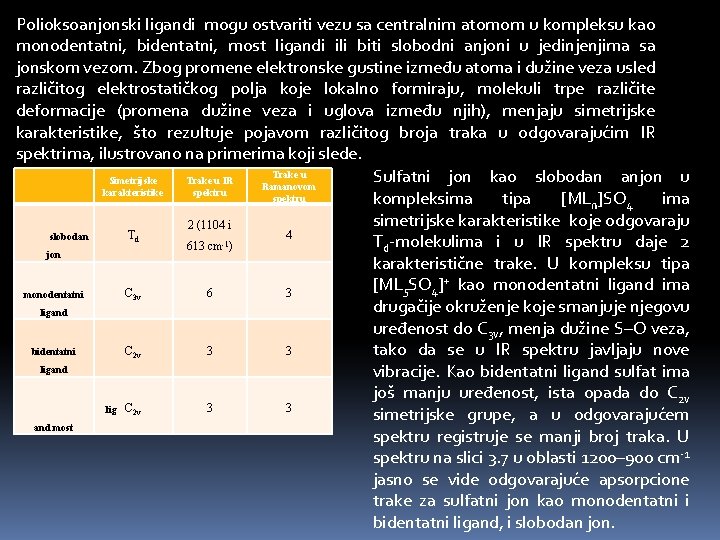
Polioksoanjonski ligandi mogu ostvariti vezu sa centralnim atomom u kompleksu kao monodentatni, bidentatni, most ligandi ili biti slobodni anjoni u jedinjenjima sa jonskom vezom. Zbog promene elektronske gustine između atoma i dužine veza usled različitog elektrostatičkog polja koje lokalno formiraju, molekuli trpe različite deformacije (promena dužine veza i uglova između njih), menjaju simetrijske karakteristike, što rezultuje pojavom različitog broja traka u odgovarajućim IR spektrima, ilustrovano na primerima koji slede. Trake u Sulfatni jon kao slobodan anjon u Simetrijske Trake u IR Ramanovom karakteristike spektru kompleksima tipa [MLn]SO 4 ima simetrijske karakteristike koje odgovaraju 2 (1104 i T 4 slobodan d Td-molekulima i u IR spektru daje 2 613 cm-1) jon karakteristične trake. U kompleksu tipa [ML 5 SO 4]+ kao monodentatni ligand ima C 3 v 6 3 monodentatni drugačije okruženje koje smanjuje njegovu ligand uređenost do C 3 v, menja dužine S–O veza, C 2 v 3 3 tako da se u IR spektru javljaju nove bidentatni ligand vibracije. Kao bidentatni ligand sulfat ima još manju uređenost, ista opada do C 2 v 3 3 lig C 2 v simetrijske grupe, a u odgovarajućem and most spektru registruje se manji broj traka. U spektru na slici 3. 7 u oblasti 1200– 900 cm-1 jasno se vide odgovarajuće apsorpcione trake za sulfatni jon kao monodentatni i bidentatni ligand, i slobodan jon.


Ostale metode analize kompleksnih jedinjenja Za određivanje geometrijske strukture kompleksa, tj. utvrđivanja prostornog rasporeda liganada i njihovih donor atoma oko centralnog atoma metala primenjuje se rentgenska strukturna analiza. Za određivanje elektronske strukture kompleksa, tj. prostorne raspodele elektronske gustine, pored već opisanih i lakše dostupnih , primenjuju se i druge metode i tehnike. Fotoelektronska spektroskopija primenjuje se za određivanje položaja MO energetskih nivoa i njihove popunjenosti valentnim i nevalentnim elektronima konstituenata (metala i liganada), posebno je pogodna za ispitivanje najbliže okoline biometala u kompleksima koji sadrže donor atome kiseonika, azota i sumpora. Nuklearna magnetna rezonanca primenjuje se za dobijanje podataka o načinu koordinacije M–L. γ-rezonantna spektroskopija ima primenu u utvrđivanju strukture bioliganada i drugih liganada sa jonima gvožđa. Termogravimetrija i diferencijalno-termička analiza se takođe mogu primeniti za određivanje oblika prisustva pojedinih atoma i atomskih grupa u kompleksima.
 Disocijacija kompleksnih jedinjenja
Disocijacija kompleksnih jedinjenja Alkoholi su
Alkoholi su Halogenovanje alkana
Halogenovanje alkana Thomsonova formula
Thomsonova formula Fazna razlika napona i struje
Fazna razlika napona i struje Potenciranje kompleksnog broja
Potenciranje kompleksnog broja Polarni oblik kompleksnog broja
Polarni oblik kompleksnog broja Kvadratna jednadžba
Kvadratna jednadžba Biologija
Biologija Kompleksni spojevi
Kompleksni spojevi Divizioni model organizacione strukture
Divizioni model organizacione strukture Adhokratija
Adhokratija Relacioni operatori
Relacioni operatori Krovne strukture
Krovne strukture

























