Kompleksni spojevi to su kompleksni spojevi sastoje se



![geometrijski oblici naziv oblika primjer linearan oblik [Ag(NH 3)2]+ tetraedar [Zn(NH 3)4]2+ kvadrat [Au. geometrijski oblici naziv oblika primjer linearan oblik [Ag(NH 3)2]+ tetraedar [Zn(NH 3)4]2+ kvadrat [Au.](https://slidetodoc.com/presentation_image_h2/3dfcc2de24de99409e03bee27e3a231b/image-5.jpg)




![Koordinacijska nomenklatura kationa (1) Kompleksni ioni pišu se u uglatim zagradama [ ]. Osnovno Koordinacijska nomenklatura kationa (1) Kompleksni ioni pišu se u uglatim zagradama [ ]. Osnovno](https://slidetodoc.com/presentation_image_h2/3dfcc2de24de99409e03bee27e3a231b/image-13.jpg)




![1. Napišite koordinacijski broj metala i dajte racionalna imena slijedećim spojevima [Ag(NH 3)2]Cl diamminsrebrov(I) 1. Napišite koordinacijski broj metala i dajte racionalna imena slijedećim spojevima [Ag(NH 3)2]Cl diamminsrebrov(I)](https://slidetodoc.com/presentation_image_h2/3dfcc2de24de99409e03bee27e3a231b/image-18.jpg)

![Strukturna izomerija p Hidratna izomerija [Cr(H 2 O)6]Cl 3 [Cr. Cl(H 2 O)5]Cl 2×H Strukturna izomerija p Hidratna izomerija [Cr(H 2 O)6]Cl 3 [Cr. Cl(H 2 O)5]Cl 2×H](https://slidetodoc.com/presentation_image_h2/3dfcc2de24de99409e03bee27e3a231b/image-21.jpg)



![ZADATCI: 6. Koliko kompleksni spoj formule [Cr(NH 3)4 Cl 2]Cl ima izomera? Skicirajte ih. ZADATCI: 6. Koliko kompleksni spoj formule [Cr(NH 3)4 Cl 2]Cl ima izomera? Skicirajte ih.](https://slidetodoc.com/presentation_image_h2/3dfcc2de24de99409e03bee27e3a231b/image-30.jpg)

![ZADATCI: 8. Koliko geometrijskih i optičkih izomera ima kompleksni ion [Co(en)2 Cl 2]-? Koliko ZADATCI: 8. Koliko geometrijskih i optičkih izomera ima kompleksni ion [Co(en)2 Cl 2]-? Koliko](https://slidetodoc.com/presentation_image_h2/3dfcc2de24de99409e03bee27e3a231b/image-32.jpg)



- Slides: 38

Kompleksni spojevi

Što su kompleksni spojevi? sastoje se od centralnog atoma (iona) i liganada p koordinacijski spojevi - imaju koordinacijsku vezu p koordinacijska veza je donorsko akceptorska veza koja nastaje iz elektronskog para samo jednog od atoma u vezi p koordinacijski broj, KB, centralnog atoma ukupan broj mjesta zauzetih ligandima p

KB može biti u rasponu od 2 do 8 p najmanje su zastupljeni kompleksni spojevi s neparnim KB p od parnih KB najčešći je koordinacijski broj 6 p Monovalentni kation Divalentni kation Trivalentni kation Ag+ KB 2 Co 2+ KB 4 i 6 Au 3+ KB 4 Cu+ KB 2 i 4 Ni 2+ KB 4 i 6 Cr 3+ KB 4 i 6 Fe 2+ 6 Co 3+ KB 4 i 6 Zn 2+ KB 4 i 6

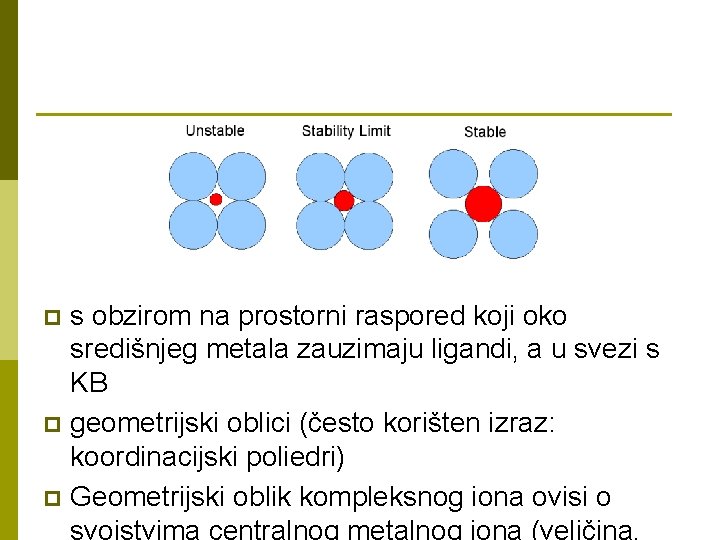
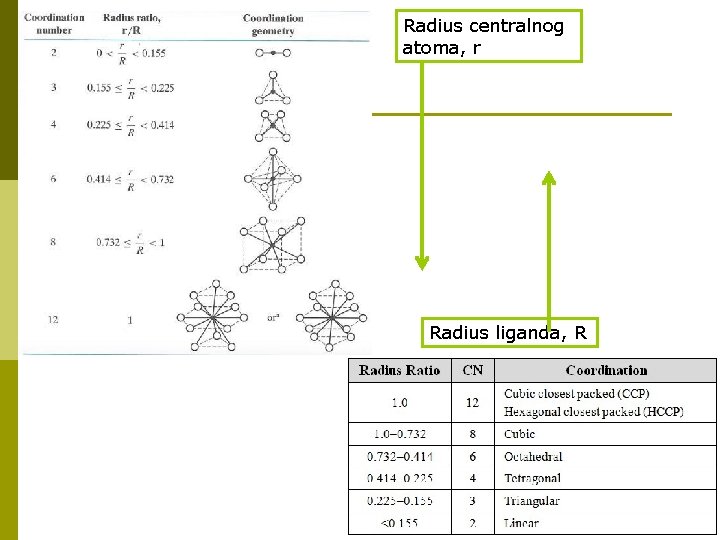
s obzirom na prostorni raspored koji oko središnjeg metala zauzimaju ligandi, a u svezi s KB p geometrijski oblici (često korišten izraz: koordinacijski poliedri) p Geometrijski oblik kompleksnog iona ovisi o svojstvima centralnog metalnog iona (veličina, p
![geometrijski oblici naziv oblika primjer linearan oblik AgNH 32 tetraedar ZnNH 342 kvadrat Au geometrijski oblici naziv oblika primjer linearan oblik [Ag(NH 3)2]+ tetraedar [Zn(NH 3)4]2+ kvadrat [Au.](https://slidetodoc.com/presentation_image_h2/3dfcc2de24de99409e03bee27e3a231b/image-5.jpg)
geometrijski oblici naziv oblika primjer linearan oblik [Ag(NH 3)2]+ tetraedar [Zn(NH 3)4]2+ kvadrat [Au. Cl 4]3− oktaedar [Co(NH 3)6]3+

Radius centralnog atoma, r Radius liganda, R

Ligandi - Lewisove baze podjela n obzirom na naboj: p anionski, p neutralni, p kationski n ovisno o tome koliko nepodjeljenih elektronskih parova doniraju u slobodne orbitale središnjeg iona/atoma metala: p monodentatni, p bidentatni i p polidentatni

Vrste liganada monodentatni (jednozubi) – doniraju 1 elektronski par


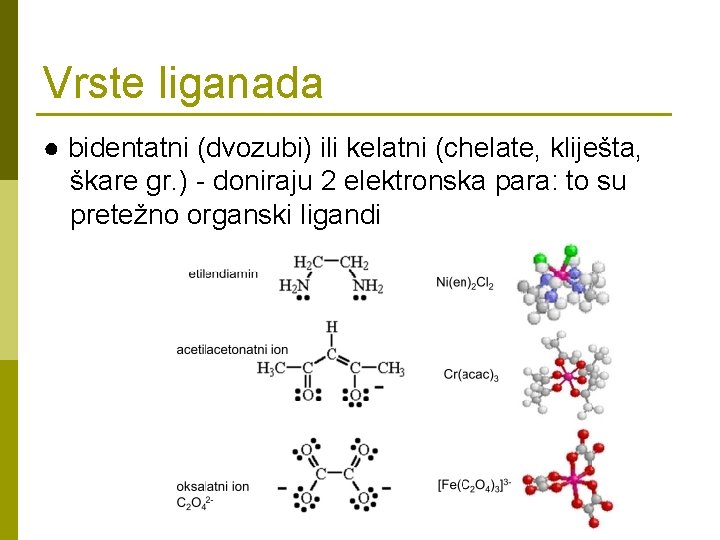
Vrste liganada ● bidentatni (dvozubi) ili kelatni (chelate, kliješta, škare gr. ) - doniraju 2 elektronska para: to su pretežno organski ligandi

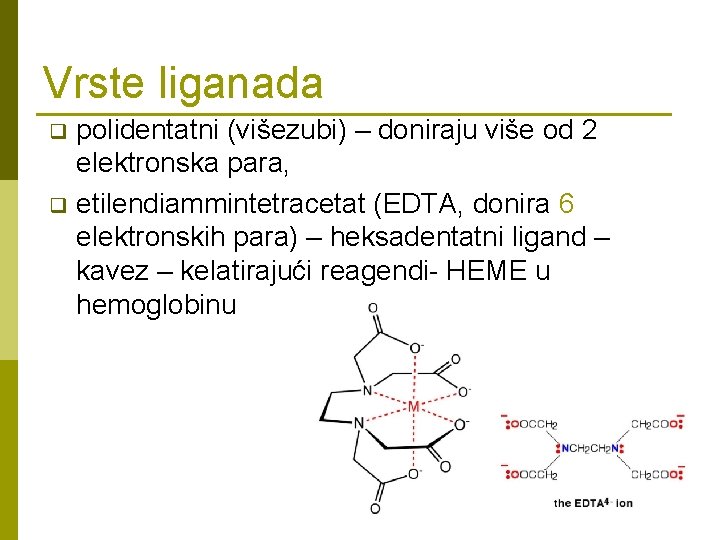
Vrste liganada polidentatni (višezubi) – doniraju više od 2 elektronska para, q etilendiammintetracetat (EDTA, donira 6 elektronskih para) – heksadentatni ligand – kavez – kelatirajući reagendi- HEME u hemoglobinu q

NOMENKLATURA KOMPLEKSNIH SPOJEVA Koordinacijska nomenklatura
![Koordinacijska nomenklatura kationa 1 Kompleksni ioni pišu se u uglatim zagradama Osnovno Koordinacijska nomenklatura kationa (1) Kompleksni ioni pišu se u uglatim zagradama [ ]. Osnovno](https://slidetodoc.com/presentation_image_h2/3dfcc2de24de99409e03bee27e3a231b/image-13.jpg)
Koordinacijska nomenklatura kationa (1) Kompleksni ioni pišu se u uglatim zagradama [ ]. Osnovno ime daje centralni atom. Kod kompleksnog kationa - hrvatski naziv elementa bez nastavka (bakrov, kromov, kositrov, itd. . . [Co(NH 3)5(ONO)]2+ kobaltov( ) kation (2) Ispred osnovnog imena dolaze imena liganada. (3) ispred imena liganda dolazi njegov broj u grčkom jeziku: mono-, di-, tri-, tetra- itd. Ako je ligand kompleksnog sastava ili organska molekula ili ion, stavlja se u okruglu zagradu, a ispred zagrade dolazi njegov broj, i to: bis-, tris-, tetrakis- itd. [Co(NH 3)5(ONO)]2+ penta_____kobaltov( ) kation

→ neki česti jednostavni ligandi naziv molekule / iona naziv u kompleksu MONODENTATNI - NEUTRALNI H 2 O NH 3 CO voda amonijak ugljični monoksid -akva-ammin-karbonil- MONODENTATNI - ANIONSKI F− Cl− Br− I− CN− S 2− OCN− NCO− SCN− NCS− fluoridni ion kloridni ion bromidni ion jodidni ion cijanidni ion sulfidni ion cijanatni ion izocijanatni ion tiocijanatni / rodanidni izotiocijanatni ion -fluoro-kloro-bromo-jodo-cijano-sulfido-cijanato-izocijanato-tio. . . - / -rodanato-izotiocijanato- MONODENTATNI - KATIONSKI NO+ nitronijev ion -nitrozil- BIDENTATNI H 2 NCH 2 NH 2 −OOCCOO− (C O 2 -) 2 4 etilendiamin oksalatni ion -etilendiamin-oksalato-

Koordinacijska nomenklatura kationa (4) I u imenu i u formuli ligandi dolaze abecednim redom bez obzira na njihov naboj. [Co(NH 3)5(ONO)]2+ penta_____kobaltov( ) kation pentaaminnitritokobaltov( ) kation (5) Oksidacijski broj centralnog atoma dolazi u zagradi iza njegova imena (rimski broj). +3 [Co(NH 3)5(ONO)]2+ pentaaminnitritokobaltov(III) kation

Koordinacijska nomenklatura aniona (1) Osnovno ime daje centralni atom. Kod kompleksnog aniona doda se nastavak -at, npr. : ferat, kobaltat, argentat, kromat, kuprat, cinkat, plumbat, aluminat, galat, itd. [Fe(CN)6]4 ferat( ) (2), (3) [Fe(CN)6]4 heksa____ferat( ) (4), (5) +2 [Fe(CN)6]4 heksacianoferat(II)

Koordinacijska nomenklatura spojeva Ime spoja sastoji se (složenica) od imena kationa i aniona, i to ime kationa uvijek je prvo. spoj: SO 4 kation: [Co(H 2 O)(NH 3)4 OH] +3 [Co(H 2 O)(NH 3)4 OH]2+ 2+ akvatetraaminhidroksokobaltov(IIl) 2 anion: SO 42 tetraoksosulfat(VI) ili sulfat [Co(H 2 O)(NH 3)4 OH]SO 4 akvatetraaminhidroksokobaltov(IIl) sulfat akvatetraaminhidroksokobaltov(IIl) tetraoksosulfat(VI)
![1 Napišite koordinacijski broj metala i dajte racionalna imena slijedećim spojevima AgNH 32Cl diamminsrebrovI 1. Napišite koordinacijski broj metala i dajte racionalna imena slijedećim spojevima [Ag(NH 3)2]Cl diamminsrebrov(I)](https://slidetodoc.com/presentation_image_h2/3dfcc2de24de99409e03bee27e3a231b/image-18.jpg)
1. Napišite koordinacijski broj metala i dajte racionalna imena slijedećim spojevima [Ag(NH 3)2]Cl diamminsrebrov(I) klorid p [Cr(Cl)2(H 2 O)4]Cl tetraakvadiklorokromov(III) klorid p [Cu(en)2]SO 4 bis(etilendiamin)bakrov(II) sulfat p Na[Ag(Cl)2] natrijev dikloroargentat(I) p [Ni(CO)4] tetrakarbonilnikal(0) p [Pt(NH 3)4][Pt(Cl)6] tetraamminplatinin(II) heksakloroplatinat(IV) p

2. Napišite formulu za svaki od slijedećih spojeva ili iona akvatetraamminklorokobaltov(III) ion [Co. Cl(H 2 O)(NH 3)4]2+ p tetrakloromerkurat(II) ion [Hg. Cl 4]2− p pentaakvahidroksoaluminijev(III) klorid [Al(H 2 O)5 OH]Cl 2 p natrijev trikarbonatokobaltat(III) Na 3[Co(CO 3)3] p natrijev heksacijanoferat(II) Na 4[Fe(CN)6] p amonijev heksanitrokobaltat(III) (NH 4)3[Co(NO 2)6] p

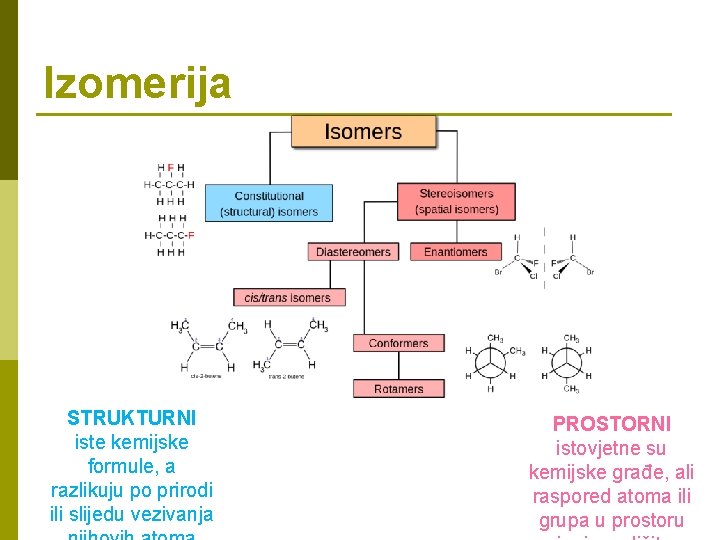
Izomerija STRUKTURNI iste kemijske formule, a razlikuju po prirodi ili slijedu vezivanja PROSTORNI istovjetne su kemijske građe, ali raspored atoma ili grupa u prostoru
![Strukturna izomerija p Hidratna izomerija CrH 2 O6Cl 3 Cr ClH 2 O5Cl 2H Strukturna izomerija p Hidratna izomerija [Cr(H 2 O)6]Cl 3 [Cr. Cl(H 2 O)5]Cl 2×H](https://slidetodoc.com/presentation_image_h2/3dfcc2de24de99409e03bee27e3a231b/image-21.jpg)
Strukturna izomerija p Hidratna izomerija [Cr(H 2 O)6]Cl 3 [Cr. Cl(H 2 O)5]Cl 2×H 2 O [Cr. Cl 2(H 2 O)4]Cl× 2 H 2 O p Ionizacijska izomerija [Co. Cl(NH 3)4(NO 2)]Cl [Co. Cl 2(NH 3)4]NO 2 Koordinacijska izomerija [Co(NH 3)5(: NO 2)]2+ [Co(NH 3)5(: ONO)]2+ p p Solna izomerija - atomska skupina unutar kompleksnog iona vezana na centralni ion preko različitih atoma, 2+ 2+ 2 -

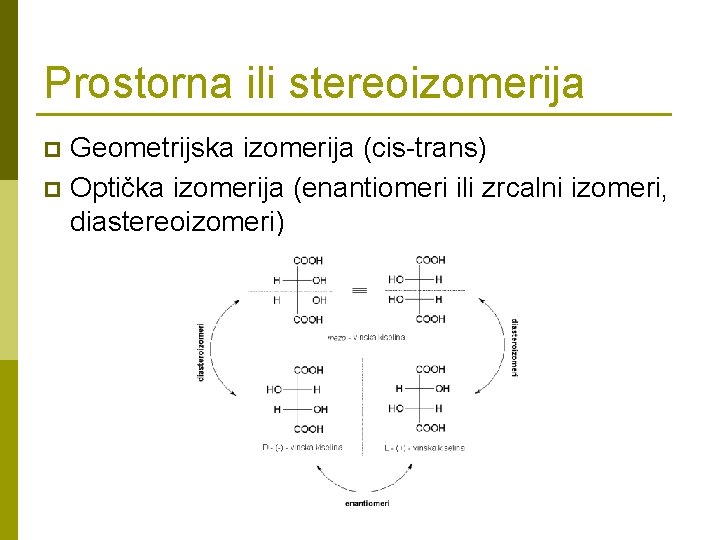
Prostorna ili stereoizomerija Geometrijska izomerija (cis-trans) p Optička izomerija (enantiomeri ili zrcalni izomeri, diastereoizomeri) p

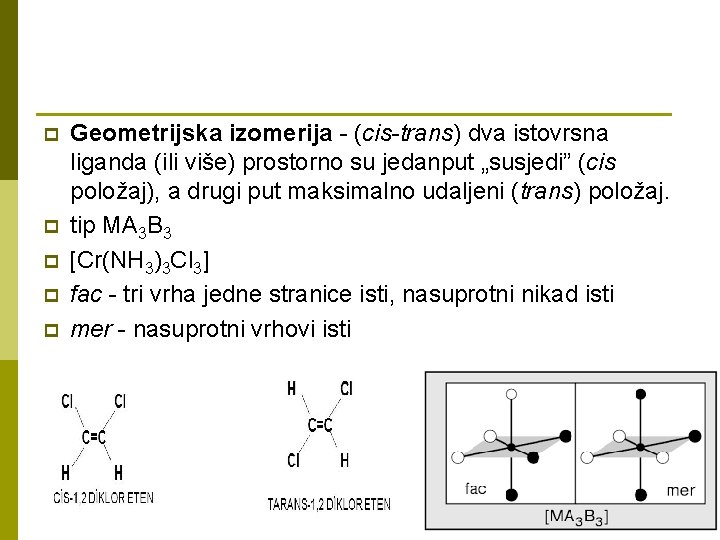
p p p Geometrijska izomerija - (cis-trans) dva istovrsna liganda (ili više) prostorno su jedanput „susjedi” (cis položaj), a drugi put maksimalno udaljeni (trans) položaj. tip MA 3 B 3 [Cr(NH 3)3 Cl 3] fac - tri vrha jedne stranice isti, nasuprotni nikad isti mer - nasuprotni vrhovi isti

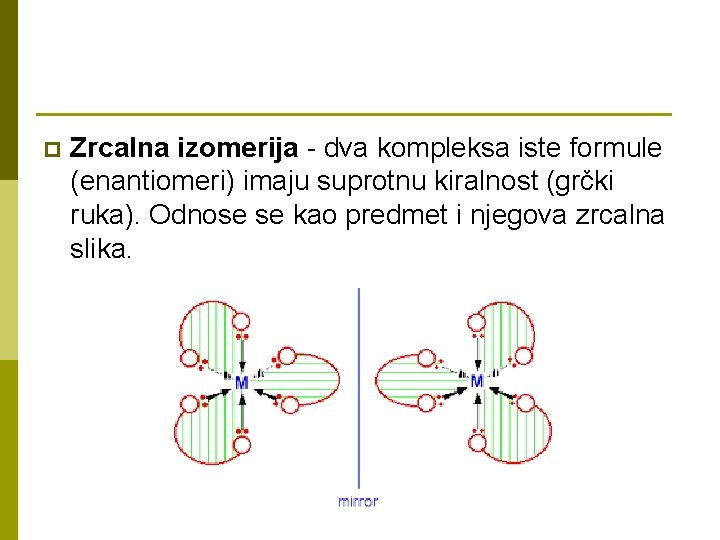
p Zrcalna izomerija - dva kompleksa iste formule (enantiomeri) imaju suprotnu kiralnost (grčki ruka). Odnose se kao predmet i njegova zrcalna slika.

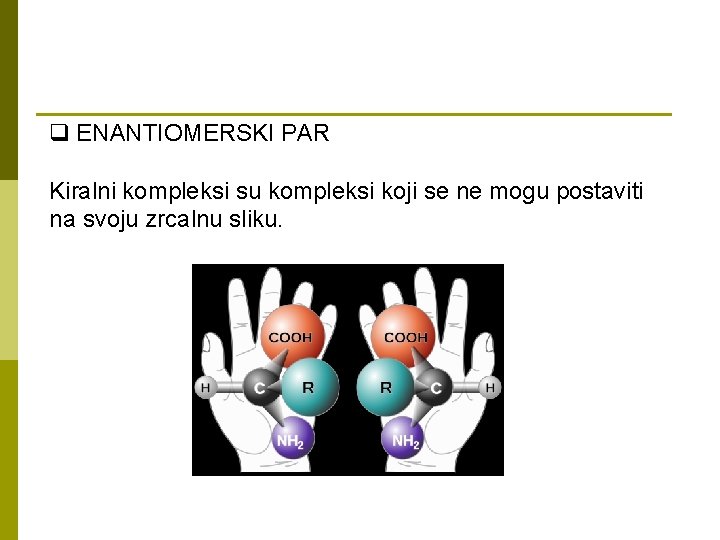
q ENANTIOMERSKI PAR Kiralni kompleksi su kompleksi koji se ne mogu postaviti na svoju zrcalnu sliku.

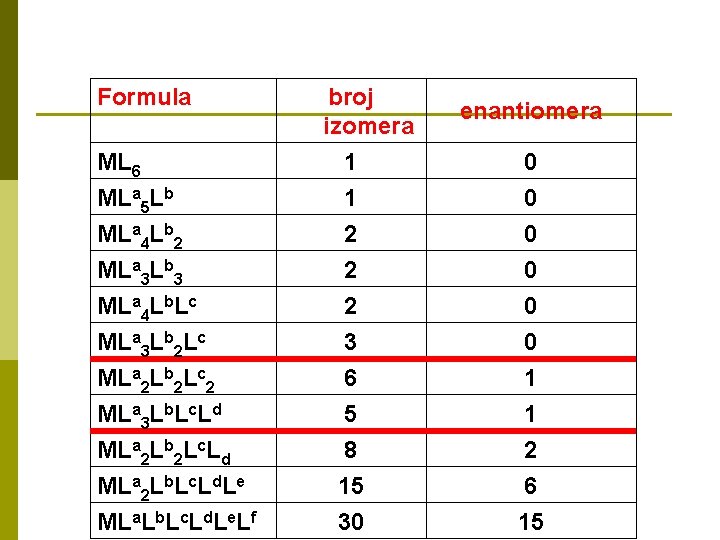
Formula ML 6 MLa 5 Lb MLa 4 Lb 2 MLa 3 Lb 3 MLa 4 Lb. Lc MLa 3 Lb 2 Lc MLa 2 Lb 2 Lc 2 MLa 3 Lb. Lc. Ld MLa 2 Lb 2 Lc. Ld MLa 2 Lb. Lc. Ld. Le MLa. Lb. Lc. Ld. Le. Lf broj izomera 1 1 2 2 2 3 6 5 8 15 30 enantiomera 0 0 0 1 1 2 6 15

ZADATCI: 3. Kada se srebrov(I) nitrat doda u otopinu tvari empirijske formule Co. Cl 3 × 5 NH 3, koliko će se molova Ag. Cl istaložiti po molu kobalta? Zašto? n Imenovati kompleks kobalta… nacrtati… odrediti broj izomera…. Kobalt(III) tvori oktaedarski kompleks. Dakle, pet molekula amonijaka i jedan kloridni ion su u unutarnjoj sferi, ostavljajući dva Cl - da reagiraju. Tako da su u otopini 2 mola kloridnih iona po 1 molu kobalta(III). To znači da će se taložiti, uz pretpostavku da je srebrov(I) nitrat u suvišku, 2 mola srebrovog(I) klorida.

ZADATCI: 4. Co(III) pojavljuje se kod oktaedarskih kompleksnih spojeva opće empirijske formule Co. Clm × n. NH 3. Koje su vrijednosti n i m moguće? Koje su vrijednosti n i m za kompleks koji taloži 1 mol Ag. Cl za svaki prisutan mol Co? Naboj kobalta je 3+ dovoljno kloridnih iona da neutralizira naboj centralnog metalnog iona 3+ m mora biti jednak 3 n može biti jednak 6, 5, 4 ili 3 (ovisno o tome koliko kloridnih iona dolazi kao ligand i imajući na umu da Co(III) mora imati šest liganada, KB = 6). Za kompleks koji taloži 1 mol Ag. Cl n = 4 i m = 3. Budući da samo slobodni Cl- ioni ragiraju sa Ag+ i talože Ag. Cl. Druga dva Cl- dolaze kao ligandi.

ZADATCI: 5. Koliko iona po molu očekujete da ćete naći u otopini kada se spoj empirijske formule Pt. Cl 4 - × 3 NH 3 otopi u vodi? Što je s Pt. Cl 2 × 3 NH 3? Nacrtajte strukturne formule svih kompleksnih kationa. Pt. Cl 4 -: 3 iona Pt. Cl 2: 0 iona [Pt(NH 3)2 Cl 2]+ [Pt(NH 3)2 Cl 2] Cl- Cl. NH 3
![ZADATCI 6 Koliko kompleksni spoj formule CrNH 34 Cl 2Cl ima izomera Skicirajte ih ZADATCI: 6. Koliko kompleksni spoj formule [Cr(NH 3)4 Cl 2]Cl ima izomera? Skicirajte ih.](https://slidetodoc.com/presentation_image_h2/3dfcc2de24de99409e03bee27e3a231b/image-30.jpg)
ZADATCI: 6. Koliko kompleksni spoj formule [Cr(NH 3)4 Cl 2]Cl ima izomera? Skicirajte ih. 2 izomera trans cis

ZADATCI: 7. Skicirajte sve geometrijske i optičke izomere kompleksnog spoja formule [Pt. Cl 2 l 2(NH 3)2].
![ZADATCI 8 Koliko geometrijskih i optičkih izomera ima kompleksni ion Coen2 Cl 2 Koliko ZADATCI: 8. Koliko geometrijskih i optičkih izomera ima kompleksni ion [Co(en)2 Cl 2]-? Koliko](https://slidetodoc.com/presentation_image_h2/3dfcc2de24de99409e03bee27e3a231b/image-32.jpg)
ZADATCI: 8. Koliko geometrijskih i optičkih izomera ima kompleksni ion [Co(en)2 Cl 2]-? Koliko izomera ima ravninu simetrije i stoga ne postoje u parovima optičkih izomera? 2 geometrijska izomera (cis i trans) 2 optička izomera (oba cis) Trans izomer ima ravninu simetrije koja sadrži oba Cl atoma i Co atom, tako da ne postoji u paru optičkih izomera.

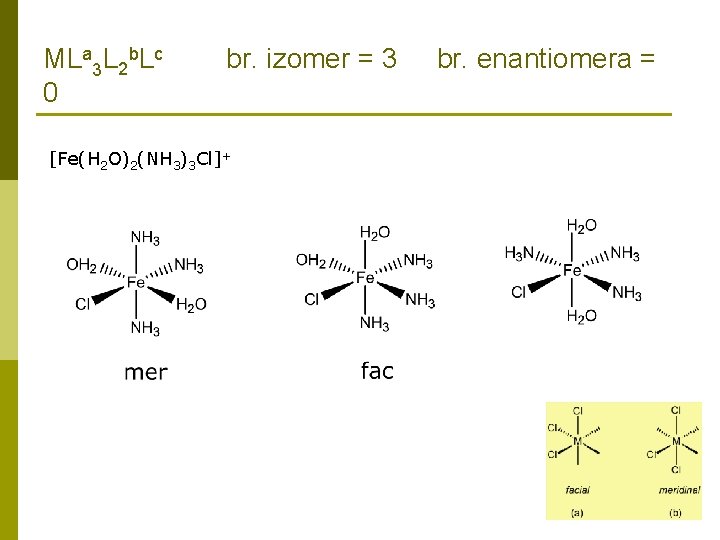
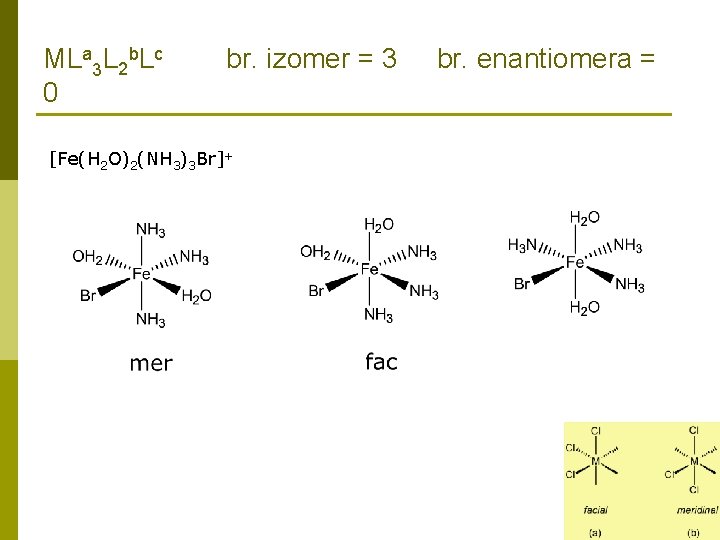
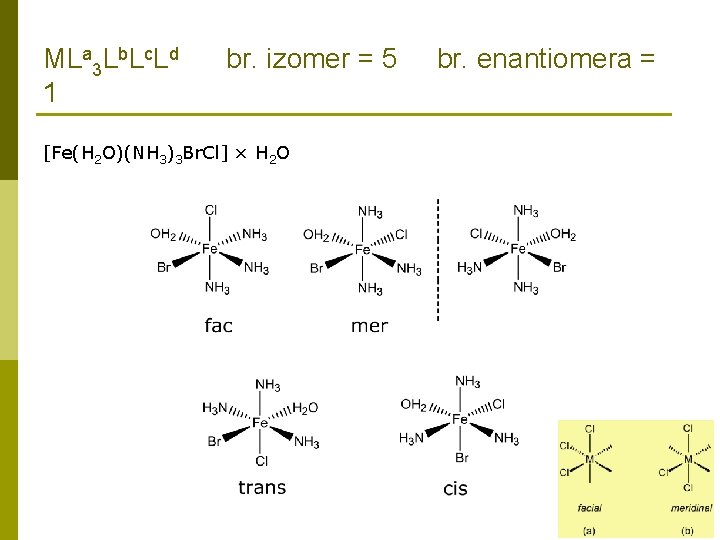
ZADATCI: 9. Koliko različitih strukturnih izomera ima spoj empirijske formule Fe. Br. Cl × 3 NH 3 × 2 H 2 O. Za svaki različiti strukturni izomer, koliko različitih geometrijskih izomera postoji? Koliko ih se može grupirati u enantiomerski par? Ionizacijska izomerija [Fe(H 2 O)2(NH 3)3 Br]Cl [Fe(H 2 O)2(NH 3)3 Cl]Br Hidratna izomerija [Fe(H 2 O)2(NH 3)3 Br]Cl [Fe(H 2 O)(NH 3)3 Br. Cl] × H 2 O

MLa 3 L 2 b. Lc 0 br. izomer = 3 [Fe(H 2 O)2(NH 3)3 Cl]+ br. enantiomera =

MLa 3 L 2 b. Lc 0 br. izomer = 3 [Fe(H 2 O)2(NH 3)3 Br]+ br. enantiomera =

MLa 3 Lb. Lc. Ld 1 br. izomer = 5 [Fe(H 2 O)(NH 3)3 Br. Cl] × H 2 O br. enantiomera =

ZADATCI: 10. Nacrtajte strukture svih geometrijskih i, ili, optičkih izomera slijedećih kompleksnih iona: a) [Ni(H 2 O)4(NH 3)2]2+ b) [Cu(en)(H 2 O)4]2+ c) [Fe(C 2 O 4)3]3 d) [Cr(O 2)4]3 e) [Cr(en)2 Br 2]+ 11. Odredite koje od slijedećih struktura mogu imati geometrijsku izomeriju: linearna, kvadratna, tetraedarska i oktaedarska? Rj. kvadratna i oktaedarska

https: //chem. libretexts. org/Bookshelves/General_Chemistry/Map%3 A_Ch emistry__The_Central_Science_(Brown_et_al. )/24%3 A_Chemistry_of_Coordinatio n_Chemistry/24. E%3 A_Chemistry_of_Coordination_Chemistry_(Exercise s)