Termodinamica Studia lenergia coinvolta nelle trasformazioni a livello




















- Slides: 31

Termodinamica • Studia l’energia coinvolta nelle trasformazioni a livello macroscopico. • Ha a che fare con le trasformazioni dell’energia, sotto forma di calore e lavoro, e con le proprietà fisiche delle sostanze coinvolte nelle trasformazioni • La termodinamica è usata per capire e descrivere i sistemi che subiscono variazioni di energia • La termodinamica studia gli scambi di energia tra il sistema e l'ambiente con lo scopo di individuare le condizioni in cui il sistema è in equilibrio o quelle in cui tende ad evolvere spontaneamente.

• Si definisce sistema: – Un sistema fisico sufficientemente grande da essere osservabile direttamente è detto un sistema macroscopico, ossia una quantità di materia o la regione dello spazio da studiare o da analizzare • Si definisce ambiente: – La regione al di fuori del sistema L’insieme di sistema più ambiente si chiama universo Sono ad esempio sistemi termodinamici: una quantità di ossigeno; una quantità d'acqua; un pezzo di ferro; un sasso; una soluzione di un acido. ambiente sistema

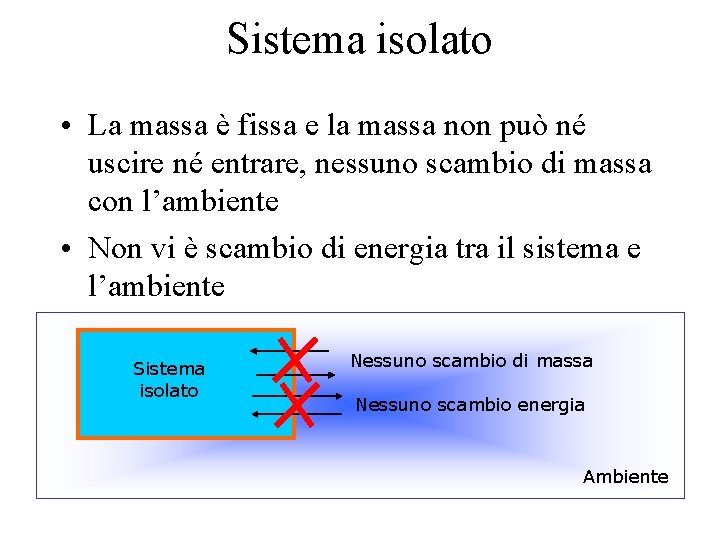
Sistema isolato • La massa è fissa e la massa non può né uscire né entrare, nessuno scambio di massa con l’ambiente • Non vi è scambio di energia tra il sistema e l’ambiente Sistema isolato Nessuno scambio di massa Nessuno scambio energia Ambiente

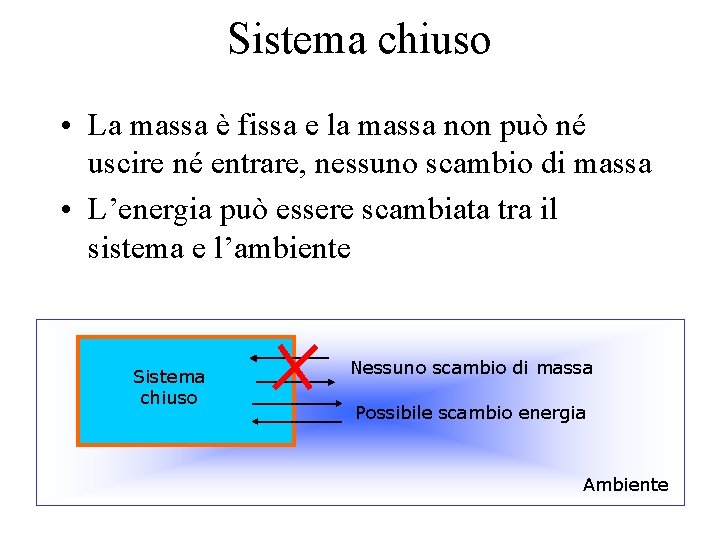
Sistema chiuso • La massa è fissa e la massa non può né uscire né entrare, nessuno scambio di massa • L’energia può essere scambiata tra il sistema e l’ambiente Sistema chiuso Nessuno scambio di massa Possibile scambio energia Ambiente

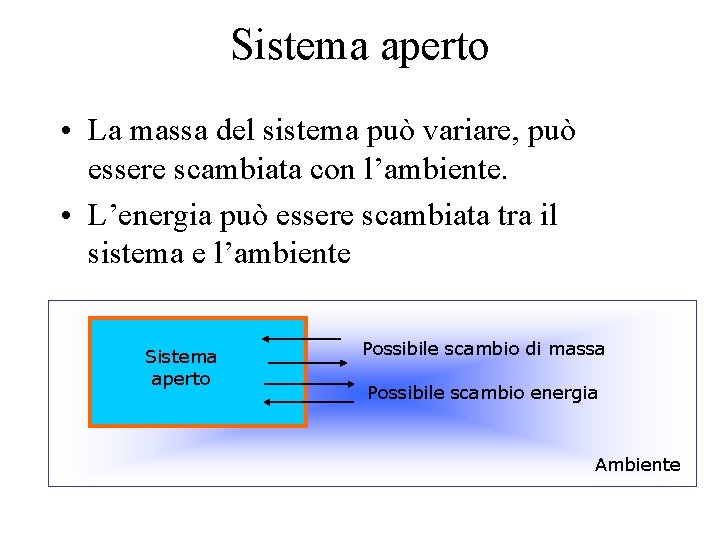
Sistema aperto • La massa del sistema può variare, può essere scambiata con l’ambiente. • L’energia può essere scambiata tra il sistema e l’ambiente Sistema aperto Possibile scambio di massa Possibile scambio energia Ambiente

Proprietà del sistema • Intensive – Indipendenti dalla estensione del sistema, ossia dalle quantità di materia del sistema e dalle sue dimensioni, ma dipendono solo dalla sua natura e dalle condizioni nel quale si trova: • Temperatura • Densità • Pressione etc. • Estensive – Dipendenti dalla estensione del sistema, ossia dalle massa e quantità di sostanza del sistema, ossia dalle dimensioni del sistema: • Massa • Volume • Energia totale etc.

Definizione di stato termodinamico di un sistema • Un sistema generico viene descritto da una serie di proprietà globali (macroscopiche): T, P, V, massa, energia etc. . . • Se le proprietà – non variano nel tempo – hanno lo stesso valore in tutti i punti dello spazio allora un sistema si dice che è in equilibrio termodinamico e rappresenta uno stato termodinamico

Stato e Equilibrio • Stato – Condizione di un sistema come specificato dai valori delle sue proprietà (T=5. 0°C, P=1 atm, volume, quantità di materia) – Se le proprietà cambiano il sistema raggiunge. P un nuovo stato • Equilibrio – Non esistono sbilanciamenti o forze che spingono a variazioni del sistema – Il sistema è in equilibrio quando non subisce cambiamenti macroscopici S 2 S 1 V

Equilibrio • Equilibrio termico – Non esiste un gradiente di temperatura all’interno del sistema T 2 T 1 • Equilibrio meccanico – La pressione è costante in ogni punto del sistema P 2 P 1 = P 2 T 1 = T 2

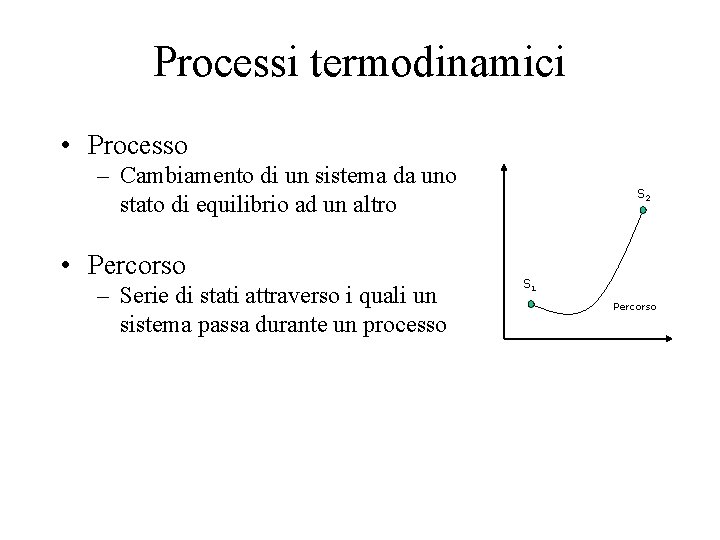
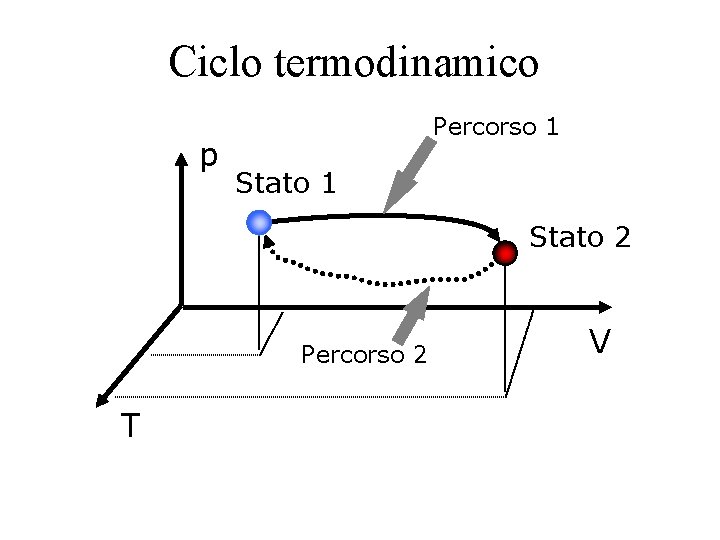
Processi termodinamici • Processo – Cambiamento di un sistema da uno stato di equilibrio ad un altro • Percorso – Serie di stati attraverso i quali un sistema passa durante un processo S 2 S 1 Percorso

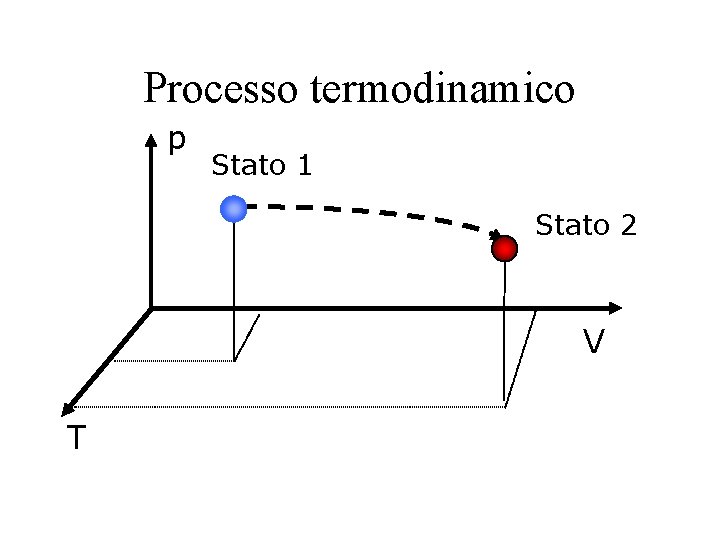
Processo termodinamico p Stato 1 Stato 2 V T

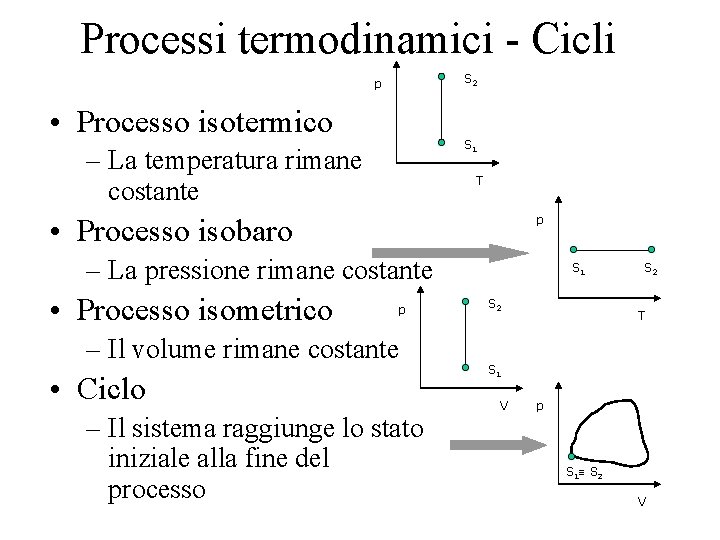
Processi termodinamici - Cicli S 2 p • Processo isotermico S 1 – La temperatura rimane costante T p • Processo isobaro – La pressione rimane costante • Processo isometrico p – Il volume rimane costante • Ciclo – Il sistema raggiunge lo stato iniziale alla fine del processo S 1 S 2 T S 1 V p S 1 S 2 V

Ciclo termodinamico p Percorso 1 Stato 2 Percorso 2 T V

La temperatura del sistema rappresenta l'indice del grado di agitazione delle sue particelle costituenti ed è direttamente correlata alla velocità media delle particelle, e all'energia cinetica media, di queste ultime. ‹Ec›= 3/2 k. T = ½ m ‹v› 2 T = (½ m ‹v› 2) / (3/2 k)

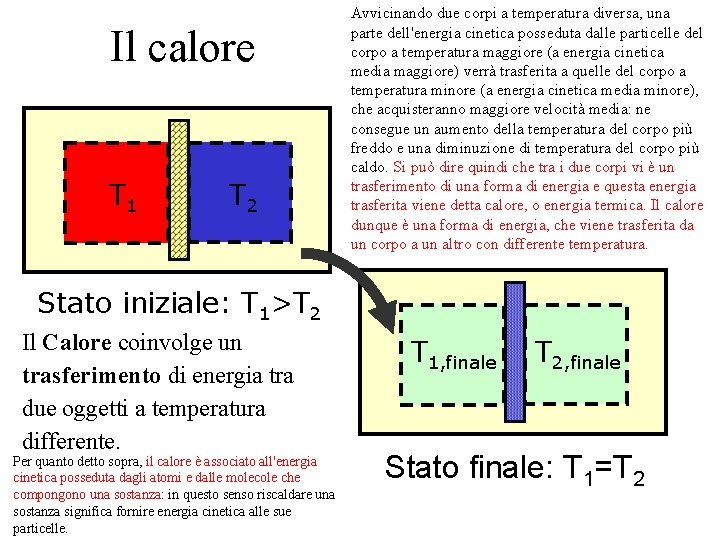
Il calore T 1 T 2 Avvicinando due corpi a temperatura diversa, una parte dell'energia cinetica posseduta dalle particelle del corpo a temperatura maggiore (a energia cinetica media maggiore) verrà trasferita a quelle del corpo a temperatura minore (a energia cinetica media minore), che acquisteranno maggiore velocità media: ne consegue un aumento della temperatura del corpo più freddo e una diminuzione di temperatura del corpo più caldo. Si può dire quindi che tra i due corpi vi è un trasferimento di una forma di energia e questa energia trasferita viene detta calore, o energia termica. Il calore dunque è una forma di energia, che viene trasferita da un corpo a un altro con differente temperatura. Stato iniziale: T 1>T 2 Il Calore coinvolge un trasferimento di energia tra due oggetti a temperatura differente. Per quanto detto sopra, il calore è associato all'energia cinetica posseduta dagli atomi e dalle molecole che compongono una sostanza: in questo senso riscaldare una sostanza significa fornire energia cinetica alle sue particelle. T 1, finale T 2, finale Stato finale: T 1=T 2

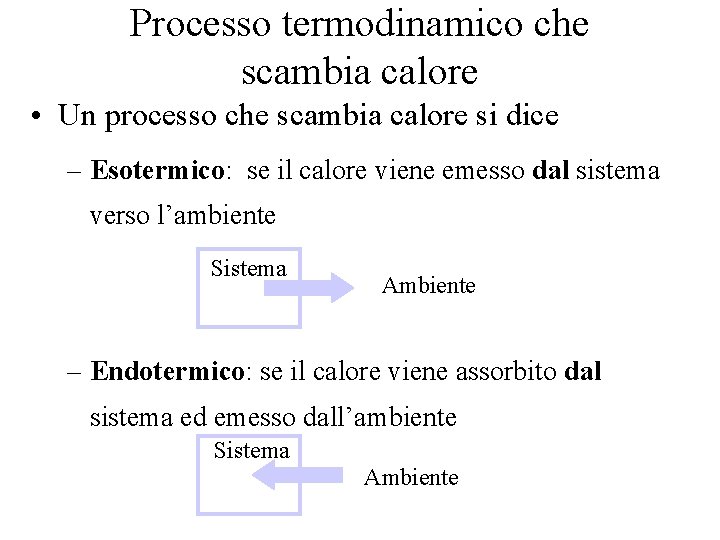
Processo termodinamico che scambia calore • Un processo che scambia calore si dice – Esotermico: se il calore viene emesso dal sistema verso l’ambiente Sistema Ambiente – Endotermico: se il calore viene assorbito dal sistema ed emesso dall’ambiente Sistema Ambiente

• Calore, q = trasferimento di energia per effetto di una differenza di temperatura. • Lavoro, w = movimento contro una forza che vi si oppone. w = Forza x distanza

Tipi di lavoro w Espansione -Pexd. V ovvero Pgasd. V Estensione f. Dl f è la tensione e l è la variazione di lunghezza Sollevamento di peso mg. Dh m è la massa, g è l’accellerazione di gravità e la variazione di altezza Elettrico f. Dq f è il potenziale elettrico e Dq è la carica spostata Espansione della superficie g. DA g è la tensione superficiale e DA è la variazione di area

In termodinamica, l’energia è la capacità di compiere lavoro da parte di un sistema. Ossia se un sistema è in grado di compiere molto lavoro ha tanta energia. Es. Una molla compressa può compiere più lavoro di una molla distesa. Un gas compresso più di uno espanso

Energia Interna • Viene postulata l’esistenza di una funzione U chiamata Energia Interna • L’Energia Interna di un sistema si accumula sotto forma di energia cinetica e di energia potenziale. L'energia interna (U) di un sistema termodinamico è data dalla somma (∑) di tutte le energie cinetica e potenziale delle particelle che lo compongono: U = ∑(Ec + Ep) • L'energia potenziale di un sistema non è altro che l'energia chimica del sistema, ovvero la somma di tutte le energie dei legami (intramolecolari e intermolecolari) presenti nel sistema. • L’energia cinetica è legata al grado di agitazione delle particelle costituenti il sistema. • Ogni sistema ha un suo contenuto di energia (energia interna, U) dovuta a tutti i contributi di energia legati al suo stato: energia dovuta al legame tra nucleo ed elettroni, energia nucleare, energia cinetica (traslazionale, oscillatoria, vibrazionale etc. ), energia di legame (se è un composto) ecc. • Il valore dell'energia U di un sistema non è noto; questo però non costituisce una limitazione in quanto la termodinamica si occupa soprattutto delle differenze di energia tra due stati diversi e non ai valori assoluti dell'energia in ciascuno stato.

Il primo principio della termodinamica (enunciato da R. Clausius nel 1865) afferma che: l'energia può essere convertita da una forma in un'altra ma non può essere nè creata nè distrutta.

Quindi, in base al primo principio della termodinamica, affinché si abbia variazione dell'energia interna di un sistema, questo deve scambiare energia con l'esterno. Ogni scambio di energia fra un sistema e l'esterno avviene o tramite lavoro o per passaggio di calore. Un sistema contiene solo energia interna, non energia sotto forma di calore o lavoro. Calore e lavoro sono solo i mezzi con i quali il sistema scambia energia con l’ambiente. Calore e lavoro esistono quindi solo durante un processo del sistema

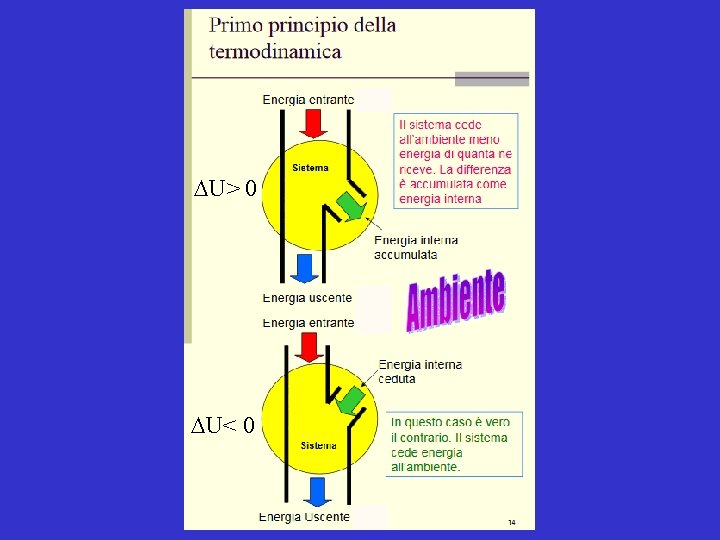
Primo principio della termodinamica Dati due stati A e B in un sistema chiuso, la variazione di energia interna Δ U = U(A) - U(B) del sistema durante la trasformazione è il risultato complessivo di calore e lavoro trasferito tra sistema e ambiente: DU = q + w Quindi: un sistema può variare il proprio contenuto di energia solo attraverso scambi di calore e di lavoro con l'ambiente. E' questo un modo alternativo di enunciare il primo principio della termodinamica. Per il sistema isolato (sistema + ambiente) vale la relazione: ∆U (sistema isolato) = 0 per cui, ad una determinata variazione dell'energia del sistema corrisponde una identica - ma di segno opposto - variazione di energia dell'ambiente.

Convenzioni • Per convenzione, Lavoro e Calore sono negativi se diminuiscono l’energia del sistema, positivi se l’aumentano • Lavoro: > 0 se è fatto sul sistema < 0 se è fatto dal sistema • Calore: > 0 se è assorbito dal sistema < 0 se è emesso dal sistema

DU> 0 DU< 0

Energia interna e trasformazioni chimiche Le trasformazioni chimiche sono sempre accompagnate dallo scambio tra le due forme di energia cinetica e potenziale, ossia variazione di energia interna. Infatti, nel corso di una reazione, avviene lo smantellamento delle molecole reagenti: gli atomi liberati si riassestano poi in modo diverso, stabilendo legami nuovi, quelli cioè dei prodotti della reazione. Possono verificarsi due casi: Se i nuovi legami, nel loro complesso, contengono una minore quantità di energia potenziale rispetto ai vecchi legami, la quantità di energia potenziale eccedente si trasforma in energia cinetica, cioè in calore (=energia termica), che viene ceduto all'ambiente: si ha una reazione esotermica. Se i nuovi legami, nel loro complesso, contengono una maggiore quantità di energia potenziale rispetto ai vecchi legami, il sistema assorbe dall'ambiente energia termica (= cinetica) che si trasforma in energia potenziale (di legame): si ha una reazione endotermica.

Le funzioni di stato • Le funzioni di stato dipendono soltanto dallo stato del sistema. • La variazione di una funzione di stato nel passare da uno stato all’altro è indipendente dal percorso fatto. • L’energia interna è funzione di stato; calore e lavoro non lo sono. Il passaggio dallo stato a allo stato b può avvenire in infiniti modi.

In chimica ci interessano trasformazioni a P costante, quella atmosferica Si definisce una funzione di stato entalpia, H: H = U + PV A pressione costante DH =Qp Durante una trasformazione fatta avvenire a pressione costante la variazione di entalpia del sistema corrisponde al calore scambiato.

Calore assorbito dal sistema e lavoro compiuto dal sistema d. U = d. Q - d. W I° Principio della termodinamica in forma differenziale Dato che d. W = Pd. V, ottengo: d. U = d. Q - Pd. V Dato che H = U + PV, ossia d. H = d. U + Pd. V + Vd. P, ottengo: d. H = d. Q - Pd. V + Vd. P Quindi: d. H = d. Q + Vd. P (per una trasformazione quasistatica) d. H = d. Qp (a Pressione costante) ossia DH = Qp

DH • L’entalpia di un sistema, che è una funzione di stato, misura l’energia del sistema disponibile in forma di calore a P costante. • Per un processo endotermico DH > 0 • Per un processo esotermico DH < 0

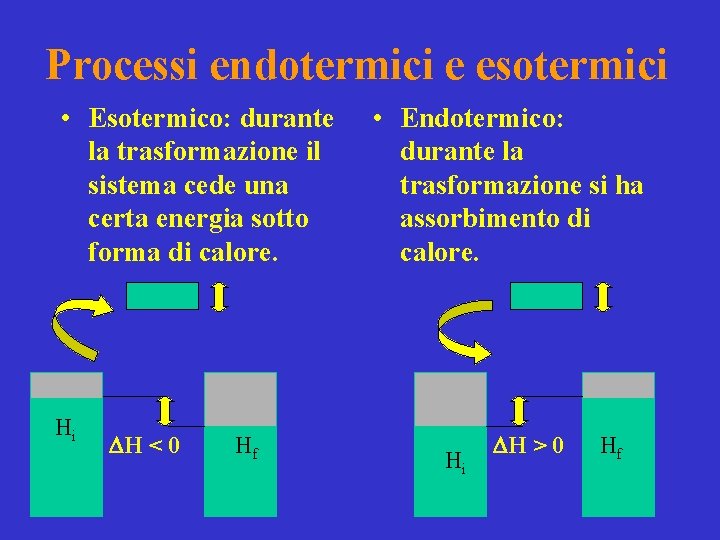
Processi endotermici e esotermici • Esotermico: durante la trasformazione il sistema cede una certa energia sotto forma di calore. Hi DH < 0 Hf • Endotermico: durante la trasformazione si ha assorbimento di calore. Hi DH > 0 Hf
 Scala del dolore
Scala del dolore Eqf significato
Eqf significato Livello di fabbisogno informativo
Livello di fabbisogno informativo Gerard genette narratologia
Gerard genette narratologia Livello transport
Livello transport Livello intensità sonora
Livello intensità sonora Codifica di alto livello
Codifica di alto livello Livello eqf
Livello eqf Diagnostica di primo livello
Diagnostica di primo livello Livello eqf
Livello eqf Livello metalmeccanico
Livello metalmeccanico Livello preconvenzionale
Livello preconvenzionale Valutazione formativa esempi
Valutazione formativa esempi Livello eqf
Livello eqf Livello eqf
Livello eqf Livello qeq
Livello qeq Livello qeq
Livello qeq Curve di livello
Curve di livello Linguaggio di alto livello
Linguaggio di alto livello Livello eqf
Livello eqf Il cibo nelle religioni scuola primaria
Il cibo nelle religioni scuola primaria Cristalli triplo fosfato nelle urine
Cristalli triplo fosfato nelle urine Risorsa limitata
Risorsa limitata Sangue occulto nelle feci falso allarme
Sangue occulto nelle feci falso allarme I diritti dei bambini nelle favole
I diritti dei bambini nelle favole Proposizioni interrogative dirette latino
Proposizioni interrogative dirette latino Determinazione ferro nelle acque
Determinazione ferro nelle acque L'acqua nelle religioni scuola primaria
L'acqua nelle religioni scuola primaria Plattegrond van nelle fabriek
Plattegrond van nelle fabriek Favole con metamorfosi
Favole con metamorfosi Perché vediamo cose nelle nuvole
Perché vediamo cose nelle nuvole Scienze della formazione nelle organizzazioni
Scienze della formazione nelle organizzazioni