Teorie kyselin a zsad Vpoty p H Joko




![p. H silných kyselin a zásad BOH B+ + OH- p. OH = -log[OH-] p. H silných kyselin a zásad BOH B+ + OH- p. OH = -log[OH-]](https://slidetodoc.com/presentation_image_h2/8e88e72f77e59fb8af5e4f3a2cc299a0/image-6.jpg)



![Soli slabých kyselin a silných zásad [CH 3 COO-][H+] KA = [CH 3 COOH] Soli slabých kyselin a silných zásad [CH 3 COO-][H+] KA = [CH 3 COOH]](https://slidetodoc.com/presentation_image_h2/8e88e72f77e59fb8af5e4f3a2cc299a0/image-10.jpg)





![1. c(KOH) = 0, 001 M = [K+] = [OH-] KOH K+ + OHp. 1. c(KOH) = 0, 001 M = [K+] = [OH-] KOH K+ + OHp.](https://slidetodoc.com/presentation_image_h2/8e88e72f77e59fb8af5e4f3a2cc299a0/image-18.jpg)






- Slides: 25

Teorie kyselin a zásad Výpočty p. H Joško Ivica

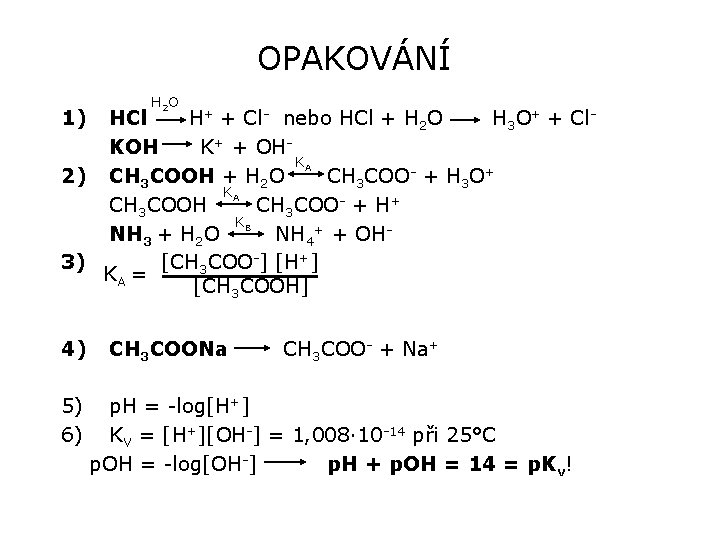
OTÁZKY - OPAKOVÁNÍ 1) 2) 3) 4) 5) 6) Napište vzorce kyseliny chlorovodíkové, hydroxidu draselného a reakce jejich disociace ve vodě Napište vzorce kyseliny octové, amoniaku a reakce jejich disociace Napište rovnici pro rovnovážnou konstantu disociace kyseliny octové Napište vzorec octanu sodného a reakci jeho disociace. Co je p. H? Iontový součin vody

OPAKOVÁNÍ 1) H 2 O HCl H+ + Cl- nebo HCl + H 2 O H 3 O+ + Cl. KOH K+ + OHKA 2) CH 3 COOH + H 2 O CH 3 COO- + H 3 O+ KA CH 3 COOH CH 3 COO- + H+ KB NH 3 + H 2 O NH 4+ + OH 3) [CH 3 COO-] [H+] KA = [CH 3 COOH] 4) 5) 6) CH 3 COONa CH 3 COO- + Na+ p. H = -log[H+] KV = [H+][OH-] = 1, 008· 10 -14 při 25°C p. OH = -log[OH-] p. H + p. OH = 14 = p. Kv!

Kyseliny a zásady Arrheniova teorie: Kyseliny jsou látky schopné disociovat ve vodě na vodíkový iont (H+) a příslušný anion (pouze vodné prostředí) HNO 3 H+ + NO 3 Zásady jsou sloučeniny, které ve vodě disociují na hydroxidový iont a kation Na. OH Na+ + OHBrønstedova teorie: Kyseliny jsou látky schopné uvolňovat H+, a zásady jsou látky schopné H+ vázat (platné i v nevodných prostředích) kyselina H+ + zásada konjugovaný pár

p. H silných kyselin a zásad HA H+ + A- úplná disociace kyseliny p. H = -log a(H+) c(HA) = [H+] = [A-] a – aktivita a(H+) = γ±·c(HA) γ± - střední aktivitní koeficient U velmi zředěných roztoků γ± = 1! p. H = -log[H+]
![p H silných kyselin a zásad BOH B OH p OH logOH p. H silných kyselin a zásad BOH B+ + OH- p. OH = -log[OH-]](https://slidetodoc.com/presentation_image_h2/8e88e72f77e59fb8af5e4f3a2cc299a0/image-6.jpg)
p. H silných kyselin a zásad BOH B+ + OH- p. OH = -log[OH-] úplná disociace zásady c(BOH) = [OH-] = [B+] p. H = 14 - p. OH = 14 + [log a(OH-)] a(OH-) = γ±·c(BOH) U velmi zředěných roztoků γ± = 1! p. H = 14 - p. OH = 14 + log [OH-]

p. H slabých kyselin a zásad Disociace slabých kyselin (Ka < 10 -4) c-x HA + H 2 O x x A- + H 3 O+ Ka = [A-][H 3 O+] c-x = koncentrace kyseliny při rovnováze [HA] = x 2 c-x = x 2 c x = koncentrace produktů při rovnováze c = počátečná koncentrace kyseliny c >> x u ředěných slabých kyselin p. Ka = -log. Ka p. H = -log[H 3 O+] = x = (Ka c)1/2 / log p. H = -log [H 3 O+] = ½ [p. Ka – log(c)]

p. H slabých kyselin a zásad Disociace slabých zásad c-x x BH+ B + H 2 O + x OH- Kb = c-x = koncentrace zásady při rovnováze x = koncentrace produktů při rovnováze [BH+][OH-] [BH] = x 2 c-x = c c >> x u ředěných slabých zásad c = počátečná koncentrace zásady p. Kb = -log. Kb x 2 [OH-] = x = (Kb c)1/2 / log p. OH = -log[OH-] p. H = 14 - p. OH p. H = 14 – p. OH = 14 – ½ [p. Kb – log(c)]

Hydrolýza soli • Při rozpouštění soli, jejíž jeden ion pochází od silného elektrolytu (kyseliny nebo zásady) a druhý od slabého, dojde k její úplné disociaci, protože ionty silného elektrolytu mohou v roztoku existovat pouze v iontové formě • Ionty slabého elektrolytu reagují s molekulami vody, čímž vytvoří konjugovanou částici • Příklady: CH 3 COONa, KCN, NH 4 Cl, NH 4 NO 3
![Soli slabých kyselin a silných zásad CH 3 COOH KA CH 3 COOH Soli slabých kyselin a silných zásad [CH 3 COO-][H+] KA = [CH 3 COOH]](https://slidetodoc.com/presentation_image_h2/8e88e72f77e59fb8af5e4f3a2cc299a0/image-10.jpg)
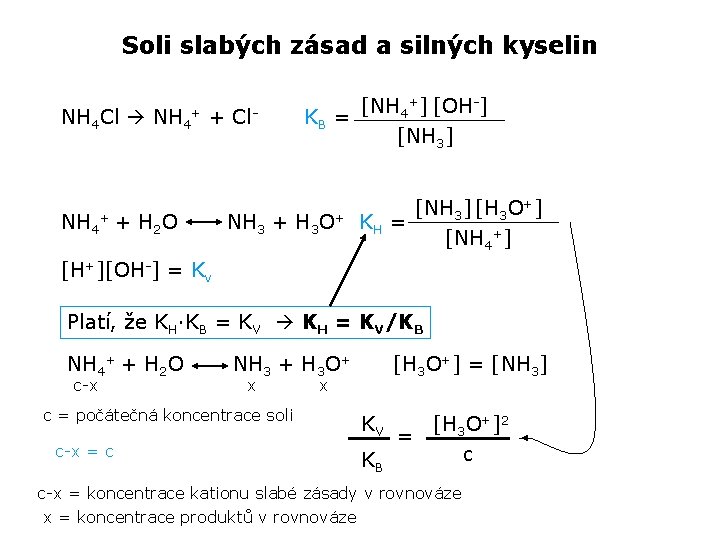
Soli slabých kyselin a silných zásad [CH 3 COO-][H+] KA = [CH 3 COOH] CH 3 COONa CH 3 COO- + Na+ CH 3 COO- + H 2 O CH 3 COOH + OH- KH = [H+][OH-] = Kv [CH 3 COOH] [OH-] [CH 3 COO-] Platí, že KH·KA = KV KH = KV/KA c-x x CH 3 COO- + H 2 O x CH 3 COOH + OH- [CH 3 COOH] = [OH-] c = počátečná koncentrace soli c-x = koncentrace anionu slabé kyseliny v rovnováze x = koncentrace produktů v rovnováze c-x = c KV = 10 -14 KA = [OH-]2 c

Z toho vyplývá obecný výraz pro výpočet p. H solí slabých kyselin a silných zásad: [OH-]2 = Kv · c (soli) KA p. OH = 7 – 1/2[p. KA – log(c)] p. H = 14 - p. OH p. H = 7 + ½ [p. KA + log(c)]

Soli slabých zásad a silných kyselin NH 4 Cl NH 4+ + + H 2 O Cl- NH 3 + [NH 4+] [OH-] KB = [NH 3] H 3 O+ [NH 3] [H 3 O+] KH = [NH 4+] [H+][OH-] = Kv Platí, že KH·KB = KV KH = KV/KB NH 4+ + H 2 O c-x NH 3 + H 3 O+ x c = počátečná koncentrace soli c-x = c [H 3 O+] = [NH 3] x KV KB [H 3 O+]2 = c c-x = koncentrace kationu slabé zásady v rovnováze x = koncentrace produktů v rovnováze

Z toho vyplývá obecný výraz pro výpočet p. H solí slabých zásad a silných kyselin: [H 3 O+]2 = Kv· c(soli) KB p. H = 7 - ½[p. KB + log(c)]

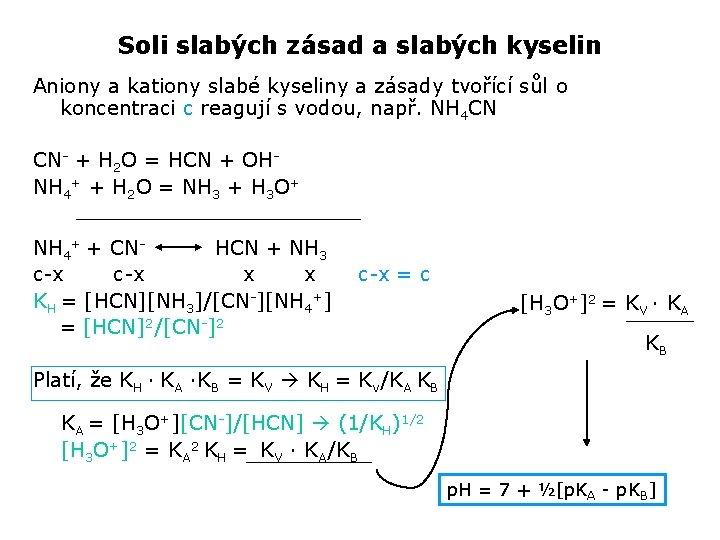
Soli slabých zásad a slabých kyselin Aniony a kationy slabé kyseliny a zásady tvořící sůl o koncentraci c reagují s vodou, např. NH 4 CN CN- + H 2 O = HCN + OHNH 4+ + H 2 O = NH 3 + H 3 O+ NH 4+ + CNHCN + NH 3 c-x x x KH = [HCN][NH 3]/[CN-][NH 4+] = [HCN]2/[CN-]2 c-x = c [H 3 O+]2 = KV · KA KB Platí, že KH · KA ·KB = KV KH = Kv/KA KB KA = [H 3 O+][CN-]/[HCN] (1/KH)1/2 [H 3 O+]2 = KA 2 KH = KV · KA/KB p. H = 7 + ½[p. KA - p. KB]

PUFRY • Pufry (tlumivé roztoky) = konjugovaný pár kyseliny nebo zásady, který je schopný udržovat v jistém rozmezí stabilní p. H po přidání silné kyseliny či zásady do systému • Pufry jsou obvykle směsi slabých kyselin a jejich solí se silnými zásadami, nebo směsi slabých zásad a jejich solí se silnými kyselinami • Důležitost pufračních systémů v organismu (krev, mezibuněčný prostor, buňky)

Výpočty p. H roztoků pufrů Pufr sestavající se ze slabé kyseliny a její soli se silnou zásadou HA + H 2 O A- + H 3 O+ Ka Henderson – Hasselbalchova rovnice p. H = p. Ka + log[A-]/[HA] HA – slabá kyselina A- – konjugovaná zásada Pufr sestavající se ze slabé zásady a její soli se silnou kyselinou B + H 2 O BH+ + OH- p. OH = p. Kb + log[BH+]/[B] B – slabá zásada BH+ - konjugovaná kyselina

Výpočty p. H 1. 2. 3. 4. 5. 6. 7. 8. Vypočítejte p. H 1 m. M KOH! Vypočítejte p. H 0. 01 M kyseliny mravenčí (HCOOH) při 25°C, p. Ka = 3. 8! Vypočítejte p. H 0. 001 M NH 3 při 25°C, p. Kb = 4. 8! Vypočítejte p. H 0. 1 M Na. CN při 25°C, p. Ka = 9. 21! Vypočítejte p. H 0. 7 M NH 4 Cl při 25°C, p. Kb = 4. 8! Vypočítejte p. H 5 m. M laktátu ammoného CH 3 CH(OH)COONH 4 při 25°C, p. Ka = 3. 86, p. Kb = 4. 8! Vypočítejte p. H pufru, který obsahuje 0. 1 M CH 3 COONa a 0. 1 M CH 3 COOH, p. Ka = 4. 8! Vypočítejte p. H pufru, který obsahuje 0. 1 M NH 4 Cl a 1 M NH 3, p. Kb = 4. 8!
![1 cKOH 0 001 M K OH KOH K OHp 1. c(KOH) = 0, 001 M = [K+] = [OH-] KOH K+ + OHp.](https://slidetodoc.com/presentation_image_h2/8e88e72f77e59fb8af5e4f3a2cc299a0/image-18.jpg)
1. c(KOH) = 0, 001 M = [K+] = [OH-] KOH K+ + OHp. OH = -log [OH-] = 3 p. H = 14 – p. OH = 11

2. c(HCOOH) = 0. 01 M, p. Ka = 3. 8 HCOOH ↔ HCOO- + H+ 0. 01 -x=c x x x = konc. produktů při rovnováze ↓ konc. HCOOH při rovnováze Ka =[HCOO-][H+]/[HCOOH] = x 2/c = [H+]2/0. 01 [H+] = (Ka· 0. 01)1/2 p. H = -log[H+] = ½ [3. 8 – log(0. 01)] = 2. 9

3. c(NH 3) = 0. 001 M, p. Kb = 4. 8 NH 3 H 2 O NH 4+ + OH- 0. 001 -x x = konc. produktů při rovnováze ↓ konc. NH 3 při rovnováze 0. 001 -x = c Kb=[NH 4+][OH-]/[NH 3] = x 2/c = [OH-]2/0. 001 [OH-] = (Kb· 0. 001)1/2 p. OH = -log[OH-] = ½ [p. Kb - log(0. 001)] p. H = 14 - ½ [4. 8 - log(0. 001)] = 14 – 3. 9 = 10. 1

4. c(Na. CN) = 0. 1 M, p. Ka = 9. 21 Na. CN Na+ + CNHCN H+ + CNKa=[H+][CN-]/[HCN] CN- + H 2 O HCN + OH- KH = [OH-][HCN]/[CN-] c-x = c x x [HCN] = [OH-] Kv = Ka KH Kv/ Ka = [OH-]2/c [OH-] = (Kvc/ Ka)1/2 p. OH = ½(p. Kv – p. Ka + log c) p. H = 14 - ½(p. Kv – p. Ka + log c) = p. H = 7 + ½ [p. KA + log(c)] = 7 + ½ (9. 21 + log 0. 1) = 11. 1

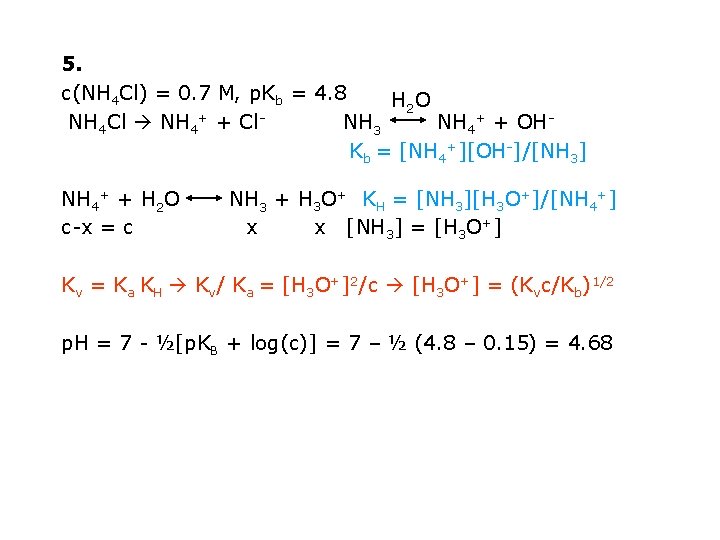
5. c(NH 4 Cl) = 0. 7 M, p. Kb = 4. 8 H 2 O NH 4 Cl NH 4+ + Cl. NH 3 NH 4+ + OHKb = [NH 4+][OH-]/[NH 3] NH 4+ + H 2 O c-x = c NH 3 + H 3 O+ KH = [NH 3][H 3 O+]/[NH 4+] x x [NH 3] = [H 3 O+] Kv = Ka KH Kv/ Ka = [H 3 O+]2/c [H 3 O+] = (Kvc/Kb)1/2 p. H = 7 - ½[p. KB + log(c)] = 7 – ½ (4. 8 – 0. 15) = 4. 68

6. c(CH 3 CH(OH)COONH 4) = 0. 005 M, p. Ka = 3. 86, p. Kb = 4. 8 CH 3 CH(OH)COO- + H 2 O NH 4+ + H 2 O CH 3 CH(OH)COOH + OH- NH 3 + H 3 O+ CH 3 CH(OH)COO- + NH 4+ CH 3 CH(OH)COOH + NH 3 c-x x x KH = [CH 3 CH(OH)COOH][NH 3]/[CH 3 CH(OH)COO-][NH 4+] = [CH 3 CH(OH)COOH]2/[CH 3 CH(OH)COO-]2 Kv = KH KA KB KH = Kv/KA KB (1/KH)1/2 KA = [H 3 O+][CH 3 CH(OH)COO-]/[CH 3 CH(OH)COOH] [H 3 O+]2 = KA 2 KH = KV · KA/KB p. H = 7 + ½[p. KA - p. KB]= 7 + ½ [3. 86 – 4. 8] = 6. 53

7. 0. 1 M CH 3 COONa, 0. 1 M CH 3 COOH, p. Ka = 4. 8 CH 3 COOH + H 2 O CH 3 COO- + H 3 O+ Ka p. H = p. Ka + log [CH 3 COO-]/[CH 3 COOH] = 4. 8 + 0 = 4. 8

8. 0. 1 M NH 4 Cl a 1 M NH 3, p. Kb = 4. 8 NH 3 + H 2 O NH 4+ + OH- Kb p. OH = p. Kb + log [NH 4 Cl]/[NH 3] = 4. 8 – 1 = 3. 8 p. H = 14 – p. OH = 10. 2
 Hydrolyza
Hydrolyza Vpoty
Vpoty Vpoty
Vpoty Deriváty karboxylových kyselin test
Deriváty karboxylových kyselin test Nazvoslovie soli kyselin
Nazvoslovie soli kyselin Kyslikate kyseliny
Kyslikate kyseliny Nitrily karboxylových kyselin
Nitrily karboxylových kyselin Metylester kyseliny mravčej
Metylester kyseliny mravčej Kyselinotvorny prvok
Kyselinotvorny prvok Acyl halogenidy
Acyl halogenidy Sytnost kyselin
Sytnost kyselin Vyznamne soli kyslikatych kyselin
Vyznamne soli kyslikatych kyselin Zsad
Zsad Zsad
Zsad Zsad
Zsad Zsad
Zsad Sou libechov
Sou libechov Zsad
Zsad Joko nurkamto
Joko nurkamto Joko tri saputro
Joko tri saputro Suhanan
Suhanan Cengkorongan sadurunge nulis karangan
Cengkorongan sadurunge nulis karangan Joko purwanto uny
Joko purwanto uny Joko email
Joko email Perjamuan khong guan
Perjamuan khong guan Joko email
Joko email