Tema 54 Farmacovigilancia Sistema Espaol de Farmacovigilancia y






















- Slides: 30

Tema 54. Farmacovigilancia: Sistema Español de Farmacovigilancia y Centro Andaluz de Farmacovigilancia. Organigrama, funciones y programas específicos. Análisis comparativos 20 DE MAYO DE 2008 Colegio Oficial de Farmacéuticos de Sevilla

JUSTIFICACIÓN. ¿PORQUÉ ES NECESARIA LA FARMACOVIGILANCIA? 4 Limitado conocimientos de los nuevos medicamentos al comercializarse 4 Pequeño número de pacientes incluidos en los EC (limitaciones en la detección de RA infrecuentes) 4“selección de pacientes”: no niños, no ancianos, no embarazadas. . (dificultad en identificar subgrupos de riesgo) 4 Duración limitada (limitación en la detección de RA periodo latencia prolongado) 4 Exclusión de tratamientos concomitantes (difícil detectar interacciones) 4 Condiciones idóneas de uso (no se detectan problemas de mal uso o abuso) ¡¡¡ esto no refleja la práctica médica diaria!!!

FARMACOVIGILANCIA DEFINICIÓN Actividad de salud pública que tiene por objetivo la identificación, cuantificación, evaluación y prevención de los riesgos asociados al uso de los medicamentos una vez comercializados. Real Decreto 1344/2007

Fuentes de información en FV • Notificación espontánea de casos individuales de sospechas de reacciones adversas por parte de profesionales sanitarios. • Estudios postautorización. • Bases de datos sanitarias informatizadas. • Información preclínica de experimentación animal y EC. • Informaciones relacionadas con la fabricación, conservación, venta, distribución, dispensación, prescripción y utilización de los medicamentos. • Publicaciones científicas. • Otras fuentes de información: uso incorrecto y abuso de los medicamentos, o las correspondientes a errores de medicación, que puedan aportar datos relevantes para la evaluación de los B/R de los medicamentos. • Otras autoridades sanitarias y organismos sanitarios internacionales.

ORGANIZACIÓN DE LA FARMACOVIGILANCIA EN ESPAÑA Sistema Español de Farmacovigilancia Estructura descentralizada, coordinada por la Agencia Española de Medicamentos y Productos Sanitarios, que integra las actividades que las Administraciones sanitarias realizan de manera permanente y continuada para recoger, elaborar y, en su caso, procesar la información útil para la supervisión de medicamentos y, en particular, la información sobre reacciones adversas a los medicamentos, así como para la realización de cuantos estudios se consideren necesarios para evaluar la seguridad de los medicamentos. Real Decreto 1344/2007

SISTEMA ESPAÑOL DE FARMACOVIGILANCIA Organización • Centros de Farmacovigilancia en CCAA: 17 operativos • Centro coordinador: División de Farmacoepidemiología y Farmacovigilancia (adscrita a la Subdirección General de Medicamentos de Uso humano de la AEMPS) • Comité técnico del SEFV • Comité de Seguridad de Medicamentos uso Humano (CSMH) de la AEMPS

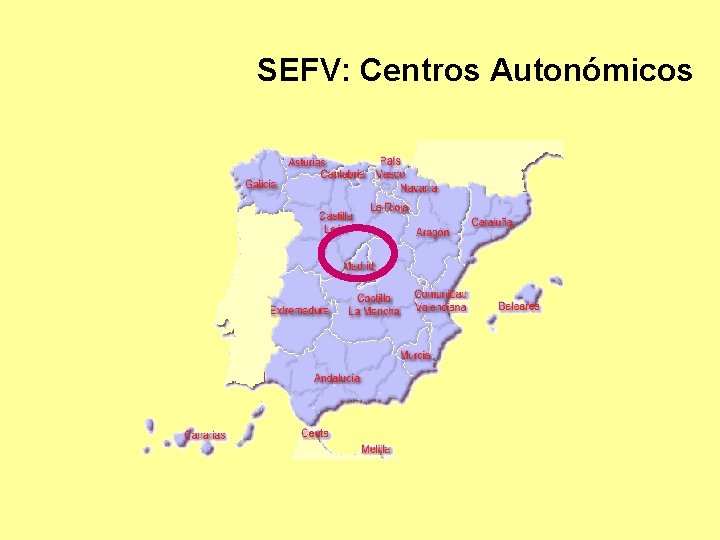
SEFV: Centros Autonómicos

FARMACOVIGILANCIA EN EUROPA • • Estados miembros tienen sistemas nacionales de FV similares al SEFV, . . EMEA, Agencia Europea de Medicamentos (www. emea. europa. eu ) – CHMP (antes CPMP), Committee Human Medicinal Products: evaluación de problemas de seguridad y armonización de medidas reguladoras • grupos de trabajo: FV, eficacia, seguridad, calidad, biotecnología, plantas medicinales, . . . – Eudra. Vigilance – Directivas, Guías, PNT/SOP, arbitrajes, conclusiones, recomendaciones

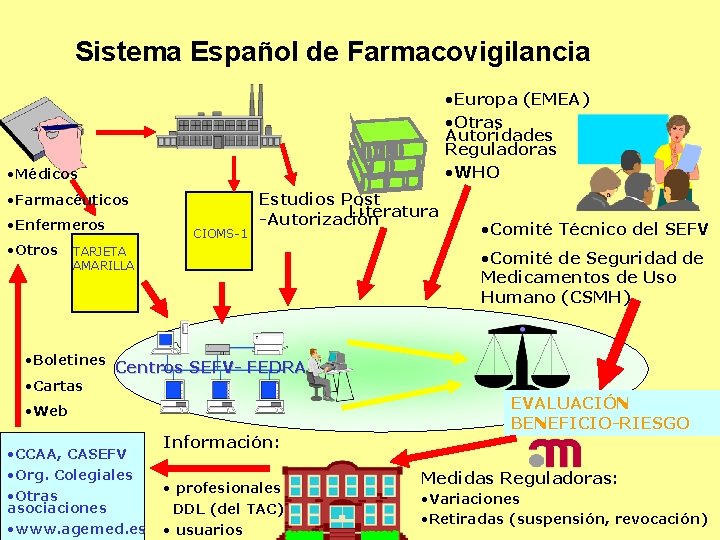
Sistema Español de Farmacovigilancia • Europa (EMEA) • Otras Autoridades Reguladoras • WHO • Médicos • Farmacéuticos • Enfermeros • Otros CIOMS-1 Estudios Post Literatura -Autorización TARJETA AMARILLA • Boletines • Cartas • Comité Técnico del SEFV • Comité de Seguridad de Medicamentos de Uso Humano (CSMH) Centros SEFV- FEDRA • Web • CCAA, CASEFV • Org. Colegiales • Otras asociaciones • www. agemed. es Información: • profesionales DDL (del TAC) • usuarios EVALUACIÓN BENEFICIO-RIESGO Medidas Reguladoras: • Variaciones • Retiradas (suspensión, revocación)

CENTRO ANDALUZ DE FARMACOVIGILANCIA • Orden de 1 de Marzo de 2000, por la que se regulan los órganos encargados de la Farmacovigilancia en la Comunidad Autónoma de Andalucía. • Empieza a funcionar en 1990 • Adscrito funcionalmente a la DG de Salud Pública y Participación. • Ubicado en el HU Virgen del Rocío

CENTRO ANDALUZ DE FARMACOVIGILANCIA FUNCIONES (Orden 1/3/2000) 4 Desarrollar el programa NERA y resto de actuaciones del SEFV en nuestra CCAA 4 Editar y distribuir los formularios (TA) a los profesionales sanitarios 4 Recibir recoger, evaluar y registrar FEDRA. 4 Consultas terapéuticas relacionadas con notificaciones de reacciones adversas 4 Edición de boletín informativo (Alerta de Farmacovigilancia) 4 Cursos, charlas y sesiones 4 Recibir y gestionar el registro de las sospechas de RAMs producidas durante la realización de los EC realizados en nuestra CCAA. 4 Recibir y gestionar el registro de incidentes adversos relacionados con productos sanitarios en nuestra CCAA. 4 Centro consultivo y asesor en materia de estudios en fase IV, excluidos los ensayos clínicos, realizados en el ámbito de nuestra CCAA. 4 Asesorar a la Administración sanitaria en materia de reacciones adversas a medicamentos, o sobre otros aspectos relacionados con el uso racional de los mismos

SISTEMA ESPAÑOL DE FARMACOVIGILANCIA Agentes que lo integran • Agencia Española del Medicamento • Órganos competentes en materia de FV de las Comunidades Autónomas • Profesionales sanitarios

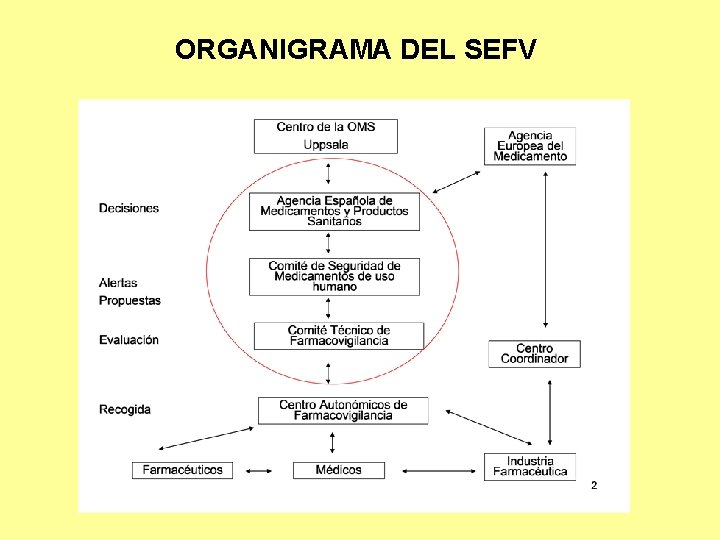
ORGANIGRAMA DEL SEFV

SISTEMA ESPAÑOL DE FARMACOVIGILANCIA Funciones AEMPS (I) a) Coordinar y evaluar el SEFV Supervisará la permanencia y continuidad del programa de notificación espontánea en las respectivas CC. AA. y presentará un informe anual de actividades del SEFV al CSMH b) Red de proceso de datos c) Control de calidad. Acceso público a los datos d) Actuar como centro de referencia para los TAC y los organismos internacionales e) Poner a disposición del titular de la autorización las RA f) Transmitir a la EMEA y demás Estados miembro de la UE g) Promover la creación de bases de datos sanitarias informatizadas en colaboración con las CC. AA. y los profesionales sanitarios h) Promover y realizar estudios farmacoepidemiológicos para evaluar la seguridad de los medicamentos autorizados

SISTEMA ESPAÑOL DE FARMACOVIGILANCIA Funciones AEMPS(II) i) Evaluar la información recibida del SEFV y otras fuentes de información (IPS, PGR, EPA) j) Establecer las medidas oportunas tendentes a la gestión de los riesgos identificados k) Garantizar el acceso público a la información remitida por los TAC o por cualquier otra entidad o persona que se considere especialmente relevante para la protección de la salud pública l) Procedimiento de inspección (junto con las CC. AA. ) m) Cualquier otra función que pueda resultar necesaria

SEFV: Participación de las CC. AA. • Las CC. AA. cooperarán con la AEMPS para la implantación y desarrollo de programas y estudios sobre la evaluación y gestión de riesgos de los medicamentos, de conformidad con los acuerdos adoptados por el CSMH y por el CTSEFV. • Las CC. AA. y la AEMPS cooperarán para la difusión del conocimiento sobre la seguridad de los medicamentos en su ámbito asistencial

OBLIGACIONES DE LOS PROFESIONALES SANITARIOS • Se dará prioridad a la notificación de las reacciones adversas graves o inesperadas de cualquier medicamento y la relacionadas con los medicamentos nuevos identificados con el triángulo amarillo • Sospechas de RA por error de medicación – Procedimientos especiales de notificación que definirá el CTSEFV • Colaborar con los planes de gestión de riesgos, en particular de los medicamentos calificados como de especial control médico • Colaborar con los responsables de fv de los TAC • Colaborar, en calidad de expertos, con la AEMPS y los órganos competentes de las CC. AA.

SISTEMA ESPAÑOL DE FARMACOVIGILANCIA • Programa básico es la notificación espontánea de reacciones adversas por parte de los profesionales sanitarios • También integra información procedente de otros ámbitos como: – – Notificaciones procedentes de la industria farmacéutica De estudios postautorización Comunicaciones de casos a revistas médicas Programas especiales

Programa de Notificación Espontánea Método de Farmacovigilancia , basado en la COMUNICACIÓN, RECOGIDA y EVALUACIÓN de notificaciones de SOSPECHAS de reacciones adversas a medicamentos. Real Decreto 1344/2007

Programa de Notificación Espontánea OBJETIVOS 4 IDENTIFICACIÓN PRECOZ DE NUEVOS RIESGOS ASOCIADOS A MEDICAMENTOS (MÉTODO MÁS EFICIENTE) 4 Identificación de factores predisponentes 4 Comparar fármacos de un mismo grupo terapéutico 4 Monitorización continua de la seguridad de todos los fármacos comercializados NO es un programa para controlar cómo se utilizan los medicamentos ni para valorar los hábitos de prescripción ni el coste

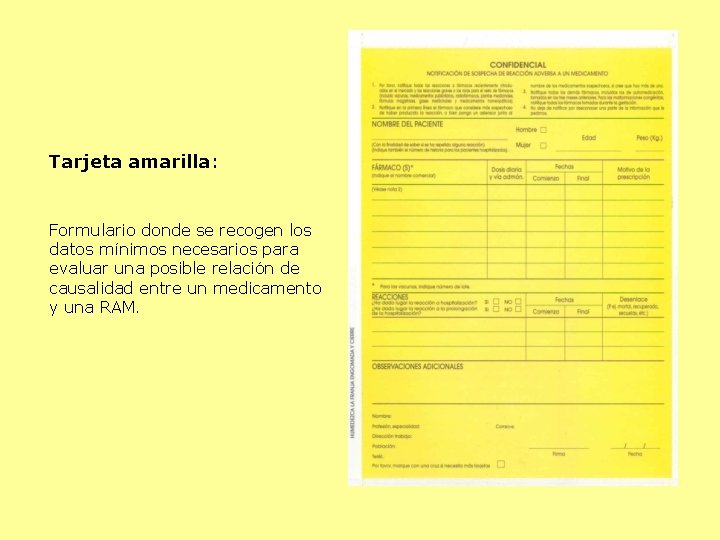
Tarjeta amarilla: Formulario donde se recogen los datos mínimos necesarios para evaluar una posible relación de causalidad entre un medicamento y una RAM.

REACCIÓN ADVERSA (RAM) DEFINICIÓN “Cualquier respuesta a un medicamento que sea nociva y no intencionada, y que tenga lugar a dosis que se apliquen normalmente en el ser humano para la profilaxis, el diagnóstico o el tratamiento de enfermedades, o para la restauración, corrección o modificación de funciones fisiológicas. Este término incluye también todas las consecuencias clínicas perjudiciales derivadas de la dependencia, abuso y uso incorrecto de medicamentos, incluyendo las causadas por el uso fuera de las condiciones autorizadas y las causadas por errores de medicación”. RD 1344/2007

ERROR DE MEDICACIÓN DEFINICIÓN “Fallo por acción u omisión en el proceso de tratamiento con medicamentos que ocasiona o puede ocasionar un daño en el paciente. Los errores de medicación que ocasionen un daño en el paciente serán considerados a efectos de su notificación como reacciones adversas, excepto aquellos derivados del fallo terapéutico por omisión de un tratamiento”. RD 1344/2007

REACCIÓN ADVERSA GRAVE “Cualquier reacción adversa” que: 4 Ocasione la muerte, o pueda poner en peligro la vida 4 Exija hospitalización del paciente o prolongación de la ya existente 4 Ocasione una discapacidad o invalidez significativa o persistente 4 Constituya una anomalía congénita o defecto de nacimiento 4 Todas las sospechas de transmisión de un agente infeccioso a través de un medicamento A efectos de su notificación se tratará también como RAM graves aquellas sospechas que se consideren importantes desde el punto de vista médico, aunque no cumplan los criterios anteriores

REACCIÓN ADVERSA INESPERADA “Cualquier reacción adversa cuya naturaleza, gravedad o consecuencias no sean coherentes con la información descrita en la ficha técnica”

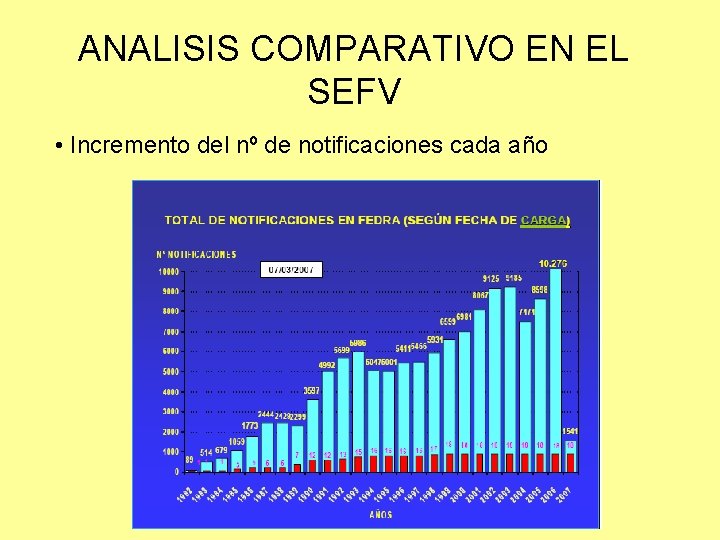
ANALISIS COMPARATIVO EN EL SEFV • Incremento del nº de notificaciones cada año

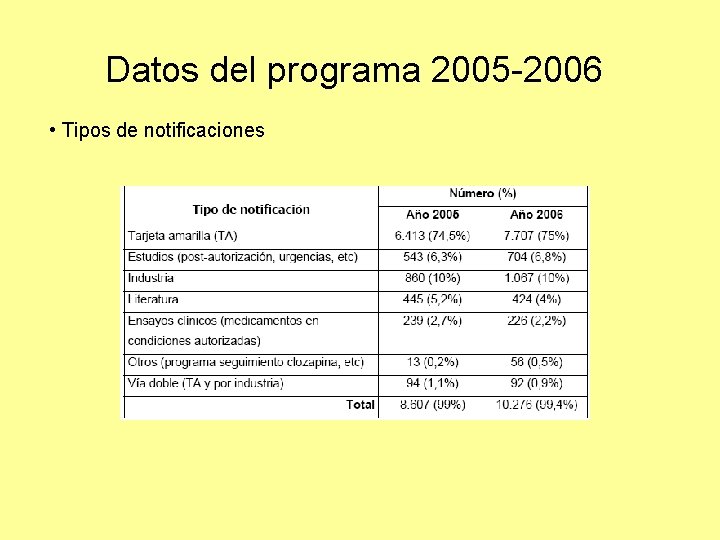
Datos del programa 2005 -2006 • Tipos de notificaciones

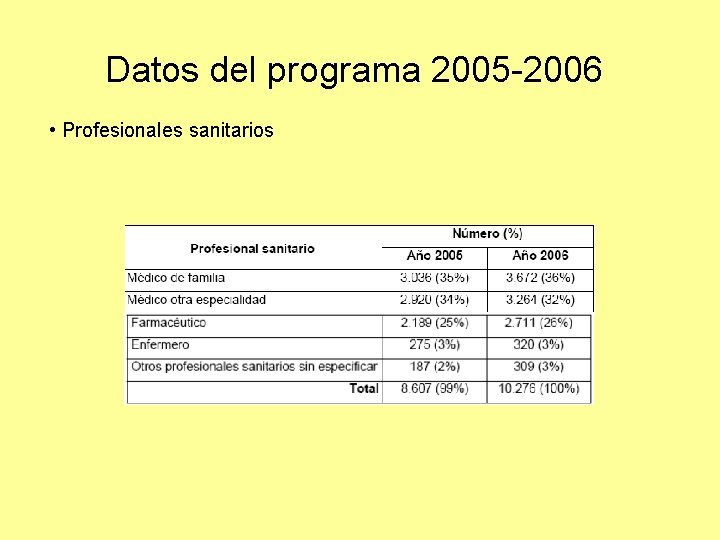
Datos del programa 2005 -2006 • Profesionales sanitarios

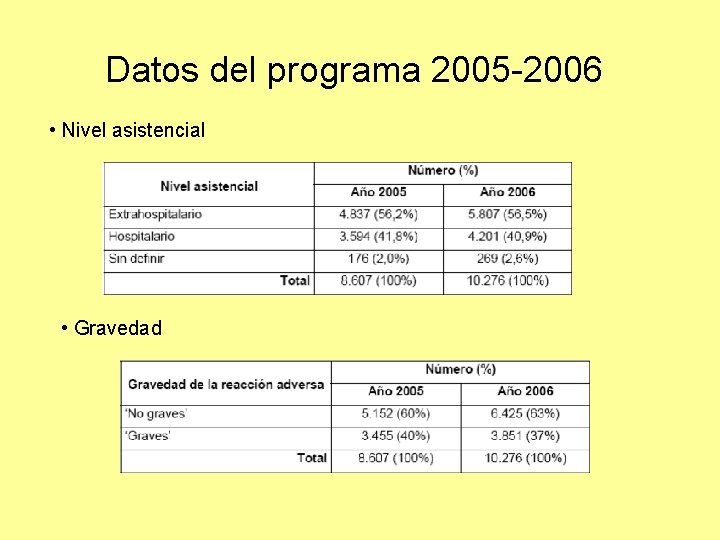
Datos del programa 2005 -2006 • Nivel asistencial • Gravedad

GRACIAS Mercedes Ruiz mercedes. ruiz. exts@juntadesandalucia. es
 Indicadores de farmacovigilancia
Indicadores de farmacovigilancia Medicamentos lasa
Medicamentos lasa Indicadores de farmacovigilancia
Indicadores de farmacovigilancia Cumaps
Cumaps Espaol
Espaol Miguel hidalgo preguntas
Miguel hidalgo preguntas Abecedario
Abecedario El espaol
El espaol Espaol
Espaol Preguntas para la ciudadana en espaol
Preguntas para la ciudadana en espaol Penas graves
Penas graves Preparatic
Preparatic En espaol
En espaol El espaol
El espaol Puntos cardinales españa
Puntos cardinales españa Examen de ciudadana 2020 en espaol
Examen de ciudadana 2020 en espaol Idioma espaol
Idioma espaol Preguntas de ciudadania en espaol
Preguntas de ciudadania en espaol Complete spanish alphabet
Complete spanish alphabet Español meridional
Español meridional Vowel + y
Vowel + y Trabajos en espaol birmingham
Trabajos en espaol birmingham Vamos a aprender español
Vamos a aprender español Espaol
Espaol Citizenship test en espaol
Citizenship test en espaol Abecedario espaol
Abecedario espaol El tema y sub tema
El tema y sub tema Ejemplo de delimitacion de una investigacion
Ejemplo de delimitacion de una investigacion Tipos de entrevistas en investigacion
Tipos de entrevistas en investigacion Vladimir tattin
Vladimir tattin Tema-tema teologi perjanjian lama
Tema-tema teologi perjanjian lama