Mtodos en farmacovigilancia Mtodos de deteccin de reacciones




































- Slides: 44

Métodos en farmacovigilancia

Métodos de detección de reacciones adversas n Sistemas notificación espontánea n n n Sistemas de vigilancia intensiva n n n Tarjeta amarilla Revistas científicas Fármaco (EPAs) Grupo de pacientes Estudios epidemiológicos n n Caso – control Cohorte Uso de bases de datos en FV Prescripción event monitoring

n Explotación de datos informatizados n n Monitorización fármacos alertantes Monitorización diagnósticos alertantes Monitorización de alergias Monitorización de parámetros de laboratorio

Sistemas de notificación espontánea

Sistema notificación espontánea n Método de farmacovigilancia basado en la comunicación, recogida y evaluación de notificaciones de sospechas de reacciones adversas a medicamentos, realizadas por un profesional sanitario, incluyendo las derivadas de la dependencia a fármacos, abuso y mal uso de medicamentos. REAL DECRETO 711/2002, de 19 de julio, por el que se regula la farmacovigilancia de medicamentos de uso humano.

Notificación de RAM n n n Debe contener una información mínima para ser considerada válida: un notificador identificable (nombre, dirección y profesión) un paciente identificable (nombre y/o iniciales y/o edad y/o n º historia clínica y//o sexo y/o fecha de nacimiento) uno o varios fármacos identificados, una o varias reacciones adversas. Además es importante conocer la fecha de inicio de la reacción adversa.


RAM que deben notificarse para los medicamentos de reciente comercialización n n Todas las sospechas de RAM, independientemente de la gravedad. Medicamento de reciente comercialización : se acepta un período de 3‑ 5 años pero es variable en función de la frecuencia de uso de ese medicamento

RAM que deben notificarse para todos los medicamentos (I) n n n RAM mortales, graves e irreversibles, aunque ya sean conocidas Malformaciones congénitas en las que se sospeche un medicamento. Sospechas de reacciones que provoquen: n n ingreso hospitalario, alargamiento de las estancia hospitalaria, modificación del estado físico, baja laboral o escolar.

RAM que deben notificarse para todos los medicamentos (II) n Sospechas de RAM en fisiológicas particulares como: n n n situaciones hepatopatía, nefropatía, diabetes, edades extremas (niños o ancianos) o embarazo, Ya que los efectos de los medicamentos en estas situaciones solo es posible conocerlos después de la comercialización.

RAM que deben notificarse para todos los medicamentos (III) n n Los efectos que aparezcan con el uso simultáneo de varios medicamentos porque pueden deberse a interacciones aunque se conozca bien el perfil para cada fármaco. La aparición durante el tratamiento de síntomas o signos en el paciente no descritos en la información del medicamento o poco habituales, aunque las manifestaciones clínicas sean banales.

El fenómeno iceberg RAM notificadas RAM sospechadas no notificadas RAM no sospechadas

Ventajas de notificación espontánea n n n Sistema sencillo y barato. No interfiere con los hábitos de prescripción. Comienza desde el momento en que se comercializa un medicamento y es permanente. Genera "señales de alerta" a partir de las cuales pueden realizarse estudios más profundos. Detecta reacciones adversas de baja frecuencia que no han sido observadas en ensayos clínicos. Permite obtener datos de todos los ámbitos en los que se emplean los medicamentos, ya que abarca a todos los pacientes, médicos y medicamentos

Desventajas de la notificación espontánea n n n No permite verificar hipótesis. Depende de forma importante de la voluntad de notificar del médico. Tienden a notificarse reacciones adversas ya conocidas o previamente descritas. Los notificadores no tienen un hábito terapéutico representativo, ya que su propia participación indica una preocupación especial por los medicamentos. No permite obtener índices de incidencia exactos, aunque pueden obtenerse datos aproximados a partir de las cifras de consumo de medicamentos. No detecta reacciones adversas que aparecen a largo plazo (carcinogénesis, mutagénesis).

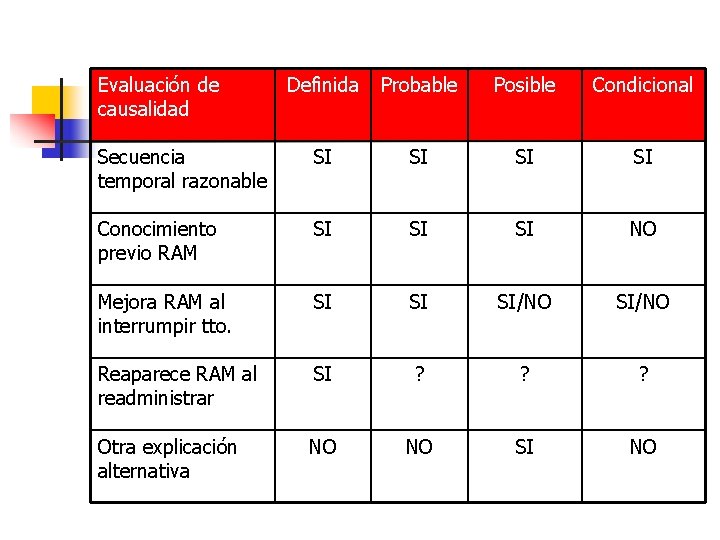
Evaluación de la causalidad n n Algoritmo de Naranjo Algoritmo Karch – Lasagna n n n Secuencia temporal Conocimiento previo Efecto retirada fármaco Efecto reexposición Existencia causa alternativa

Algoritmo Karch - Lasagna n n n Que la manifestación patológica siga una secuencia temporal razonable después de la administración del fármaco La existencia o no de conocimientos previos en cuanto a la reacción adversa o a su mecanismo farmacológico Que mejore cuando se suspende la administración del fármaco Que se reproduzca si se administra el medicamento de nuevo Que no se pueda explicar la manifestación patológica por el curso de la enfermedad o por otros medicamentos.

Evaluación de causalidad Definida Probable Posible Condicional Secuencia temporal razonable SI SI Conocimiento previo RAM SI SI SI NO Mejora RAM al interrumpir tto. SI SI SI/NO Reaparece RAM al readministrar SI ? ? ? Otra explicación alternativa NO NO SI NO

Estudios post – autorización n Es cualquier estudio realizado con medicamentos según las condiciones de su Ficha Técnica autorizada o bien en condiciones normales de uso. REAL DECRETO 711/2002, de 19 de julio, por el que se regula la farmacovigilancia de medicamentos de uso humano.

Estudio de seguridad post - autorización n Estudio farmacoepidemiológico o ensayo clínico efectuado de conformidad con las disposiciones de la autorización de comercialización y realizado con el propósito de identificar o cuantificar los riesgos asociados a los medicamentos autorizados.

Objetivos estudios post - autorización n n Efectividad Efectos adversos no conocidos Patrones de utilización Estudios farmacoeconómicos Efecto de la intervención sobre calidad de vida

Circular 4/2000 de la AEM n n n Discusión protocolo con las autoridades Presentación del protocolo en la AEM Comunicación inicio estudio y evaluación semestral Cumplir requisitos notificación RAM Recomendación de someter el protocolo al CEIC

Monitorización de señales alertantes Diagnósticos alertantes Prescripciones alertantes Fármacos alertantes Parámetros laboratorio alertantes

Diagnósticos alertantes n DIGESTIVOS n n n Diarrea Estreñimiento Nauseas, vómitos Epigastralgia Dolor abdominal Hematemesis Melenas Rectorragia Hemorragia digestiva Ictericia Hepatitis Pancreatitis n n n Mialgia Miopatia Calambres n NEUROLOGICOS n n n n n Ataxia Confusión Convulsiones Discinesia Transtorno estrapiramidal cefalea temblor Sindrome neuroléptico maligno Insomnio Nerviosismo Hemorragia intracraneal

Prescripciones alertantes n n n n Vigilancia de signos o síntomas Suspensión brusca de un medicamento “No administrar tal fármaco” Cambios de dosis Cambio de un medicamento a otro Prescripción de un fármaco alertante Monitorización n n Analítica: iones, glucosa, etc. Farmacológica: Niveles de fármacos

Fármacos alertantes n n n n n Corticoides IV o tópicos. Adrenalina Antihistamínicos Resinas de intercambio iónico Protamina Loperamida Vitamina K Glucosa 50% Flumazenilo n n n n Dantroleno Diazepan IV Fenitoina IV Naloxona Acetilcisteina antídoto Carbón activado Anticuerpos antidigitálicos Hidroxicina

Parámetros laboratorio alertantes n n n n Eosinófilos > 9% Fosfatasa alcalina > 350 ui/ml AST o ALT > 80 ui/ml INR>5 Test para Clostridium difficile Potasio >6 mmol/l Crs> 2, 5 mg/dl

Ejemplo 1 Hemorragia por anticoagulantes n n n n Suspender Sintrom o heparina Vigilar melenas o hematuria Administración vitamina k Administración de protamina Administración plasma fresco Control tiempo protrombina, INR Control tiempo parcial tromboplastina

Ejemplo 2 Hiperpotasemia por fármacos n n n Suspender el potasio Realizar analítica Recuento de potasio Administrar resinas de intercambio iónico No administrar diruréticos ahorradores de potásio

Estudios epidemiológicos

Estudios de cohortes prospectivo Exposición Investigador Enfermedad ? ? Tiempo Presente Ausente ? A determinar Investigador al comienzo del estudio

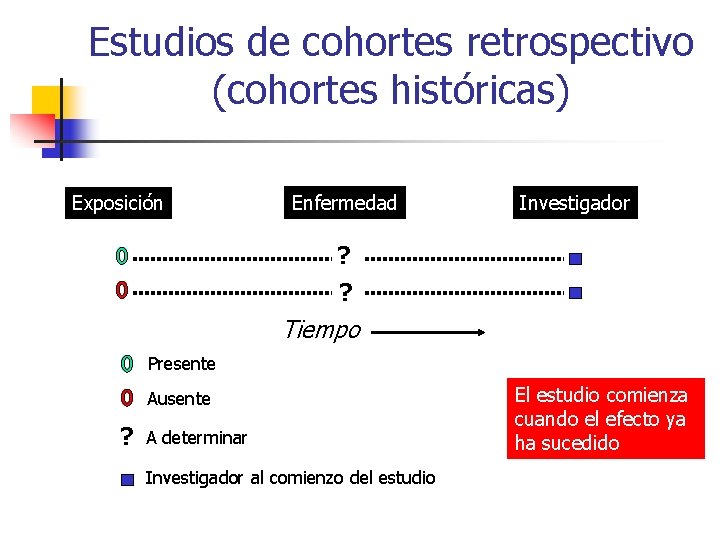
Estudios de cohortes retrospectivo (cohortes históricas) Exposición Enfermedad Investigador ? ? Tiempo Presente Ausente ? A determinar Investigador al comienzo del estudio El estudio comienza cuando el efecto ya ha sucedido

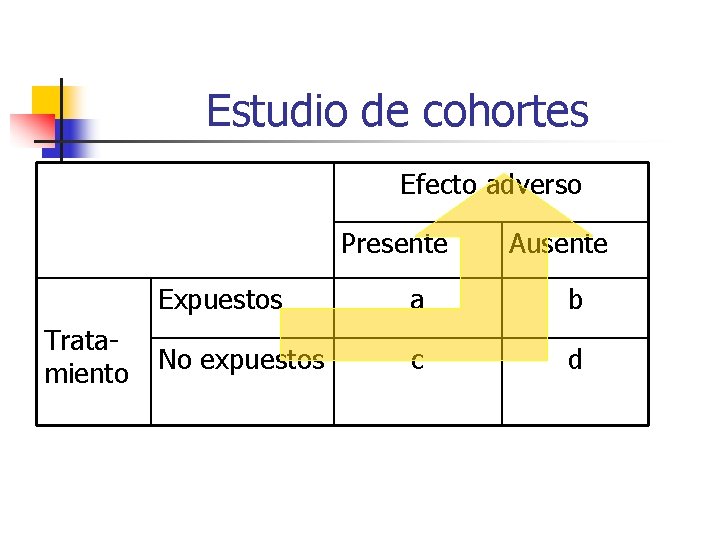
Estudio de cohortes Efecto adverso Presente Tratamiento Ausente Expuestos a b No expuestos c d

Inconvenientes cohortes n n Trabajo campo costoso Poco eficiente para RAM infrecuentes No buenos para RAM tras largos períodos de exposición Pérdidas de pacientes en el seguimiento

Ventajas estudios cohortes n n Permiten estudiar más de una RAM Permiten estimar medidas n n n Asociación (Riesgo relativo) Frecuencia (Riesgo absoluto) Riesgo atribuible

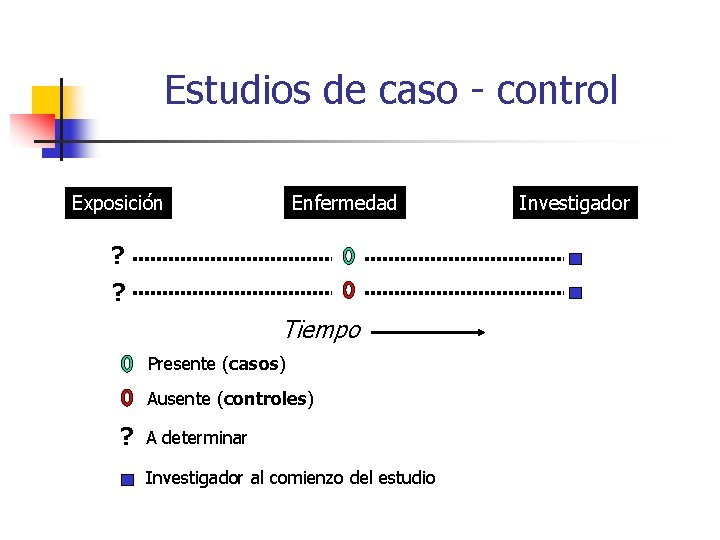
Estudios de caso - control Enfermedad Exposición ? ? Tiempo Presente (casos) Ausente (controles) ? A determinar Investigador al comienzo del estudio Investigador

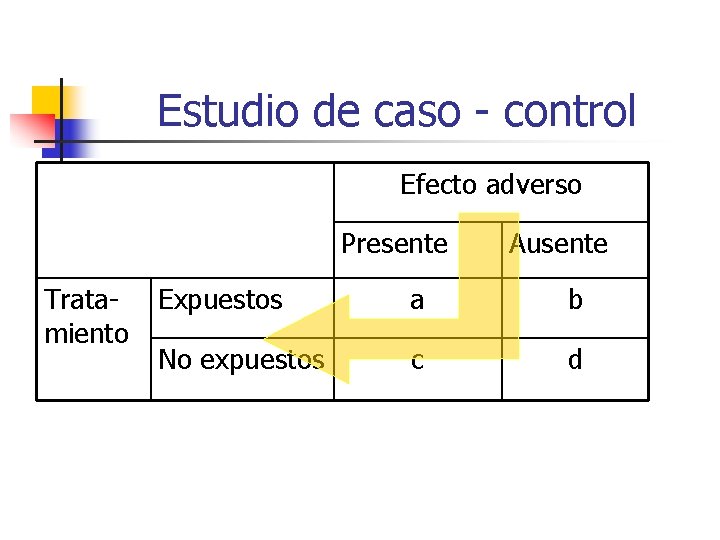
Estudio de caso - control Efecto adverso Presente Tratamiento Ausente Expuestos a b No expuestos c d

Ventajas estudios caso-control n n Útil para RAM poco frecuentes o con latencias prolongadas Realización relativamente económica Precisa comparativamente pocos pacientes Permite estudiar varios fármacos como causas de la RAM

Desventajas de estudios caso-control n n Sujeto a más sesgos que los cohortes Basados en memorización para registrar la exposición. Validación difícil de la información No es posible determinar la incidencia de la RAM

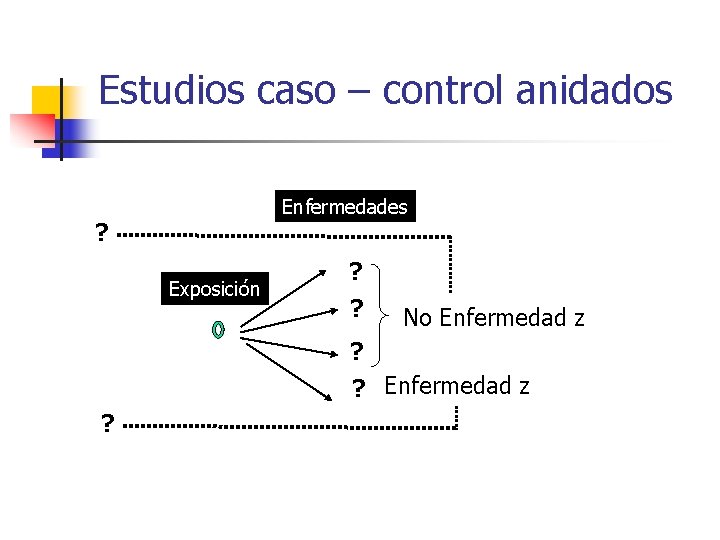
Estudios caso – control anidados Enfermedades ? Exposición ? ? No Enfermedad z ? ? Enfermedad z ?

Uso de bases de datos sanitarias informatizadas n Recogen de forma sistemática información individualizada sobre el uso de recursos sanitarios de grandes grupos de población como n n Prescripción de medicamentos Visitas ambulatorias Ingresos médicos con diagnósticos de alta Permiten identificación cohortes expuestos o no, casos y controles

School of Medicine Boston Collaborative Drug Surveillance Program 11 Muzzey Street Lexington, Massachusetts USA 02421 phone 781 862 -6660 fax 781 862 -1680 http: //www. bu. edu/bcdsp

General Practice Research Database (GPRD)* n n n Archivo de HC población atendida por MAP en GB Gestionada por Medicines Control Agency (similar a la AEM) 1500 médicos generalistas 400 equipos de AP Población 3 millones personas * Antiguamente conocida como VAMP research

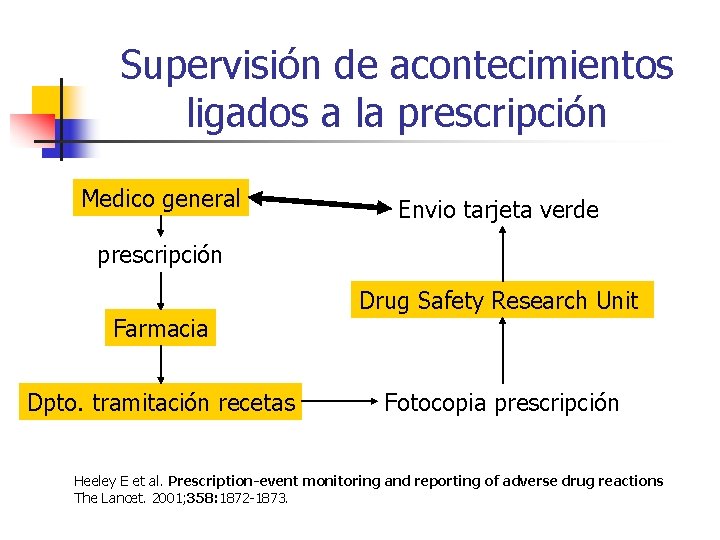
Supervisión de acontecimientos ligados a la prescripción Medico general Envio tarjeta verde prescripción Farmacia Dpto. tramitación recetas Drug Safety Research Unit Fotocopia prescripción Heeley E et al. Prescription-event monitoring and reporting of adverse drug reactions The Lancet. 2001; 358: 1872 -1873.

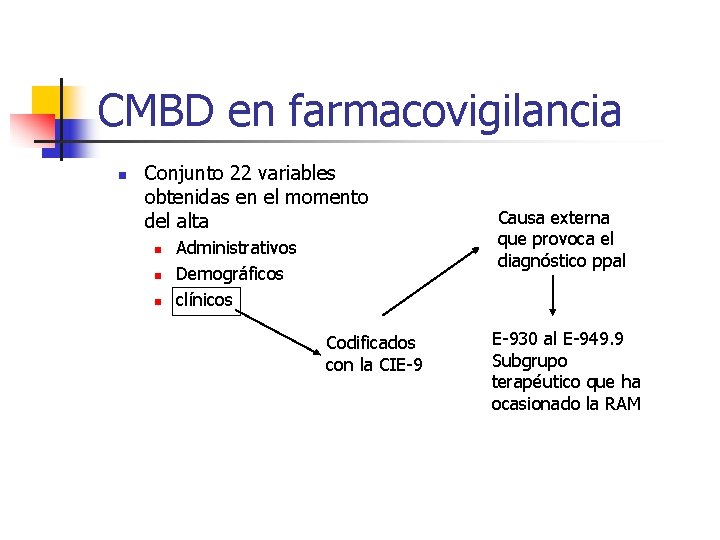
CMBD en farmacovigilancia n Conjunto 22 variables obtenidas en el momento del alta n n n Administrativos Demográficos clínicos Codificados con la CIE-9 Causa externa que provoca el diagnóstico ppal E-930 al E-949. 9 Subgrupo terapéutico que ha ocasionado la RAM
 Indicadores de farmacovigilancia
Indicadores de farmacovigilancia Farmacovigilancia que es
Farmacovigilancia que es Indicadores de farmacovigilancia
Indicadores de farmacovigilancia Medicamentos lasa
Medicamentos lasa Funda de plastico latex que evita el paso de espermatozoide
Funda de plastico latex que evita el paso de espermatozoide Mtodos
Mtodos Mtodos
Mtodos Mtodos
Mtodos Mtodos
Mtodos Mtodos
Mtodos Mtodos
Mtodos Mtodos
Mtodos Preservativo femenino
Preservativo femenino Mtodos
Mtodos Aumento de entropia
Aumento de entropia Reacciones de neutralización ejemplos
Reacciones de neutralización ejemplos Significado de combustion
Significado de combustion Combustion etanol
Combustion etanol Representacion del fluor
Representacion del fluor Surco mayor adn
Surco mayor adn Complejo activado
Complejo activado Teoria de arrhenius
Teoria de arrhenius Reacciones de vinculo
Reacciones de vinculo Krebs o holbein
Krebs o holbein Reacciones redox
Reacciones redox Reacción de simmons–smith
Reacción de simmons–smith Www.biologia.edu.ar
Www.biologia.edu.ar Electrófilo y nucleófilo
Electrófilo y nucleófilo Reacciones supravitales
Reacciones supravitales Reacciones anodicas y catodicas
Reacciones anodicas y catodicas Aplicaciones del principio del trabajo virtual
Aplicaciones del principio del trabajo virtual Reacciones redox mapa conceptual
Reacciones redox mapa conceptual Reacciones contra el proyecto moderno
Reacciones contra el proyecto moderno Reacción de precipitación
Reacción de precipitación Reacciones quimicas
Reacciones quimicas Tipo de reacciones quimicas
Tipo de reacciones quimicas Alcanos reacciones
Alcanos reacciones Reaccion de sustitucion simple
Reaccion de sustitucion simple Acido mas base
Acido mas base Formula kp
Formula kp Reacciones de neutralización ejemplos
Reacciones de neutralización ejemplos Catabolismo de las proteinas
Catabolismo de las proteinas Reacciones
Reacciones Oxidacion alcohol terciario
Oxidacion alcohol terciario Fsica
Fsica