Stof voor het SE 1 H 1 tm





















- Slides: 24

Stof voor het SE 1 H 1 t/m 7

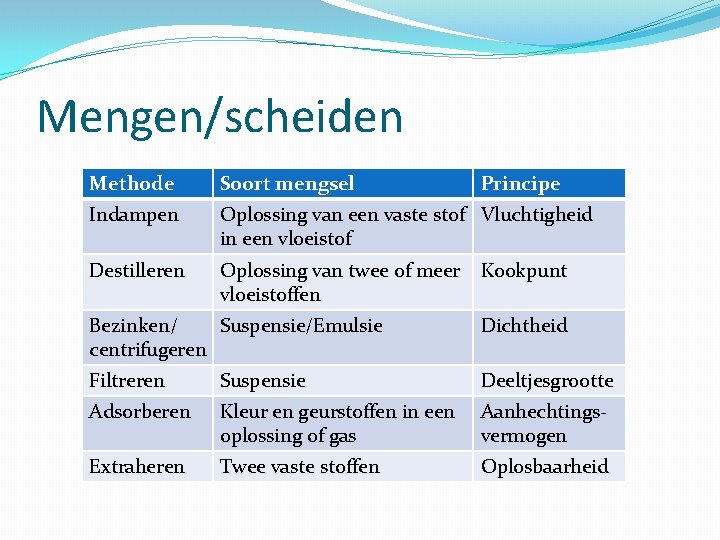
Mengen/scheiden Methode Soort mengsel Principe Indampen Oplossing van een vaste stof Vluchtigheid in een vloeistof Destilleren Oplossing van twee of meer Kookpunt vloeistoffen Bezinken/ Suspensie/Emulsie centrifugeren Dichtheid Filtreren Suspensie Deeltjesgrootte Adsorberen Kleur en geurstoffen in een oplossing of gas Aanhechtingsvermogen Extraheren Twee vaste stoffen Oplosbaarheid

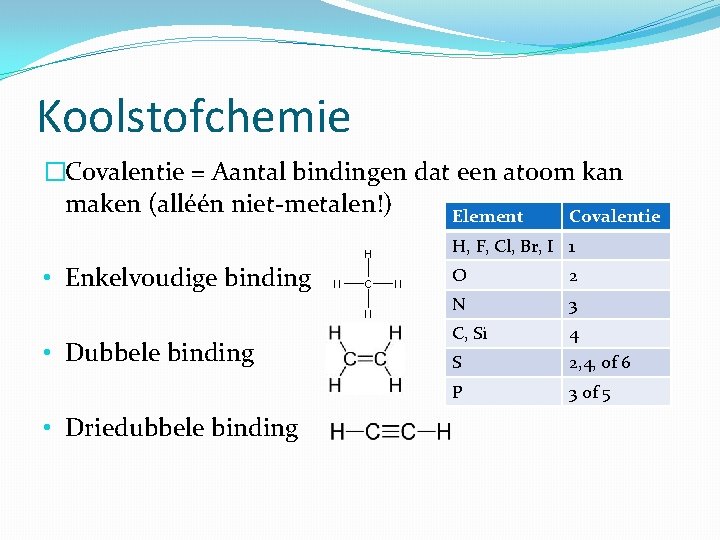
Koolstofchemie �Covalentie = Aantal bindingen dat een atoom kan maken (alléén niet-metalen!) Element Covalentie H, F, Cl, Br, I 1 • Enkelvoudige binding • Dubbele binding • Driedubbele binding O 2 N 3 C, Si 4 S 2, 4, of 6 P 3 of 5

Naamgeving (BINAS 66 D) 1. 2. 3. 4. 5. Zoek de langste keten (=stamnaam) Bepaal de binding (enkel, dubbel) Bepaal de zijgroepen Hoeveel van elk (mono, di, tri) Nummering Alkaan= alleen enkele bindingen: Cn. H 2 n+2 Alkeen= één of meer dubbele bindingen: Cn. H 2 n

Zijgroepen (BINAS 66 D) �Halogenen (Br, Cl, F of I, voorvoegsel eigen naam) �Methylgroep (Cn. Hn+2 groep, CH 3 of C 2 H 5, voorvoegsel metyl, ethyl) �Alcohol (OH groep, achtervoegsel –ol, voorvoegsel hydroxy-) �Aminen (NH 2 groep, achtervoegsel –amine, voorvoegsel amino-) �Zuren (COOH groep, achtervoegsel –zuur)

Voorbeeldje: Langste keten = 3 – 1 dubbele binding stamnaam propeen. Zijgroepen= 1: broom Naam: 3 -broom-1 -propeen Langste keten = 5 – enkele bindingen stamnaam = pentaan Zijgroepen= 3 methyl groepen Naam: 2, 2, 4 -trimethylpentaan

H 3: Atomen Atoomnummer = aantal protonen Massagetal = aantal protonen + neutronen = het aantal deeltjes in de kern Zie tabel 25 (massagetal) & 99 (relatieve atoommassa) Atoomnummer is altijd Kleiner dan de atoommassa

Bouw van het atoom Bij een atoom zijn de elektronen altijd gelijk aan het aantal protonen Atoom = ongeladen, dus positief en negatief moet gelijk aan elkaar zijn Ion = geladen atoom. Heeft dus te veel (negatieve lading) of te weinig (positieve lading) elektronen Aantal elektronen = protonen + of – de lading. Bv: Mg 2+ Atoomnummer = 12, dus 12 protonen. Lading van 2+, dus twee elektronen te weinig. Elektronen = 12 -2=10.

Isotopen Isotoop = hetzelfde atoomnummer, ander massagetal Zie Binas 25 Zelfde atoomnummer = zelfde aantal protonen Ander massagetal, zelfde aantal protonen ander aantal neutronen Isotoop = hetzelfde element, met hetzelfde aantal protonen, maar een ander aantal neutronen Bv: Mg-24, Mg-25 en Mg-26. Het getal staat voor het massagetal

Elementgroepen Groep 1: Alkalimetalen Zeer onedel, reageren dus met alles Lading 1+ Groep 2: Aardalkalimetalen Behoorlijk onedel, reageren met bijna alles Lading 2+ Groep 17: Halogenen Komen nooit alleen voor (Cl 2 Br 2 I 2 F 2) Lading 1 - Groep 18: Edelgassen Zeer edel, reageren nergens mee Geen ionlading, want komen niet als ion voor

Zouten �Opgebouwd uit een metaal en een niet-metaal �Bestaan uit ionen, gebonden door zeer sterke ionbinding. Element �Ion heeft een ander aantal e- dan p+ K, Na, Ag �Ionlading: Zie BINAS 45 & 66 B Al �Lading in een molecuul is 0, aantal – en + moet dus gelijk zijn �Al. Cl 3 �Ba 2 (PO 4)3 Lading 1+ 3+ Fe 2+, 3+ Overige metalen meestal 2+ F, Cl, Br, I 1 - O, S 2 -

Water In water lost een zout wel of niet op. Zie BINAS 45 Reactievergelijkingen: Oplosvergelijking: van (s) naar (aq) KI (s) K+ (aq) + I- (aq) Mg. Cl 2 (s) Mg 2+ (aq) + 2 Cl- (aq) Indampvergelijking: van (aq) naar (s) 3 Na+ (aq) + PO 43 - (aq) Na 3 PO 4 (s)

Neerslag �Twee oplosbare zouten die samen een onoplosbaar zout vormen Deeltjes inventariseren �Vergelijking maken: Mini-tabel 45 We voegen bij elkaar: Neerslagreactie opschrijven Kloppend maken een oplossing van loodnitraat Check: deeltjes + lading en natriumjodide 1. Deeltjes Pb 2+ (aq), NO 3 - (aq), Na+ (aq), I- (aq) 2. 45 NO 33. Reactie Pb 2+ (aq) + 2 I- (aq) Pb. I 2 (s) Pb 2+ g 4. Kloppend Na+ g 5. Check Is g

Bindingen Metalen – Alleen metalen Binding waarbij de positieve metaalionen bij elkaar gehouden worden door de vrije, negatieve, elektronen Zouten – Metaal met een niet metaal Ionbinding: + en – trekt elkaar aan zeer sterke binding Moleculaire stoffen – Alleen niet-metalen Molecuulbinding (vanderwaals krachten): Binding TUSSEN moleculen. Zeer zwak laag smeltpunt Hoe groter het molecuul, hoe hoger de massa, hoe hoger de aantrekkingskracht, hoe hoger het smeltpunt

Invloed op kook/smeltpunt Ionbinding = zeer sterk, hoogste smeltpunt Metaalbinding = redelijk sterk, hoog smeltpunt Vanderwaalsbinding = zwak, laag smeltpunt Grotere massa hoger smeltpunt Dipool extra binding hoger smeltpunt Atoombinding = redelijk sterk Polarie atoombinding= sterker hoger smeltpunt

Waterstofbruggen Binding tussen N-H of O-H groep H bindt met N of O (dus positief (H) met negatief (O of N) N kan dus niet met O! Kan náást de covalente bindingen! Aangegeven met een stippellijn Waterstofbruggen = hydrofiel

Hydrofiel en Hydrofoob Hydrofiel = houdt van water, lost dus goed op in water Hydrofoob = bang voor water, lost dus niet op in water Soort zoekt soort principe Hydrofiel lost op in hydrofiel Hydrofoob lost op in hydrofoob Als een moleculaire (dus niet ionaire) stof waterstofbruggen kan vormen, lost het op.

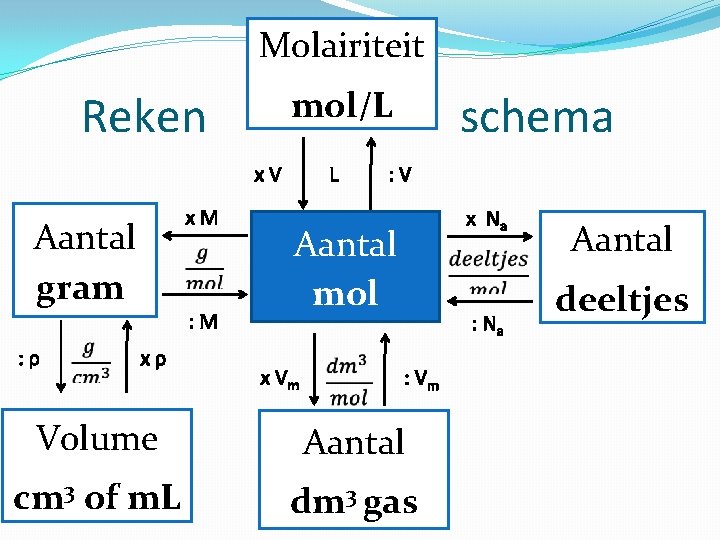
De Mol Eenheid voor de hoeveelheid die je van een stof hebt. 1 mol = 6, 022 x 1023 (getal van Avogadro, zie Binas 7) 1 mol H 2 O = 6, 022 x 1023 water moleculen 1 mol van een stof = de molecuulmassa in u. Dus 1 mol H 2 O weegt 18, 016 gram (Binas) De massa van 1 mol stof = molaire massa. Eenheid = gram per mol (g/mol) De molaire massa van H 2 O is 18, 016 g/mol

Molairiteit mol/L Reken L x. V Aantal gram : ρ xρ x. M : M schema : V Aantal mol x Vm : Vm Volume Aantal cm 3 of m. L dm 3 gas x Na : Na Aantal deeltjes

BINAS Grootheid Eenheid Tabel dichtheid 103 kg m-3 (= g m. L-1); kg m-3 (= g L-1) T 8 t/m T 12 M molaire massa g mol-1 T 98, T 99, T 40 A Vm molair volume 22, 4 L mol-1 (298 K, p 0) T 7 24, 5 L mol-1 (298 K, p 0) NA getal van Avogadro 6, 02 x 1023 deeltjes mol-1 T 7 ρ

Energie effecten Endotherm – Energie voor nodig Constante energietoevoer, bv koken van water Exotherm – Komt energie bij vrij Geen constante energietoevoer, bv een kampvuur Vaak wel activeringsenergie nodig, bv hogere temperatuur http: //www. youtube. com/watch? v=x 9 n 2 j 8 Wv. Df. E

Evenwichtsvoorwaarde Zodra het evenwicht is ingesteld, verandert de concentratiebreuk niet meer. Hij blijft dus constant. De evenwichtsvoorwaarde is dan: Er is evenwicht zodra de concentratiebreuk gelijk is aan K (evenwichtsconstante) De evenwichtsconstante is alleen afhankelijk van de temperatuur.

Reactiesnelheid Afhankelijk van: Soort stof Verdelingsgraad (hoe hoger, hoe sneller) Meer contactoppervlak, dus grotere kans op een effectieve botsing Concentratie (hoe hoger hoe sneller) Meer deeltjes aanwezig, dus grotere kans op een effectieve botsing Temperatuur (hoe hoger hoe sneller) Deeltjes bewegen sneller, het aantal botsingen verandert niet, maar het aantal botsingen per seconde wel.

Verschuiving van het evenwicht 1. Toevoegen reagens (beginstoffen) 1. 1. - Bv: H 2 evenwicht naar rechts. 2. 2. Toevoegen reactant (reactieproduct) 1. - Bv: NH 3 evenwicht naar links Verlagen van druk 3. 1. Evenwicht verschuift naar de kant met de meeste mol gas (in dit geval links). 4. Verkleinen van volume 1. Evenwicht verschuift naar de kant met de minste mol gas (in dit geval rechts). Verlagen temperatuur 5. 1. Evenwicht verschuift naar de kant waar energie wordt vrijgegeven dus de exotherme kant (in dit geval naar rechts)
 Saldo fiscale winst
Saldo fiscale winst Biologie voor het mlo
Biologie voor het mlo Soorten klimaten
Soorten klimaten Dank u voor het kruis heer tekst
Dank u voor het kruis heer tekst Biologie voor het mlo
Biologie voor het mlo Leerlijnen voor het basisonderwijs
Leerlijnen voor het basisonderwijs Uitgaande primaire geldstromen
Uitgaande primaire geldstromen Opwekking 464 tekst
Opwekking 464 tekst Psalm 145 vers 2
Psalm 145 vers 2 Bedankt voor het luisteren
Bedankt voor het luisteren Bedankt voor het welkom heten
Bedankt voor het welkom heten Symbolentaal
Symbolentaal Stof cv
Stof cv Gemalen koffie mengsel of zuivere stof
Gemalen koffie mengsel of zuivere stof Emergente eigenschap biologie
Emergente eigenschap biologie Pentagrammodellen
Pentagrammodellen Koos du plessis poems
Koos du plessis poems Planeten
Planeten Feodale verhoudingen
Feodale verhoudingen Smoet vet espe en spek tekst
Smoet vet espe en spek tekst Uit het oog uit het hart frans
Uit het oog uit het hart frans Stamboom aartsvaders
Stamboom aartsvaders Het regent en het is november
Het regent en het is november Zijn het heupbeen en het dijbeen van de walvis rudimenten?
Zijn het heupbeen en het dijbeen van de walvis rudimenten? Het bloed stroomt waar het niet gaan kan
Het bloed stroomt waar het niet gaan kan