Scheikunde Live 2 april 2020 Atoommodel Rutherford Atoommodel
















- Slides: 18

Scheikunde Live 2 april 2020

Atoommodel Rutherford

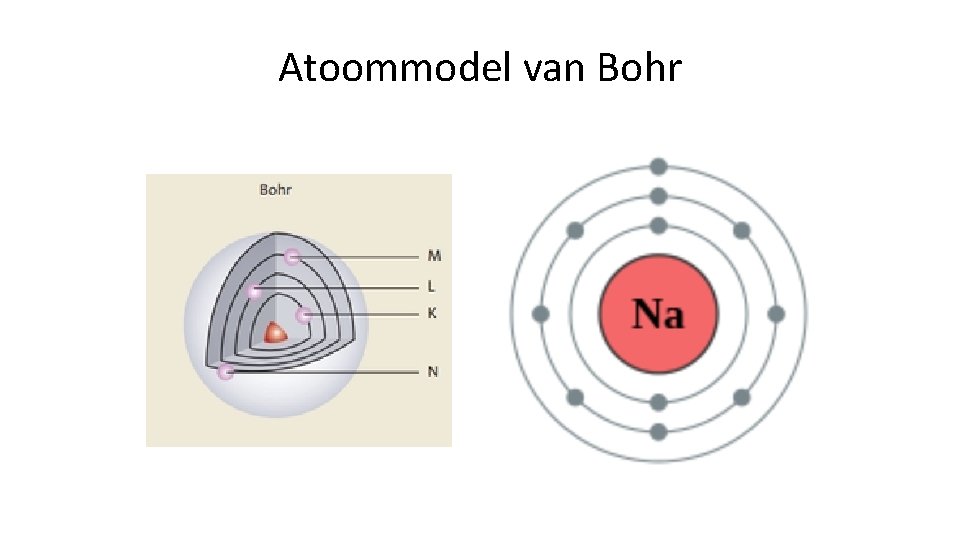
Atoommodel van Bohr

Samengevat (I) • Protonen – Massa: 1 u (1 unit) – Lading: eenheidslading positief (+) – Locatie: Kern • Neutronen – Massa: 1 u (1 unit) – Lading: neutraal (0) – Locatie: Kern • Elektronen – Massa: 0, 0005 u (verwaarloosbaar) – Lading: eenheidslading negatief (-) – Locatie: Elektronenwolk / schillen om de kern

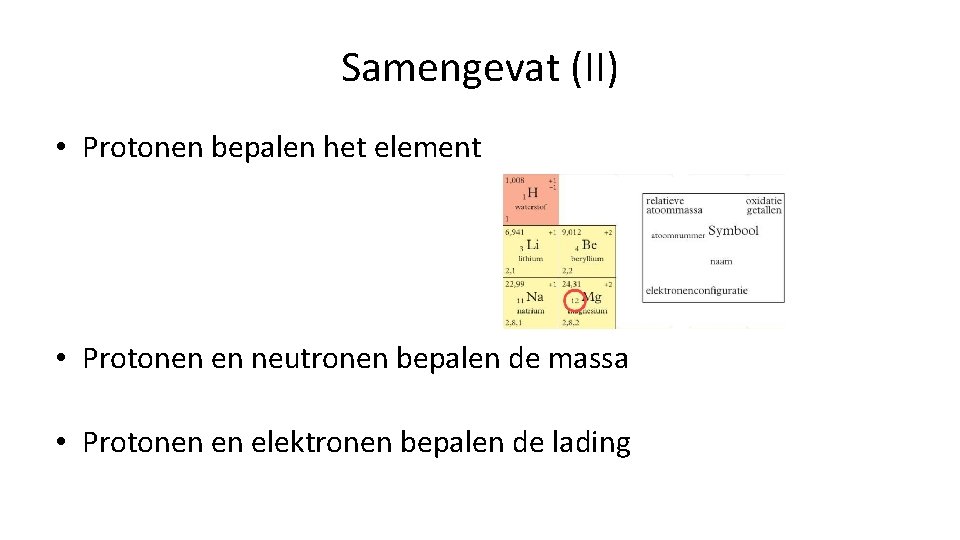
Samengevat (II) • Protonen bepalen het element • Protonen en neutronen bepalen de massa • Protonen en elektronen bepalen de lading

Korte notatie atoommodel • • • 1 p betekend 1 proton 1 n betekend 1 neutron 1 e betekend 1 elektron 1 u betekend de massa is 1 unit 1+ betekend 1 elementaire lading positief 1 - betekend 1 elementaire lading negatief

Huiswerk Geef een beschrijving van het atoommodel van Rutherfort Het atoommodel van Rutherfort gaat als volgt, Rutherfort zegt dat er een kern is en daar omheen zweven allemaal elektronen die worden aangetrokken door de kern, de kern is echt een heel klein deel van de volume maar daar zit wel al de massa van het atoom zegt Rutherford.

Huiswerk Geef aan wat het schil is tussen het atoommodel van Bohr en het Rutherford. In het atoommodel van Rutherford is het een wolk van elektronen die zich vrij kunnen bewegen, maar in die van Bohr zijn er verschillende banen met een bepaalde energie en een bepaalde afstand van de kern waar de elektronen in bewegen.

Huiswerk Bij de vlamtest hebben sommige elementen een specifieke kleur. Leg uit wat er bij het atoom gebeurt waardoor de kleur te zien is. Dan springt de elektron die er omheen zit gaat naar een hoger niveau en omdat de elektron zo dicht mogelijk bij de kern wil zitten springt hij weer terug en zend dan licht uit.

Huiswerk Leg aan de hand van het atoommodel uit wat het verband is tussen de kleuren die een atoom in een vlam uitzend (emissie) en kleuren die een atoom opneemt (absorptie). Volgens het atoommodel zijn de golflengten van adsorptie en emissie altijd hetzelfde

Licht & Bohr • Model voor licht: golfbeweging van een foton • De golflengte bepaald energie per foton • De mens neemt verschil in golflengte als verschil in kleur waar • Een element heeft verschillende elektronen schillen • Van 1 e schil naar 2 e schil is een vaste hoeveelheid energie • De weg terug is EXACT dezelfde hoeveelheid energie

Binas tabel 25 A • 3 van de 4 atomen hebben een massa van 35 u • 1 van de 4 atomen hebben een massa van 37 u • De gemiddelde massa van 4 chloor atomen is…. (zelf uitrekenen)

Gemiddelde massa chloor •

Massa chloor atoom • De massa van een chloor atoom is 35, 45 u • De massa van één chloor atoom is 35 u of 37 u Notatie • Een chloor atoom: Cl • Één chloor atoom met massa 35 u: Cl-35 • Één chloor atoom met massa 37 u: Cl-37 of of 35 Cl 37 Cl

Isotopen 2 atomen van het zelfde element met een verschil in massa worden isotopen genoemd Cl-35 en Cl-37 zijn twee chloor isotopen Isotopen hebben dus hetzelfde aantal protonen en een ander aantal neutronen Isotopen hebben ‘exact’ dezelfde eigenschappen (m. u. v. massa)

Opgave • Bereken aantal protonen, neutronen en elektronen van een --ion Cl 37 • Element Cl heeft atoomnummer 17, dus 17 p. • Totale massa is 37 u. 17 u komt door de protonen, dus 37 u – 17 u = 20 u massa komt door neutronen, dus 20 n. • 17 p, dus 17 e zou het atoom neutraal maken. Het atoom heeft een - lading, dus 1 e extra: 18 e.

Reacties met atomen • Elektronen worden genegeerd • Behoud protonen en neutronen toepassen U-235 He-4 + ? 235 U 4 He + ?

Mag ik van u naar g? • Het aantal C-12 atomen dat bij elkaar exact 12 gram weegt, noemen we een portie / een mol atomen. • Chloor heeft een massa van 35, 45 u, dus een massa per portie van 35, 45 g mol-1. Snel vergeten • 1 u = 1, 66· 10 -24 g (Binas-tabel 7 B) • 1 mol = 6, 022· 1023 deeltjes (Binas-tabel 7 A) • 1, 66· 10 -24 · 6, 022· 1023 = …
 Reactie warmte berekenen
Reactie warmte berekenen Woudschoten scheikunde
Woudschoten scheikunde Pauzevlam
Pauzevlam Telwoorden scheikunde
Telwoorden scheikunde Scheikunde chemie overal vwo 4
Scheikunde chemie overal vwo 4 Atoomeconomie
Atoomeconomie Scheikunde scheidingsmethoden oefeningen
Scheikunde scheidingsmethoden oefeningen Spatelpuntje
Spatelpuntje Zilvernitraat formule
Zilvernitraat formule Glyceryltrilinolaat
Glyceryltrilinolaat Bolbuis scheikunde
Bolbuis scheikunde Aantal mol
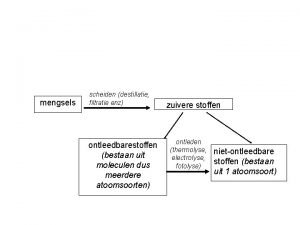
Aantal mol Scheidingsmethoden scheikunde schema
Scheidingsmethoden scheikunde schema Indampen
Indampen Scheidingsmethodes scheikunde schema
Scheidingsmethodes scheikunde schema Scheikunde huiswerk
Scheikunde huiswerk Calciumwaterstofsulfaat wat is dat
Calciumwaterstofsulfaat wat is dat Gecondenseerde structuurformule
Gecondenseerde structuurformule Index betekenis scheikunde
Index betekenis scheikunde