RED PANAMERICANA DE ARMONIZACIN DE LA REGLAMENTACIN FARMACUTICA











































- Slides: 46

RED PANAMERICANA DE ARMONIZACIÓN DE LA REGLAMENTACIÓN FARMACÉUTICA GRUPO DE TRABAJO DE BUENAS PRÁCTICAS DE FARMACOVIGILANCIA PARA LAS AMÉRICAS y otras actividades del GT de FVG de la red PARF 8 de Abril de 2010, Lima, Perú Claudia Vacca, José Luis Castro, OPS/OMS

Grupos de Trabajo de la Red PARF 1) BPM (FDA) 2) BE (FDA) 3) BPC (ANMAT) 4) Falsificación (ANVISA) 5) Clasificación (MS Costa 8) Plantas Medicinales (MS 6) Registro (MS Venezuela) 7) Farmacopeas (USP) 11) Promoción de Medicamentos (ANVISA) Rica) Jamaica) 9) Farmacovigilancia (INVIMA, Colombia) 10) Vacunas (Cuba/MS) BPL (Chile/ISP)

Mandato IV Conferencia Panamericana: Constituir un Grupo de Trabajo que aborde el tema de Farmacovigilancia en la Red Panamericana I REUNION: 23 -24 Agosto, 2006. Salvador Bahía, Brasil.

Grupo de Trabajo en Farmacovigilancia Miembros �Marta Rodríguez, Colombia. Coordinator �Julian Perez, Cuba �Cristina Alonzo, Uruguay �Maryan Hinds, Barbados �Heather Suttcliffe, Canadá �FIFARMA Alternos: Murilo Freitas, Brazil • Personas de recurso • Puntos focales de los países Secretariado OPS/OMS

Grupo de Trabajo en Farmacovigilancia: Misión �Desarrollar y fortalecer la farmacovigilancia a través de actividades y propuestas de regulación armonizadas que promuevan el uso racional y seguro de los medicamentos como un componente necesario de las políticas de Salud Pública en la Región de las Américas.

Grupo de Trabajo en Farmacovigilancia: Objetivos 1. Promover el desarrollo y divulgación de conocimientos, criterios y metodologías en Farmacovigilancia para ser utilizadas en actividades de capacitación y educación dirigidas a los distintos actores relacionados con el medicamento. 2. Analizar y proponer el desarrollo de instrumentos y herramientas de soporte armonizados en farmacovigilancia. 3. Diseñar e impulsar el trabajo en red para el intercambio de conocimientos, la comunicación y el soporte en la toma de decisiones relacionadas con farmacovigilancia. 4. Fomentar la integración de la Farmacovigilancia como parte necesaria de las políticas y programas de Medicamentos y Salud Pública. 5. Promover la investigación y divulgación en Farmacovigilancia, y evaluar su impacto en la Salud Pública con especial énfasis en la seguridad del paciente.

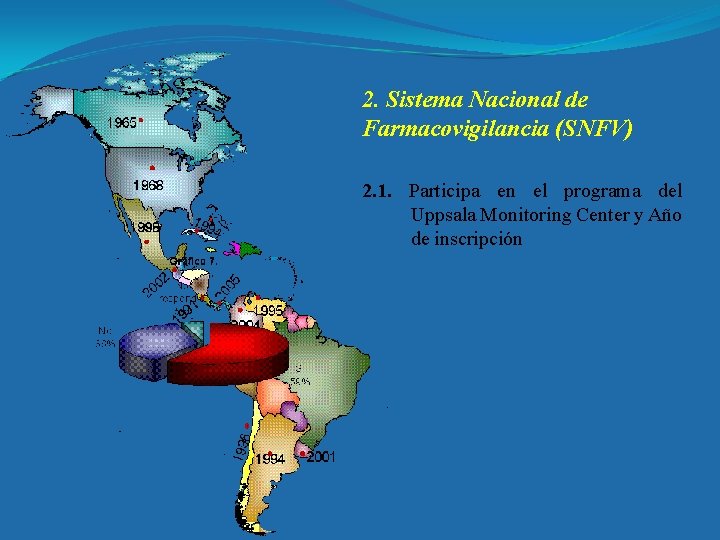
2. Sistema Nacional de Farmacovigilancia (SNFV) 2. 1. Participa en el programa del Uppsala Monitoring Center y Año de inscripción

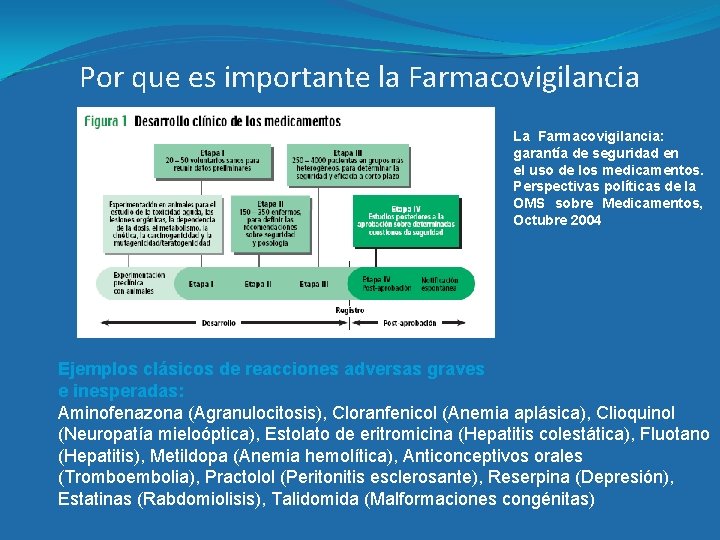
Por que es importante la Farmacovigilancia La Farmacovigilancia: garantía de seguridad en el uso de los medicamentos. Perspectivas políticas de la OMS sobre Medicamentos, Octubre 2004 Ejemplos clásicos de reacciones adversas graves e inesperadas: Aminofenazona (Agranulocitosis), Cloranfenicol (Anemia aplásica), Clioquinol (Neuropatía mieloóptica), Estolato de eritromicina (Hepatitis colestática), Fluotano (Hepatitis), Metildopa (Anemia hemolítica), Anticonceptivos orales (Tromboembolia), Practolol (Peritonitis esclerosante), Reserpina (Depresión), Estatinas (Rabdomiolisis), Talidomida (Malformaciones congénitas)

Buenas Prácticas de Farmacovigilancia �Principios centrales de desarrollo del documento: �El papel fundamental que tienen los sistemas de notificación para intensificar la seguridad de los pacientes. Notificar tiene valor si la misma puede generar una respuesta constructiva. OBJETIVOS DEL DOCUMENTO Se trabajó con el objetivo de facilitar el desarrollo, mejorar y fortalecer los sistemas de farmacovigilancia en la región de las Américas, y promover el ejercicio de las buenas prácticas, para mejorar la seguridad del paciente y de la población de acuerdo a las necesidades de la región. FVG: componente de los programas de SP.

Proceso de formulación Colombia (INVIMA/UN) - Documento ANMAT Cuba (Glosario) OPS-> Propuesta preliminar Comentarios y aportes de los países (4 -8 meses). Redacción Mabel Valsecia, María Sylvia Viola Segundo borrador (OPS) Discusión septiembre de 2007. XIV Reunión DURGLA/Corrientes-Argentina.

Post- DURG-LA: Ajustes �Énfasis en objetivos. �Incorporar guía de análisis de casos, señales y comunicación de alertas (EJEMPLOS!). �Lista de documentos de referencia OMS y otras de BPFV. �Incorporar elementos de certificación y verificación de BPFV.

Post- DURG-LA: Ajustes �Bases de datos existentes, codificación/armonización mínima (posibilidades y limitaciones). �Revisar comunicación de riesgos, retroalimentación a todos niveles. �Anexar formatos de países de la región. �Validar glosario (destacar términos armonizados y no armonizados). �PUESTA A LA OPINIÓN PÚBLICA

Versión final: Octubre de 2008 aprobado en V Conferencia Panamericana

Buenas Prácticas de Farmacovigilancia �Dos pautas centrales: �¿Qué se debe hacer para iniciar un sistema de farmacovigilancia? �¿Cómo mejorar un sistema de farmacovigilancia pre-existente?

Estructura del Documento 1. PRESENTACIÓN 2. OBJETIVOS DEL DOCUMENTO 3. INTRODUCCIÓN 4. BUENAS PRÁCTICAS DE FARMACOVIGILANCIA 5. BUENAS PRÁCTICAS DE ANÁLISIS Y GESTIÓN DE RIESGOS

Estructura del Documento 6. FUNCIONES Y RESPONSABILIDADES DE LOS AGENTES IMPLICADOS 7. PUBLICACIÓN EN FARMACOVIGILANCIA 8. GLOSARIO DE TÉRMINOS UTILIZADOS EN FARMACOVIGILANCIA 68 9. SIGLARIO Anexos: � I Modelo de tarjeta de notificación espontánea 87 � II Algoritmo de de Naranjo y col. y Algoritmo de Causalidad de FDA 89 � III Resumen de responsabilidades

Introducción “La Farmacovigilancia (FV) es la ciencia y las actividades relacionadas con la detección, evaluación, comprensión y prevención de los efectos adversos de los medicamentos o cualquier otro problema relacionado con ellos” Metas de la Farmacovigilancia • Mejorar el cuidado y seguridad de los pacientes en relación al uso de medicinas y todas las intervenciones médicas. • Mejorar la salud pública y la seguridad en relación al uso de los medicamentos • Detectar los problemas relacionados con el uso de medicamentos y comunicar los hallazgos • Contribuir con la evaluación de los beneficios, daños, efectividad y riesgos de los medicamentos • Fomentar la seguridad, del uso de los medicamentos en forma segura, racional y más efectiva • Promover la compresión, educación y entrenamiento clínico en la farmacovigilancia y su efectiva comunicación al público

Buenas Prácticas de Farmacovigilancia � Las Buenas Prácticas de Farmacovigilancia son un conjunto de reglas, procedimientos operativos y prácticas establecidas que se deben cumplir para asegurar la calidad e integridad de los datos. � Las Buenas Prácticas de Farmacovigilancia están basadas en la adquisición de datos completos de los informes de eventos adversos espontáneos. Objetivo de las Buenas Prácticas de Farmacovigilancia Las Buenas Prácticas de Farmacovigilancia deben garantizar: • La veracidad de los datos recogidos, para la correcta evaluación de los riesgos asociados a los medicamentos. • La confidencialidad de la identidad de las personas que hayan presentado o notificado las reacciones adversas. • El uso de criterios uniformes en la evaluación de las notificaciones y en la generación de señales y alertas.

Buenas Prácticas de Farmacovigilancia Organización de Sistemas Nacionales y Centros de Farmacovigilancia Es indispensable plantearse claridad en: • Objetivos • Quién debe notificar • Cómo obtener las notificaciones • Mecanismos para recibir las notificaciones y manejar los datos • Análisis de expertos • Capacidad de responder a las notificaciones • Método de clasificación de los eventos notificados • Diseminación de los hallazgos • Infraestructura técnica • Seguridad de los datos

Buenas Prácticas de Farmacovigilancia Para comenzar un centro es necesario: � Divulgación � Continuidad administrativa � Recursos gubernamentales � Colaboración, coordinación, comunicación y relaciones públicas Acciones básicas en el establecimiento de un centro � Plan de Trabajo � Recursos económicos � Localización � Equipamiento necesario � Personal � Continuidad � Comités consultivos � Servicios de información

Buenas Prácticas de Farmacovigilancia Ficha de Notificación Cuatro secciones: datos del paciente, descripción del evento, datos del medicamento y del notificador Se establece la información: Mínima y necesaria: • Datos del paciente • Descripción del evento adverso • Datos del medicamento sospechoso • Datos del paciente sobre su enfermedad • Medicamentos concomitantes • Datos del profesional que notifica • Factores de riesgo • Documentación del diagnóstico del evento • La evolución clínica • Determinaciones de laboratorio relevantes • Retirada y reexposición • otra información relevante Para los errores de medicación es deseable: • Productos involucrados • Secuencia de eventos que condujeron al error • Entorno laboral en el cual sucedió el error • Tipos de personal involucrados con el error, tipo(s) de errores, y factores que pueden contribuir en ellos Es recomendable la inclusión de una sección narrativa

Buenas Prácticas de Farmacovigilancia Ficha de Notificación El anexo I incluye un modelo de ficha de notificación

Buenas Prácticas de Farmacovigilancia Documentación Manual de calidad: Es un documento que describe los objetivos, medios y procedimientos de calidad. Es un documento importante a través del cual, tanto personal interno como externo puede hacerse una idea del sistema de garantía de calidad existente. Manual de procedimientos: Es un documento que debe recoger, de forma ordenada y lógica, los Procedimientos Normalizados de Trabajo que se utilizan en el centro, describiendo la interrelación existente entre ellos, para dar una idea de conjunto del sistema de garantía de calidad. Procedimientos operativos de trabajo: Se definen como las instrucciones escritas y detalladas para lograr la uniformidad en la realización de una actividad específica. Se establecen los contenidos mínimos

Buenas Prácticas de Farmacovigilancia Sistema informático Debe estar validado Procedimientos operativos para: I. Funcionamiento II. Mantenimiento III. Seguridad IV. Control de acceso y copias Acceso a documentación y modificaciones restringido y registrado Controles periódicos

Buenas Prácticas de Farmacovigilancia Gestión de Notificaciones La gestión de notificaciones implica: • Considerar todas las notificaciones realizadas por profesionales sanitarios. • Verificar que la notificación contenga la información mínima para ser considerada válida. • Realizar el máximo esfuerzo para obtener la información completa y necesaria. • Realizar un seguimiento de las notificaciones incompletas. • Establecer procedimientos para estimular la notificación. Las Buenas Prácticas de Farmacovigilancia involucra: • Métodos de envío de notificaciones • Cómo mejorar la notificación • Codificación y registro de datos • Revisión de la base de datos • Evaluación de notificaciones (codificación, relevancia, imputabilidad, etc. )

LAS BUENAS PRÁCTICAS DE ANÁLISIS Y GESTIÓN DE RIESGOS � El análisis de riesgos se ocupa de la identificación, la cuantificación y la evaluación de los riesgos. � La gestión de riesgos se ocupa de la implementación y del seguimiento de las medidas reguladoras adoptadas para la comunicación de los riesgos a los profesionales de la salud y/o la población en general, y determinar las medidas preventivas.

LAS BUENAS PRÁCTICAS DE ANÁLISIS Y GESTIÓN DE RIESGOS Luego de la entrada de datos de acuerdo a las buenas prácticas, se realiza el Análisis de Riesgos en tres pasos y luego se aplica la Gestión de riesgos: �Identificación de riesgos �Cuantificación de riesgos �Evaluación de riesgos. �Gestión de riesgos �Comunicación de riesgos

LAS BUENAS PRÁCTICAS DE ANÁLISIS Y GESTIÓN DE RIESGOS �Identificación de riesgos: Generación de señales y evaluación de la causalidad de informes de casos y series de casos individuales. �Cuantificación de riesgos: Cuantificación de la fuerza de asociación y de su impacto en la Salud Pública. �Evaluación de riesgos: Evaluación del riesgo/beneficio, si es aceptable para la sociedad y en que condiciones. �Gestión de riesgos: Desarrollo e implementación de herramientas para la minimización del riesgo y reevaluación del riesgo/beneficio � Adoptar medidas administrativas de reducción del riesgo. � Comunicar a los profesionales sanitarios y a los pacientes la existencia del riesgo, las medidasadoptadas y las recomendaciones al respecto. � Establecer estrategias específicas de prevención.

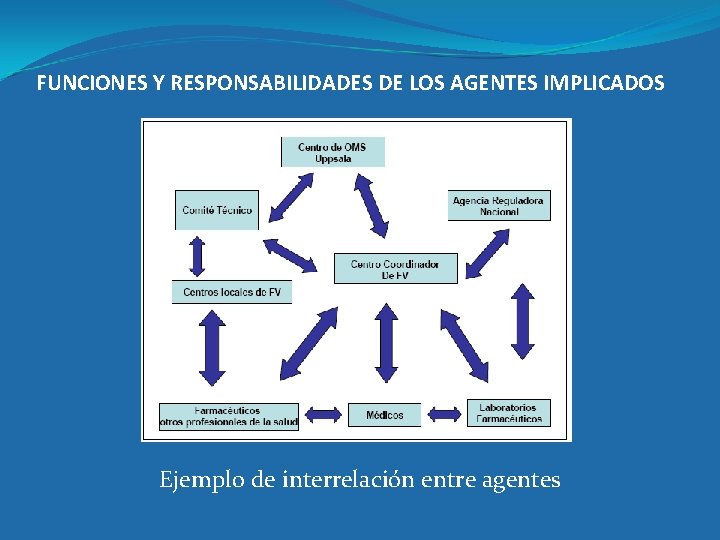
FUNCIONES Y RESPONSABILIDADES DE LOS AGENTES IMPLICADOS �La Farmacovigilancia es un trabajo cooperativo y una actividad de responsabilidad compartida entre todos los agentes o actores implicados con los medicamentos �Se definen los objetivos, obligaciones, interrelaciones de los principales agentes o actores: �Autoridad Reguladora Nacional �Sistemas Nacionales de Farmacovigilancia �Profesionales Sanitarios �Laboratorios farmacéuticos �Otras instituciones de salud

FUNCIONES Y RESPONSABILIDADES DE LOS AGENTES IMPLICADOS Ejemplo de interrelación entre agentes

PUBLICACIÓN EN FARMACOVIGILANCIA �Difusión de la información, importancia, metodología y requerimientos. �Observación, revisión de casos y series de casos múltiples. �Directrices a autores y editores �Responsables editoriales.


BUENAS PRÁCTICAS DE FARMACOVIGILANCIA (FV) V Conferencia recomienda a la Red PARF: �Adoptar el documento BPFV con los cambios sugeridos. �Implementarla para su validación y seguimiento en dos grupos de países que representen bajos niveles de desarrollo de la FV y en un grupo con programas en marcha.

A las autoridades nacionales reguladoras de medicamentos (ARN): �Incorporar y posicionar programas de FV en el marco de las actividades regulatorias de las agencias y de la vigilancia integral del uso de medicamentos considerando la evaluación de la información clínica del registro, el seguimiento de ensayos clínicos y la vigilancia post comercialización.

Reunión marzo 2009 OPS/INVIMA �Priorización Plan de Trabajo: VALIDACIÓN BPFV, edición, publicación y capacitación con base en el documento. �Socialización miembros del grupo y puntos focales.

�Validar en países Guatemala, Colombia, Argentina (bajo, medio y alto nivel de desarrollo del sistema de FV) DOS FASES 1 Prevalidación (ajuste documento) 2. Validación (aplicación lista de chequeo).

Cuestionario de prevalidación

PAISES QUE RESPONDIERON LA ENCUESTA DE PREVALIDACIÓN

Validación 1. Lista de chequeo EXTRAIDO del documento: 196 preguntas y guía de aplicación. Español e inglés. 2. Aplicación en Guatemala y Colombia

GUATEMALA

Indicadores Farmacovigilancia. Proyecto: Autoridades Reguladoras Nacionales de Referencia de OPS, EM/THR. Documento base: Practical Guidance for Conducting a Review (based on the WHO Data Collection Tool for the Review of Drug Regulatory Systems).

ØJulio 2010: Documento Publicado dentro de la serie de documentos técnicos de OPS/OMS

ØIntegración con vacunas y biológicos. ØRed de puntos focales. ØReferencia Subregiona de centros: Colombia?

Reunión de Bogotá, Marzo de 2010 • Preparación de conferencia para autoridades. • Importancia desde SP: no recepción de notificaciones. • CAN: Sensibilización de autoridades en Septiembre en Venezuela. NO VIABLE. • Capacitación vrs: preparación para la acción: Entrenamiento: virtual- presencial- virtual Piloto: Ecuador, Perú?

Reunión de Bogotá, Marzo de 2010 Entrenamiento: Virtual. Preguntas/rtas: Funciones, conceptos y casos. Presencial: Ejercicio con casos. Discusión. 3 er día: plan personal y grupal. Virtual: Desarrollo de plan y foro. Piloto: Ecuador, Perú?

Muchas Gracias
 Farmacutica
Farmacutica Farmacutica
Farmacutica Ciudad redond
Ciudad redond Municipios del estado merida
Municipios del estado merida Ed panamericana
Ed panamericana Organizacion mundial de la salud logo
Organizacion mundial de la salud logo Nombres de preparatoria
Nombres de preparatoria Panamericana
Panamericana Asociacion panamericana de la salud
Asociacion panamericana de la salud Purves
Purves Panamericana
Panamericana Hb panamericana urbana
Hb panamericana urbana Proteunuria
Proteunuria Panamericana
Panamericana Why does a red ball look red
Why does a red ball look red Blue g red o yellow o blue g green l red e
Blue g red o yellow o blue g green l red e Blue indigo violet
Blue indigo violet Als approach
Als approach Metaphor in stereo hearts
Metaphor in stereo hearts White over red pilot ahead
White over red pilot ahead Blue red orange blue green red
Blue red orange blue green red A red red rose
A red red rose Old news poetic devices
Old news poetic devices The original source of all genetic variation is _____
The original source of all genetic variation is _____ You are my sunshine text
You are my sunshine text The red command
The red command Red blood cell
Red blood cell Red nacional de observatorios
Red nacional de observatorios Bumpin up and down in my little red wagon
Bumpin up and down in my little red wagon Zadnji roditeljski sastanak
Zadnji roditeljski sastanak Alexandru anca
Alexandru anca Irish red cross register of pledges
Irish red cross register of pledges Ch3(ch2)3cooh
Ch3(ch2)3cooh Roses are red, violets are blue poem
Roses are red, violets are blue poem Dnevni red prvog roditeljskog sastanka
Dnevni red prvog roditeljskog sastanka Red hat linux firewall
Red hat linux firewall Red headed flea beetle
Red headed flea beetle Stephen crane realism
Stephen crane realism Red chilena de municipios ante el cambio climático
Red chilena de municipios ante el cambio climático Vodafone red edge
Vodafone red edge Foreshadowing and flashback
Foreshadowing and flashback Game ka na ba
Game ka na ba Upon
Upon Pirámide trófica y sus 5 niveles
Pirámide trófica y sus 5 niveles Red cross greater ny
Red cross greater ny Red timber wolf
Red timber wolf Rapoport luebering pathway
Rapoport luebering pathway