REAKSI ELIMINASI Mekanisme Reaksi Eliminasi 1 Eliminasi 1




![Mekanisme E 2 • Laju = k[CH 2 Br][B] • Karena sering kali B Mekanisme E 2 • Laju = k[CH 2 Br][B] • Karena sering kali B](https://slidetodoc.com/presentation_image/2a4eb09af8521c7f5ef5aeb64ccc369f/image-11.jpg)




- Slides: 24

REAKSI ELIMINASI

Mekanisme Reaksi Eliminasi 1. Eliminasi (β) – 1, 2 2. Mekanisme E 1 3. Mekanisme E 1 c. B 4. Mekanisme E 2 5. Eliminasi (α)-1, 1 6. Eliminasi Sin Pirolitik

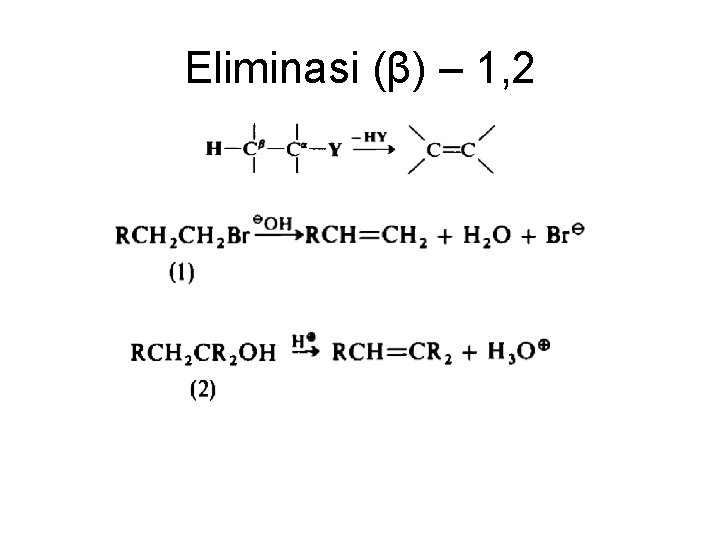
Eliminasi (β) – 1, 2

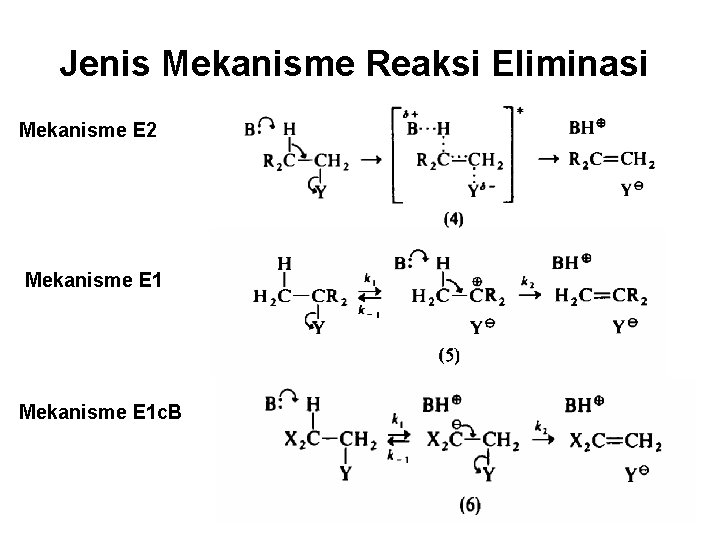
Jenis Mekanisme Reaksi Eliminasi Mekanisme E 2 Mekanisme E 1 c. B

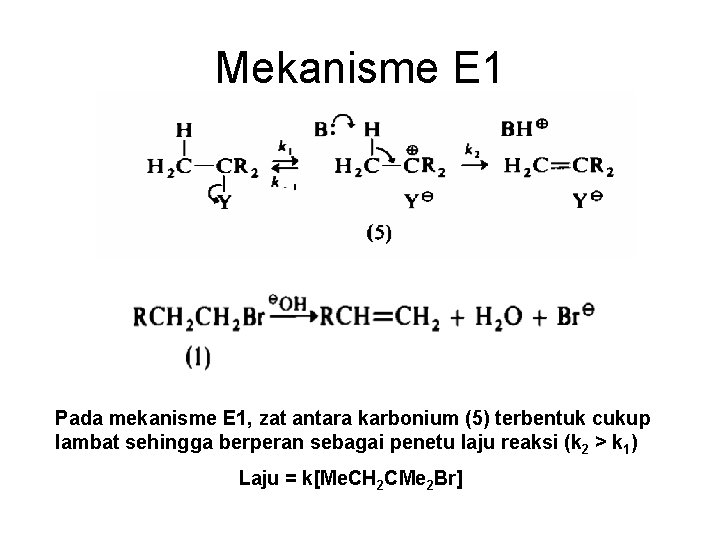
Mekanisme E 1 Pada mekanisme E 1, zat antara karbonium (5) terbentuk cukup lambat sehingga berperan sebagai penetu laju reaksi (k 2 > k 1) Laju = k[Me. CH 2 CMe 2 Br]

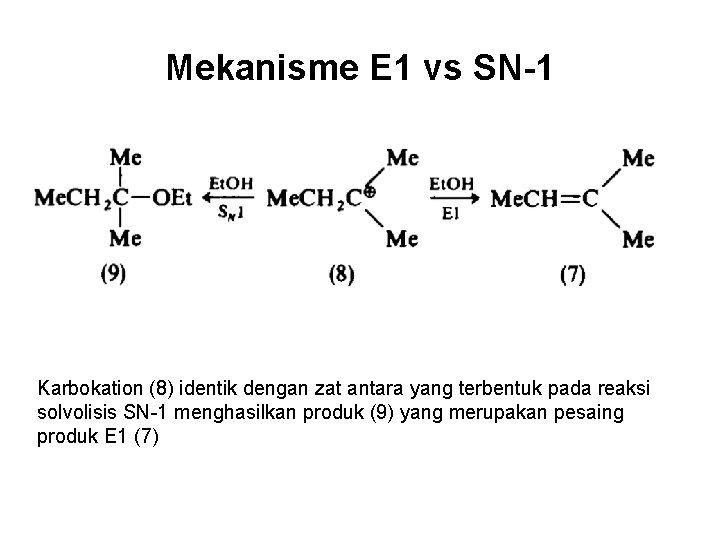
Mekanisme E 1 vs SN-1 Karbokation (8) identik dengan zat antara yang terbentuk pada reaksi solvolisis SN-1 menghasilkan produk (9) yang merupakan pesaing produk E 1 (7)

Pengaruh Struktur Substrat q Gugus yang dapat memantapkan karbokation : Laju E 1 primer < sekunder < tersier q Percabangan pada atom karbon β mendukung eliminasi E 1, sehingga : eliminasi terhadap Me. CH 2 CMe 2 Cl menghasilkan 34 % alkena, sedangkan terhadap Me 2 CHCMe 2 Cl menghasilkan 62 % alkena.

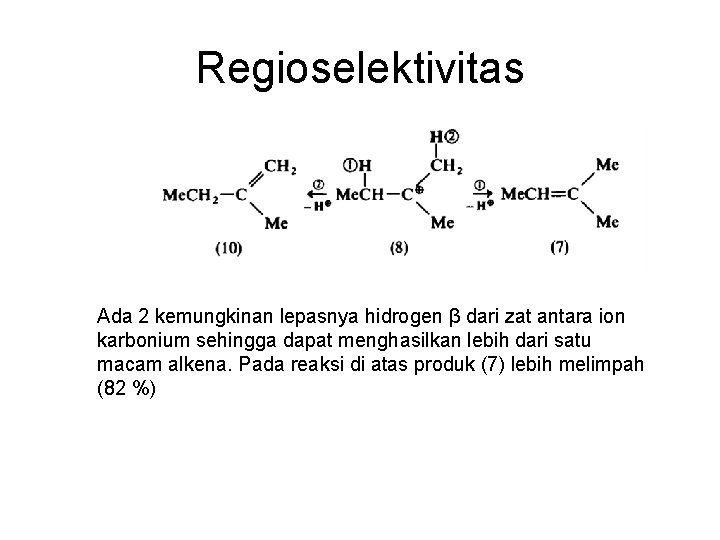
Regioselektivitas Ada 2 kemungkinan lepasnya hidrogen β dari zat antara ion karbonium sehingga dapat menghasilkan lebih dari satu macam alkena. Pada reaksi di atas produk (7) lebih melimpah (82 %)

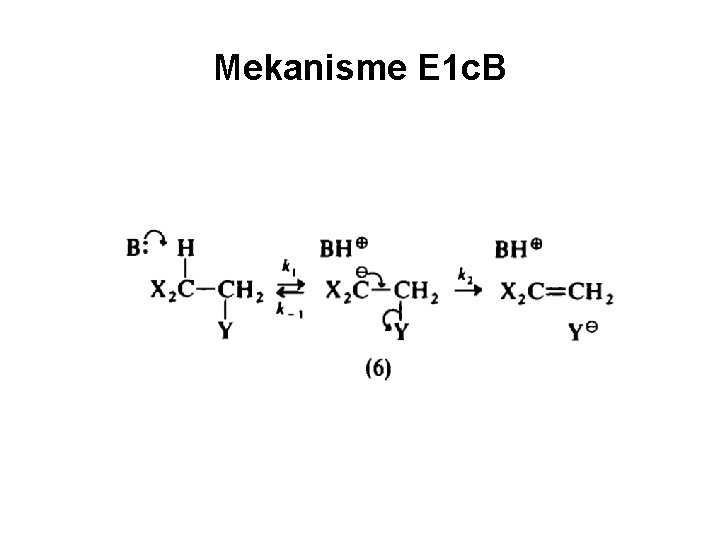
Mekanisme E 1 c. B

Pengaruh Gugus pergi
![Mekanisme E 2 Laju kCH 2 BrB Karena sering kali B Mekanisme E 2 • Laju = k[CH 2 Br][B] • Karena sering kali B](https://slidetodoc.com/presentation_image/2a4eb09af8521c7f5ef5aeb64ccc369f/image-11.jpg)
Mekanisme E 2 • Laju = k[CH 2 Br][B] • Karena sering kali B merupakan nukleufil selain basa, pada reaksi E 2 sering disertai produk SN-2

Faktor yang Mempengaruhi Laju E 2 • Pengaruh Kekuatan Basa • -NH > -OR > -OH 2 • Pergantian pelarut protik polar menjadi aprotik polar meningkatkan kekuatan basa tertentu misalnya -OH dan –OR, karena menurunnya kekuatan solvasi terhadap basa. • Laju relatif dengan -OEt/Et. OH: Ph. CH 2 F Ph. CH 2 Cl Ph. CH 2 Br Ph. CH 2 I 1 70 4, 2 x 10 3 2, 7 x 104

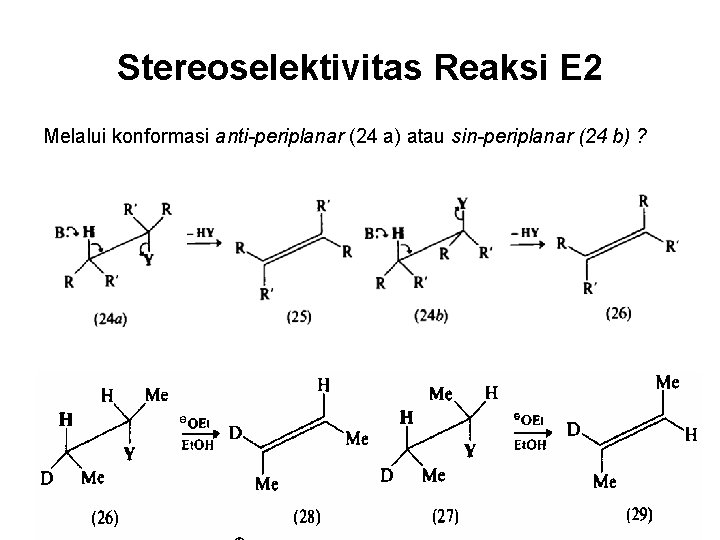
Stereoselektivitas Reaksi E 2 Melalui konformasi anti-periplanar (24 a) atau sin-periplanar (24 b) ?

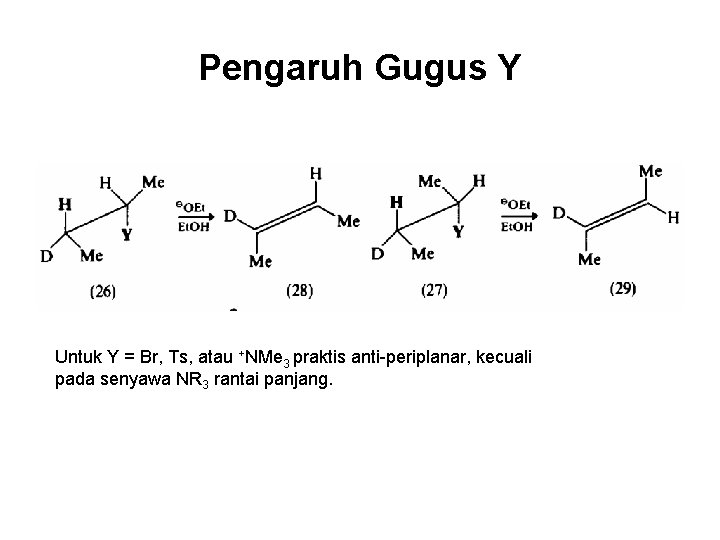
Pengaruh Gugus Y Untuk Y = Br, Ts, atau +NMe 3 praktis anti-periplanar, kecuali pada senyawa NR 3 rantai panjang.

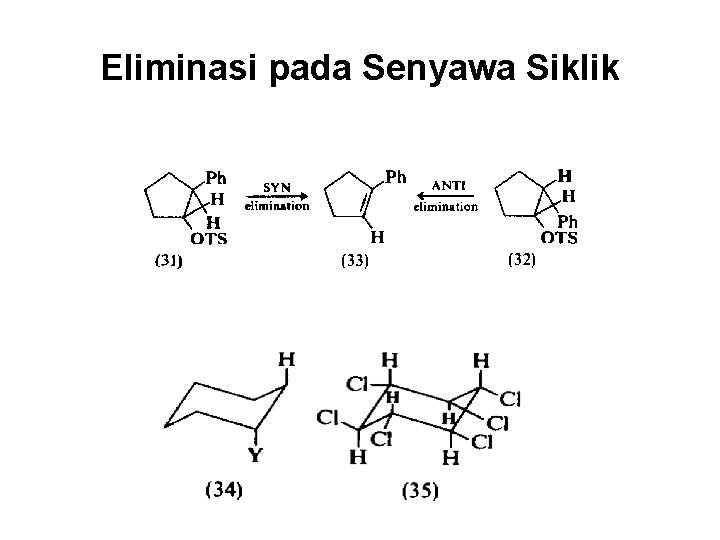
Eliminasi pada Senyawa Siklik

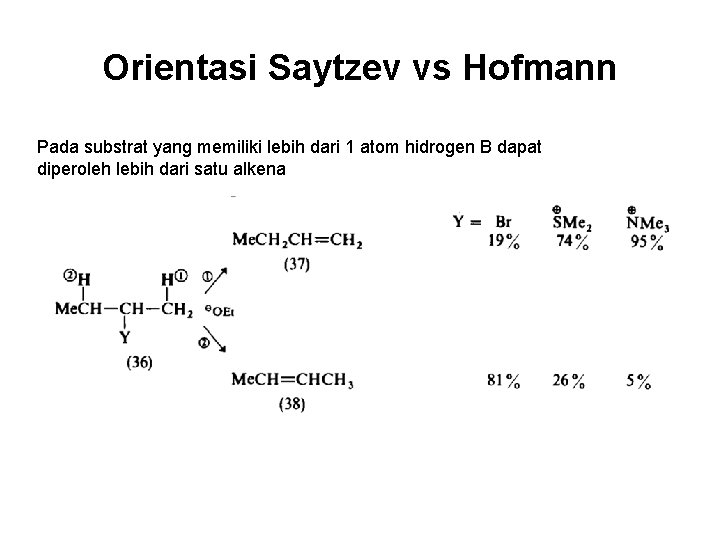
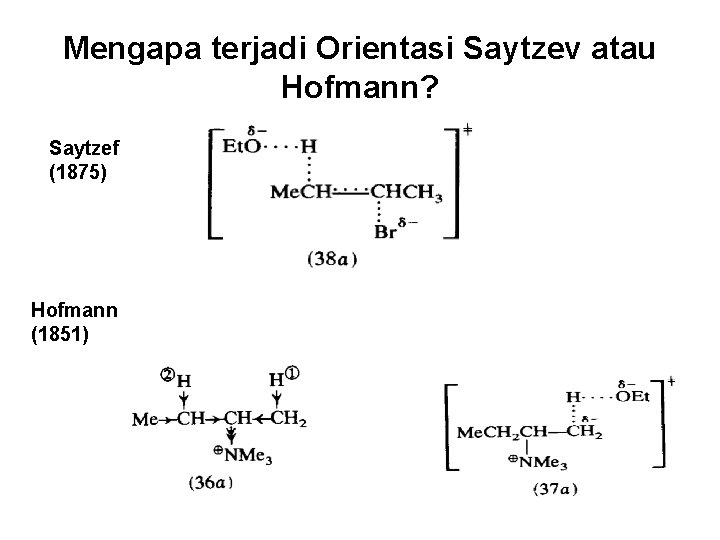
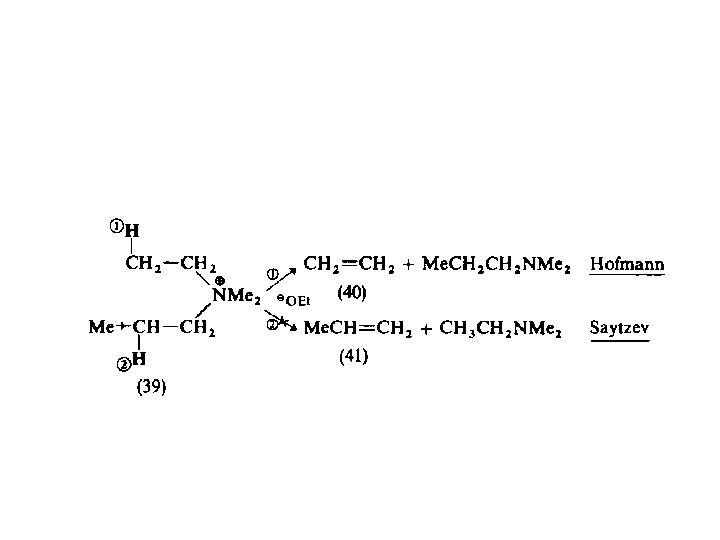
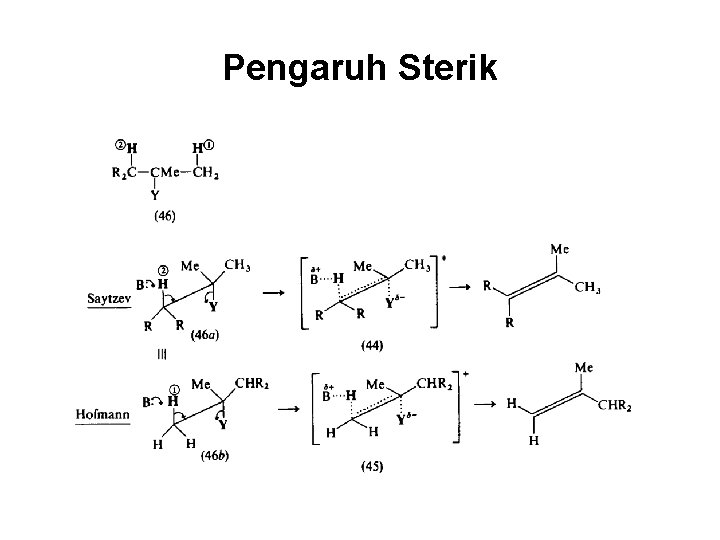
Orientasi Saytzev vs Hofmann Pada substrat yang memiliki lebih dari 1 atom hidrogen B dapat diperoleh lebih dari satu alkena

Mengapa terjadi Orientasi Saytzev atau Hofmann? Saytzef (1875) Hofmann (1851)

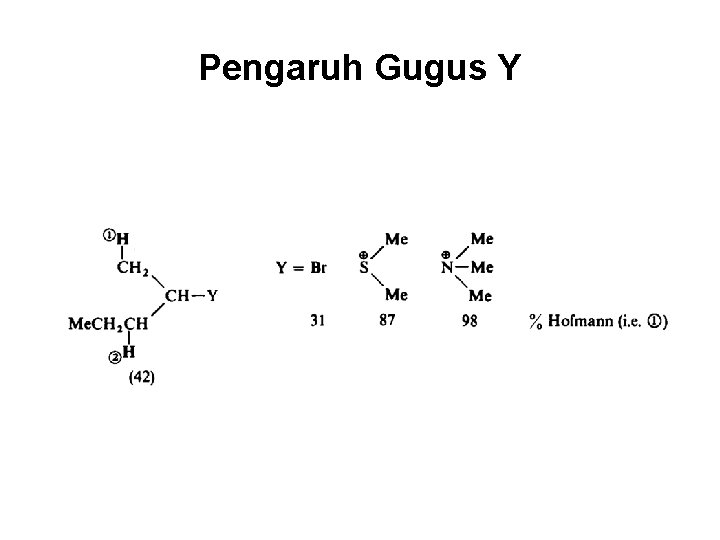
Orientasi Hofmann • Apabila Y adalah F cenderung produk Hofmann, misalnya pada eliminasi terhadap Et. CH 2 CHFCH 3 menghasilkan tidak kurang dari 85% Et. CH 2 CH=CH 2 • Meningkatnya kekuatan basa juga meningkatkan produk Hofmann. • Subtituen Ph, C=C, meningkatkan pembentukan alkena dengan ikatan rangkap terkonjugasi dengannya.


Pengaruh Gugus Y

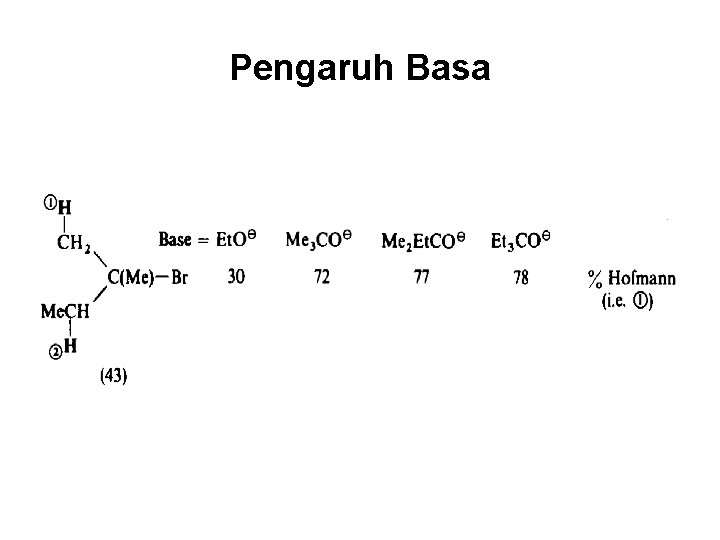
Pengaruh Basa

Pengaruh Sterik

Zaitsev’s Rule for Elimination Reactions (1875) • In the elimination of HX from an alkyl halide, the more highly substituted alkene product predominates

Mekanisme E 1 c. B
 Mekanisme reaksi e1
Mekanisme reaksi e1 Reaksi senyawa karbon adisi eliminasi substitusi
Reaksi senyawa karbon adisi eliminasi substitusi Reaksi eliminasi
Reaksi eliminasi Reaksi
Reaksi Reaksi diazotasi
Reaksi diazotasi Reaksi kompleks adalah
Reaksi kompleks adalah 2-etil-1-butanamina
2-etil-1-butanamina Bilangan oksidasi unsur bebas adalah +1 *
Bilangan oksidasi unsur bebas adalah +1 * Reaksi ch3 ch2 cl ch2 ch2 + hcl disebut reaksi
Reaksi ch3 ch2 cl ch2 ch2 + hcl disebut reaksi Gas mulia
Gas mulia Invers matriks
Invers matriks Eliminasi gauss jordan
Eliminasi gauss jordan Elektrik akısı formülü
Elektrik akısı formülü Eliminasi gauss
Eliminasi gauss Tatancang pemorosan
Tatancang pemorosan Penyelesaian
Penyelesaian Cara menyelesaikan
Cara menyelesaikan Contoh soal persamaan simultan dan penyelesaiannya
Contoh soal persamaan simultan dan penyelesaiannya Asuhan keperawatan dengan gangguan konstipasi
Asuhan keperawatan dengan gangguan konstipasi Metode gauss jordan
Metode gauss jordan Elektrostimülasyon
Elektrostimülasyon Eliminasi gauss
Eliminasi gauss Metode eliminasi gauss jordan
Metode eliminasi gauss jordan Eliminasi gauss jordan
Eliminasi gauss jordan Contoh jurnal eliminasi
Contoh jurnal eliminasi