QUIMICA ORGANICA La qumica orgnica es la rama
















- Slides: 18

QUIMICA ORGANICA La química orgánica es la rama de la química que estudia una clase numerosa de moléculas que en su gran mayoría contienen carbonoformando enlaces covalentes carbono o carbono-hidrógeno y otros heteroátomos, también conocidos como compuestos orgánicos. Debido a la omnipresencia del carbono en los compuestos que esta rama de la química estudia esta disciplina también es llamada química del carbono https: //es. wikipedia. org/wiki/Qu%C 3%ADmica_org%C 3%A 1 nica

¿QUÉ ES LA QUÍMICA ORGÁNICA? La química orgánica es la química del carbono y de sus compuestos. IMPORTANCIA DE LA QUÍMICA ORGÁNICA Los seres vivos estamos formados por moléculas orgánicas, proteínas, ácidos nucleicos, azúcares y grasas. Todos ellos son compuestos cuya base principal es el carbono. Los productos orgánicos están presentes en todos los aspectos de nuestra vida: la ropa que vestimos, los jabones, champús, desodorantes, medicinas, perfumes, utensilios de cocina, la comida, etc.


TIPOS DE ENLACES ENTRE ÁTOMOS DE CARBONO Enlace doble, el orbital puede hibridarse con dos orbitales en vez de tres, dando lugar a tres orbitales híbridos denominados y quedando una orbita. Enlace tipo π, en el que las orbitales tienen forma de dos lóbulos tangentes en el núcleo del átomo, al solaparse con los del otro átomo formando dos nubes electrónicas una por encima y otra por debajo de del eje que une los dos átomos de carbono. Enlace triple entre átomos de carbono, el orbital se híbrida con un solo orbital dando lugar a dos orbitales híbridos denominados , quedando el átomo dos orbitales .

CARACTERITICAS DEL ÁTOMO DE CARBONO Número atómico 6 y número de masa 12 Esto significa que tiene en su núcleo 6 protones y 6 neutrones, y que dicho núcleo está rodeado por 6 electrones. Esos electrones se distribuyen en su estructura de la siguiente manera: dos en su primer nivel (llamado s) y cuatro en su segundo nivel (llamado p). Fuente: https: //www. caracteristicas. co/atomo-de-carbono/#ixzz 4 pst. A 0 Cub

ES TETRAVALENTE Esto significa que, como se señaló, tiene 4 electrones orbitando en su último nivel de energía, los cuales se pueden combinar con los electrones más externos de otros átomos, a menudo también de carbono, formando enlaces covalentes. Fuente: https: //www. caracteristicas. co/atomo-de-carbono/#ixzz 4 pst. Tn. Vx 5

TRES POSIBLES HIBRIDACIONES En virtud de esos cuatro electrones de la capa más externa que se pueden combinar con los electrones de otros átomos, el átomo de carbono puede formar tres tipos de uniones, las que tienen implicancias en la geometría molecular final. Estos enlaces pueden ser: simples (hibridación sp 3) dobles (hibridación sp 2) triples (hibridación sp) Fuente: https: //www. caracteristicas. co/atomo-de-carbono/#ixzz 4 pstev. OF 2

TRES POSIBLES CONFIGURACIONES Dado que el tipo de unión determina el ángulo de enlace, a su vez existen tres posibles geometrías moleculares cuando el carbono participa de una unión: El enlace simple determina la formación de un tetraedro, con ángulos de 109. 5° El enlace doble determina la formación de una estructura triangular plana, con ángulos de 120° El enlace triple determina la formación de una estructura lineal, con ángulos de 180° Fuente: https: //www. caracteristicas. co/atomo-de-carbono/#ixzz 4 pstp. O 5 Lz

TRES GRADOS DE REACTIVIDAD El enlace simple determina la mayor distancia entre los átomos de carbono (1. 54 Armstrongs) y por ende, la mayor estabilidad o menor reactividad (nivel de energía: 347 Kj/mol). El enlace doble “acerca” los átomos de carbono (1. 34 Armstrongs) y torna a la unión más reactiva (598 Kj/mol). El enlace triple es el que más acerca los átomos de carbono entre sí (1. 20 Armstrongs), por lo que son estos los más reactivos (811 Kj/mol). Fuente: https: //www. caracteristicas. co/atomo-de-carbono/#ixzz 4 psu 0 z. IWQ

RELATIVA SEMEJANZA CON EL DE SILICIO El carbono es el primer miembro del grupo IV dentro de la tabla periódica de los elementos. Le sigue en este mismo grupo el silicio, que también tiene 4 electrones en su capa más externa. Sin embargo, el silicio no puede formar enlaces múltiples silicio-silicio a causa de la repulsión que genera un mayor número de electrones internos, lo que hace que los átomos no puedan aproximarse lo suficiente. Fuente: https: //www. caracteristicas. co/atomo-de-carbono/#ixzz 4 psu. BMqwf

PRESENTA ALOTROPÍA Esto significa que puede presentarse bajo estructuras moleculares diferentes, en el mismo estado físico, dependiendo de las condiciones de formación. Los alótropos más importantes del carbono son: Diamante Grafito Lonsdaleíta Buckminsterfullereno Nanotubo de carbono Carbono amorfo Grafeno Fuente: https: //www. caracteristicas. co/atomo-de-carbono/#ixzz 4 psu. Ka. H 00

PRESENTA ISÓTOPOS El carbono tiene solo dos isótopos naturales: el carbono 12, que es el mayoritario (98, 90%), y el carbono 13, presente en mínima proporción (1, 10%). Además existen trece isótopos inestables cuyos períodos de semidesintegración o vida media van desde los 200 nanosegundos (como en el carbono 22) hasta los 5730 años (como sucede con el carbono 14). El carbono 13 se utiliza en estudios estructurales (sobre todo, de RMN), el carbono 14 se emplea para datar objetos arqueológicos, dada su larguísima vida media. Fuente: https: //www. caracteristicas. co/atomo-de-carbono/#ixzz 4 psucna. UC

SE COMBINA FÁCILMENTE El carbono se puede combinar tanto con metales como con no metales (ejemplos: carburo de calcio, disulfuro de carbono, cloroformo, etc. ). Se estima que hay cerca de 10 millones de compuestos de carbono, muchos de ellos esenciales para la vida. Fuente: https: //www. caracteristicas. co/atomo-de-carbono/#ixzz 4 psun. YB 48

KEKULÉ Y LAS BASES DE LA QUÍMICA ORGÁNICA El químico alemán August Kekulé postuló en el año 1858 una teoría estructural que permitió explicar el fenómeno de resonancia del benceno, constituido por 6 átomos de carbono y 6 de hidrógeno. Esto fue fundamental como antecedente del concepto de enlace covalente introducido por Lewis, que sirve de base para entender la química del carbono en general. Fuente: https: //www. caracteristicas. co/atomo-de-carbono/#ixzz 4 psuy. Kj. P 3

GRUPOS FUNCIONALES El grupo funcional es un átomo o conjunto de átomos unidos a una cadena carbonada, representada en la fórmula general por R para los compuestos alifáticos y como Ar(radicales alifáticos) para los compuestos aromáticos. Los grupos funcionales son responsables de la reactividad y propiedades químicas de los compuestos orgánicos. La combinación de los nombres de los grupos funcionales con los nombres de los alcanos de los que derivan brinda una nomenclatura sistemática poderosa para denominar a los compuestos orgánicos. Los grupos funcionales se asocian siempre con enlaces covalentes, al resto de la molécula. https: //es. wikipedia. org/wiki/Grupo_funcional

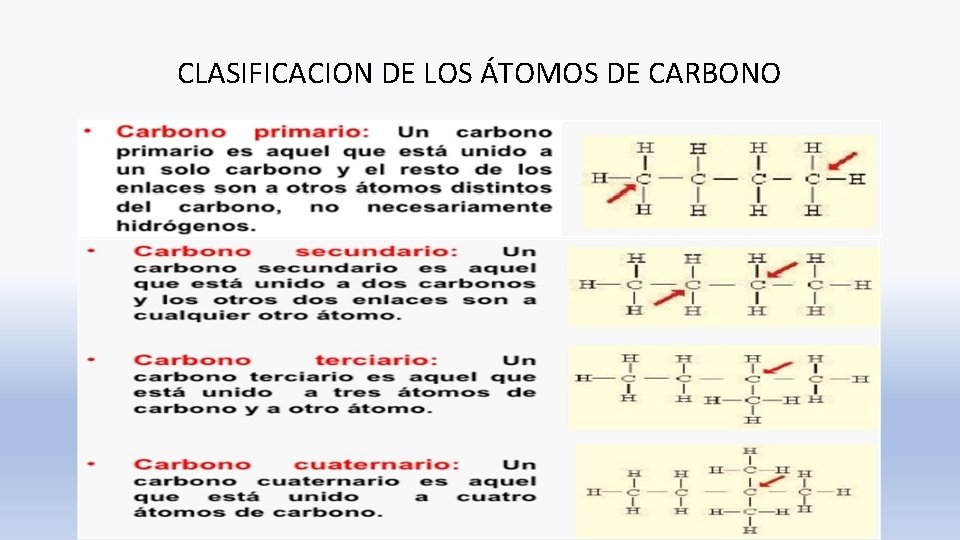
CLASIFICACION DE LOS ÁTOMOS DE CARBONO


 Proses tumbesaran rama-rama
Proses tumbesaran rama-rama Sri rama sri rama sri manoharama
Sri rama sri rama sri manoharama Grupo funcional del alcohol etilico
Grupo funcional del alcohol etilico Quimica
Quimica Propilundecano
Propilundecano Prioridad de grupos funcionales en quimica organica
Prioridad de grupos funcionales en quimica organica Actividad optica en quimica organica
Actividad optica en quimica organica Que es la quimica organica
Que es la quimica organica Cadena abierta ramificada
Cadena abierta ramificada Química orgânica resumo
Química orgânica resumo Tabela nomenclatura dos hidrocarbonetos
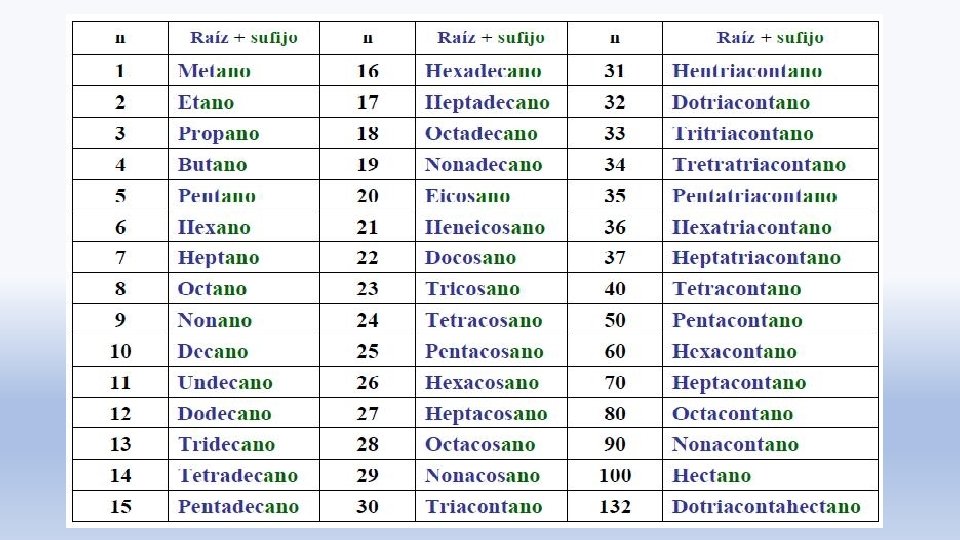
Tabela nomenclatura dos hidrocarbonetos Prefijo neo
Prefijo neo Tabla de grupos funcionales
Tabla de grupos funcionales Enantiomeros
Enantiomeros Que son pares
Que son pares Tabla comparativa de quimica organica e inorganica
Tabla comparativa de quimica organica e inorganica Grupos alquilo
Grupos alquilo Qumica
Qumica Ciclometano
Ciclometano

































