ISOMERA Fenmeno por el que sustancias que tienen





- Slides: 37

ISOMERÍA Fenómeno por el que sustancias que tienen la misma fórmula molecular presentan fórmulas estruturales diferentes y propiedades distintas. (iso = igual, meros = parte) Concepto general en química, de especial relevancia en Química Orgánica I. Robina, Dpto. Química Orgánica 1/67

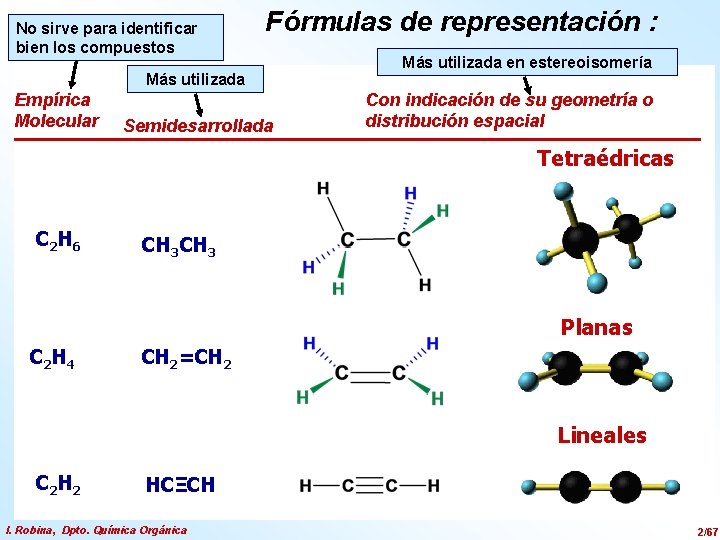
No sirve para identificar bien los compuestos Fórmulas de representación : Más utilizada Empírica Molecular Semidesarrollada Más utilizada en estereoisomería Con indicación de su geometría o distribución espacial Tetraédricas C 2 H 6 CH 3 Planas C 2 H 4 CH 2=CH 2 Lineales C 2 H 2 HCΞCH I. Robina, Dpto. Química Orgánica 2/67

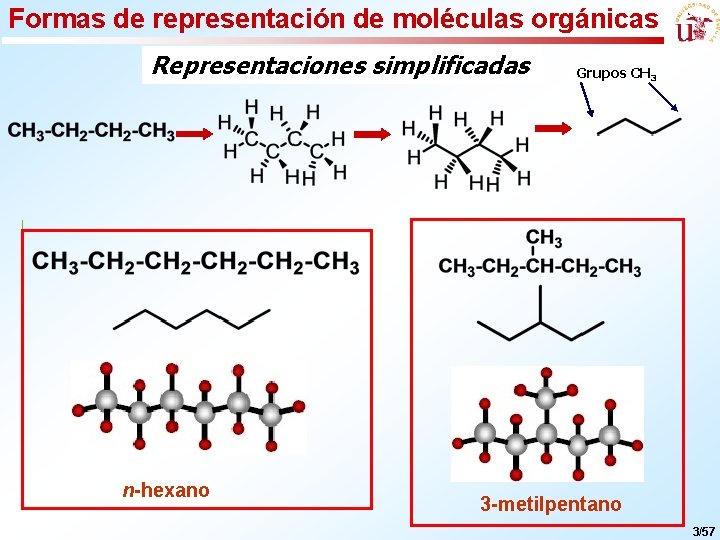
Formas de representación de moléculas orgánicas Representaciones simplificadas n-hexano Grupos CH 3 3 -metilpentano 3/57

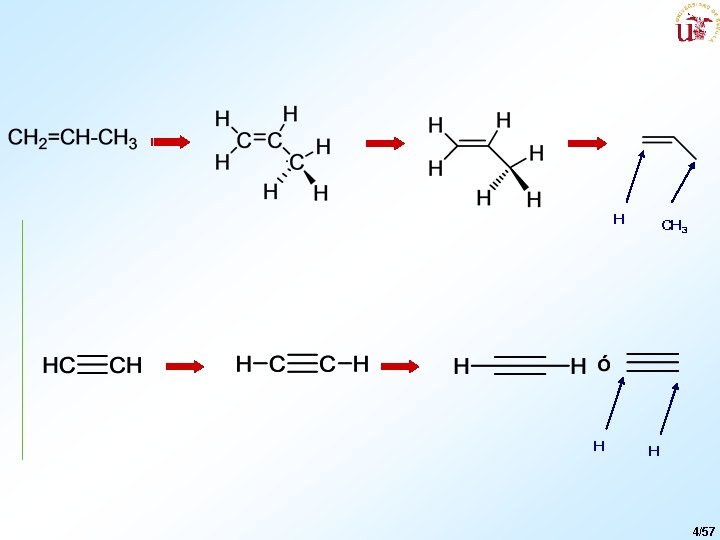
H H CH 3 H 4/57

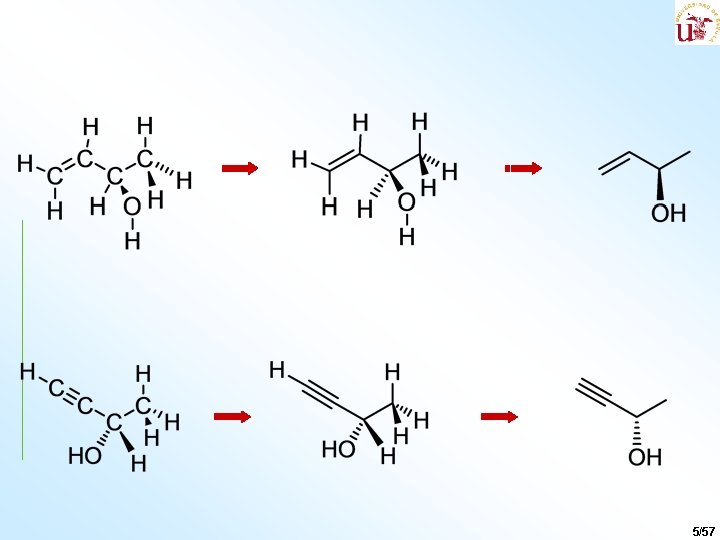
5/57

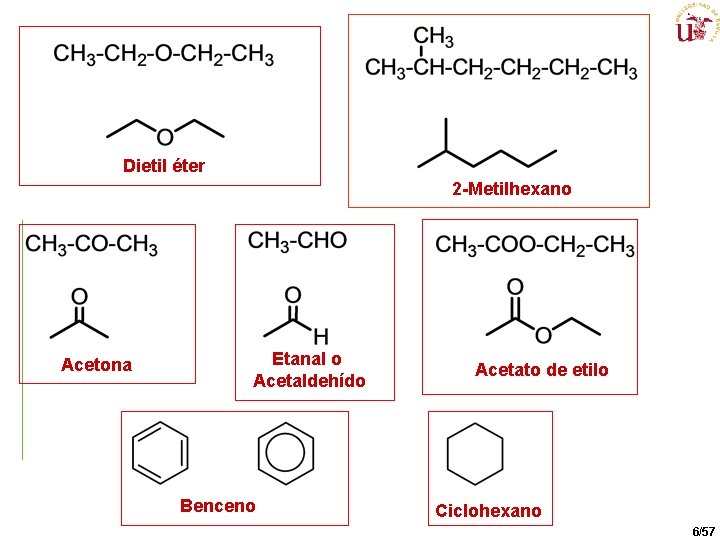
Dietil éter 2 -Metilhexano Acetona Etanal o Acetaldehído Benceno Acetato de etilo Ciclohexano 6/57

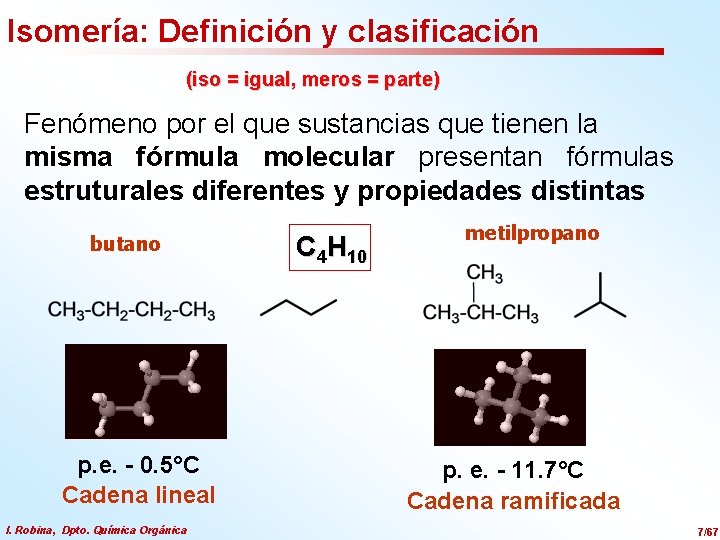
Isomería: Definición y clasificación (iso = igual, meros = parte) Fenómeno por el que sustancias que tienen la misma fórmula molecular presentan fórmulas estruturales diferentes y propiedades distintas butano p. e. - 0. 5°C Cadena lineal I. Robina, Dpto. Química Orgánica C 4 H 10 metilpropano p. e. - 11. 7°C Cadena ramificada 7/67

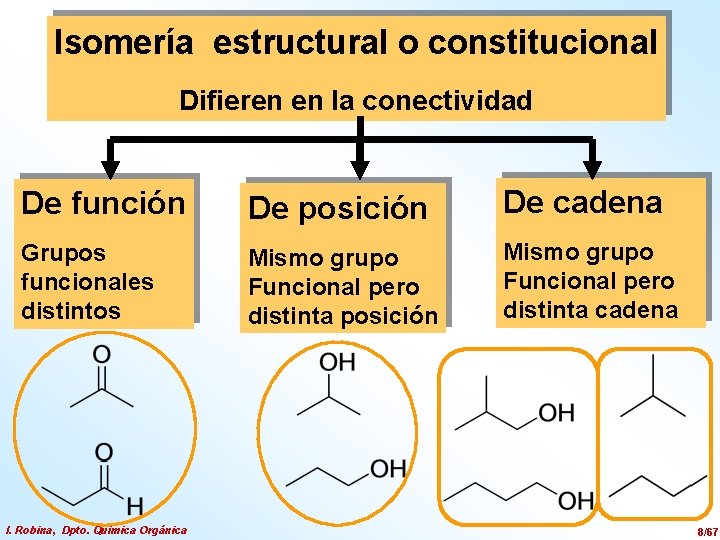
Isomería estructural o constitucional Difieren en la conectividad De función De posición De cadena Grupos funcionales distintos Mismo grupo Funcional pero distinta posición Mismo grupo Funcional pero distinta cadena I. Robina, Dpto. Química Orgánica 8/67

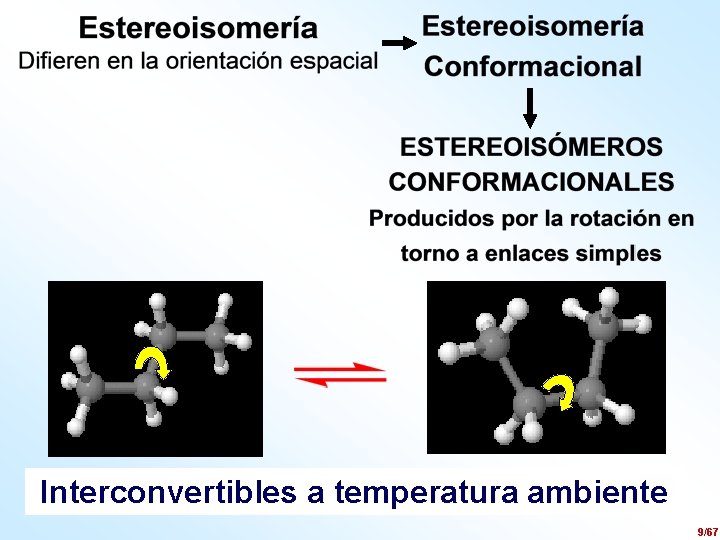
Interconvertibles a temperatura ambiente 9/67

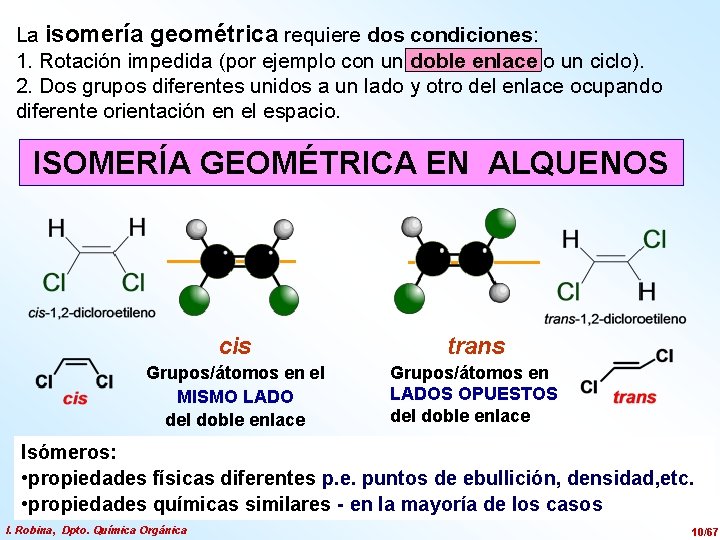
La isomería geométrica requiere dos condiciones: 1. Rotación impedida (por ejemplo con un doble enlace o un ciclo). 2. Dos grupos diferentes unidos a un lado y otro del enlace ocupando diferente orientación en el espacio. ISOMERÍA GEOMÉTRICA EN ALQUENOS cis trans Grupos/átomos en el MISMO LADO del doble enlace Grupos/átomos en LADOS OPUESTOS del doble enlace Isómeros: • propiedades físicas diferentes p. e. puntos de ebullición, densidad, etc. • propiedades químicas similares - en la mayoría de los casos I. Robina, Dpto. Química Orgánica 10/67

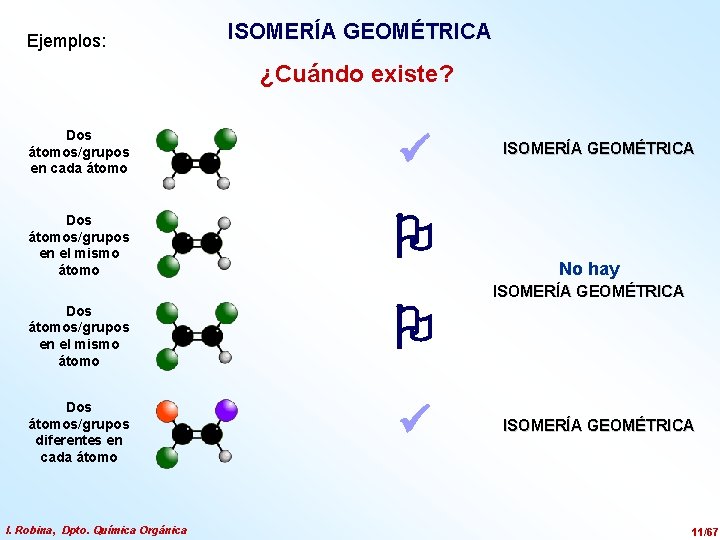
Ejemplos: ISOMERÍA GEOMÉTRICA ¿Cuándo existe? Dos átomos/grupos en cada átomo Dos átomos/grupos en el mismo átomo Dos átomos/grupos diferentes en cada átomo I. Robina, Dpto. Química Orgánica ISOMERÍA GEOMÉTRICA No hay ISOMERÍA GEOMÉTRICA 11/67

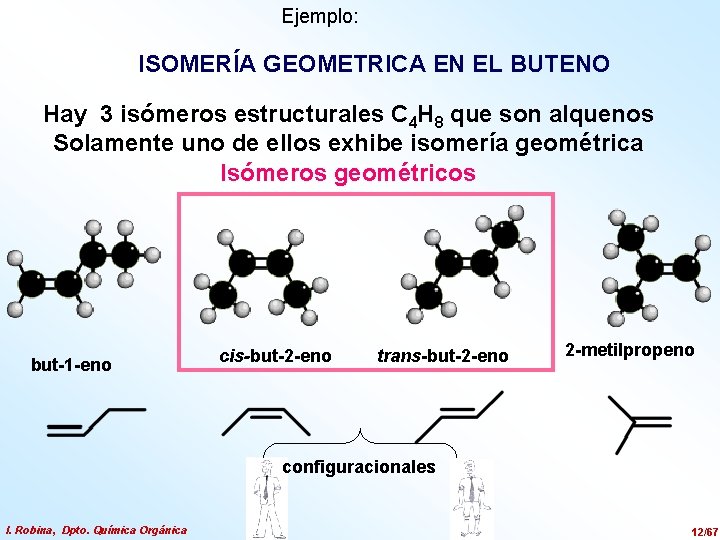
Ejemplo: ISOMERÍA GEOMETRICA EN EL BUTENO Hay 3 isómeros estructurales C 4 H 8 que son alquenos Solamente uno de ellos exhibe isomería geométrica Isómeros geométricos but-1 -eno cis-but-2 -eno trans-but-2 -eno 2 -metilpropeno configuracionales I. Robina, Dpto. Química Orgánica 12/67

ISOMERIA ÓPTICA Está relacionada con la ACTIVIDAD ÓPTICA ¿Qué es la ACTIVIDAD ÓPTICA? Capacidad de hacer girar el plano de vibración de la luz polarizada. La presentan ciertos compuestos puros o mezclas no equimolares. I. Robina, Dpto. Química Orgánica 13/67

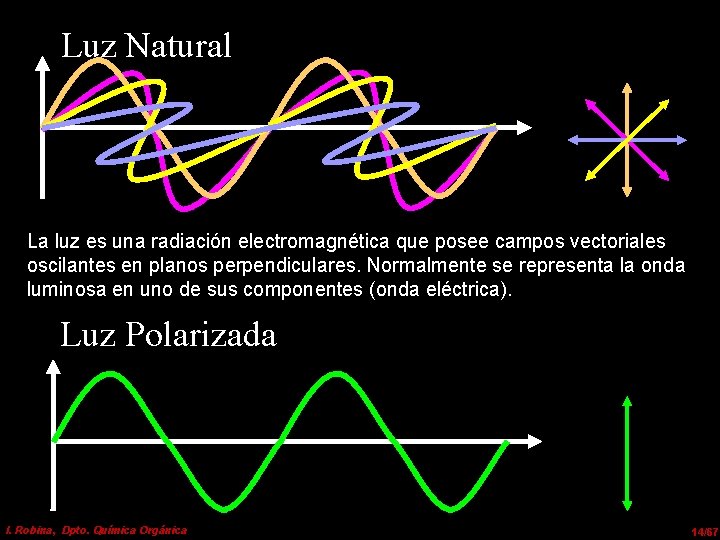
Luz Natural La luz es una radiación electromagnética que posee campos vectoriales oscilantes en planos perpendiculares. Normalmente se representa la onda luminosa en uno de sus componentes (onda eléctrica). Luz Polarizada I. Robina, Dpto. Química Orgánica 14/67

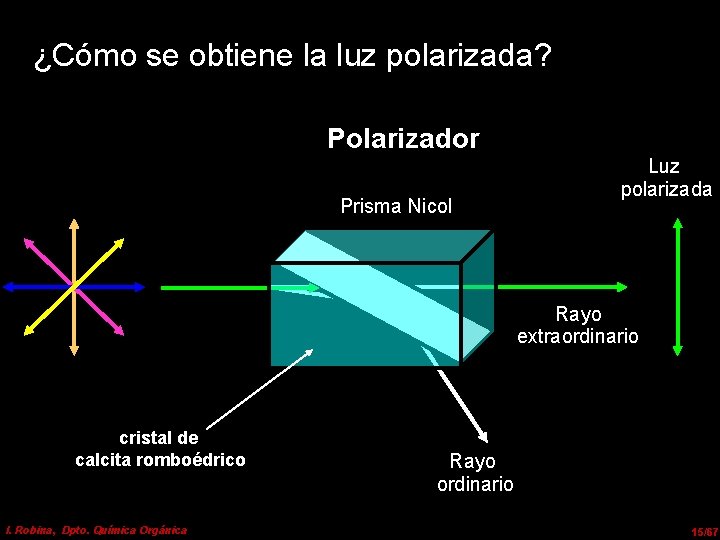
¿Cómo se obtiene la luz polarizada? Polarizador Prisma Nicol Luz polarizada Rayo extraordinario cristal de calcita romboédrico I. Robina, Dpto. Química Orgánica Rayo ordinario 15/67

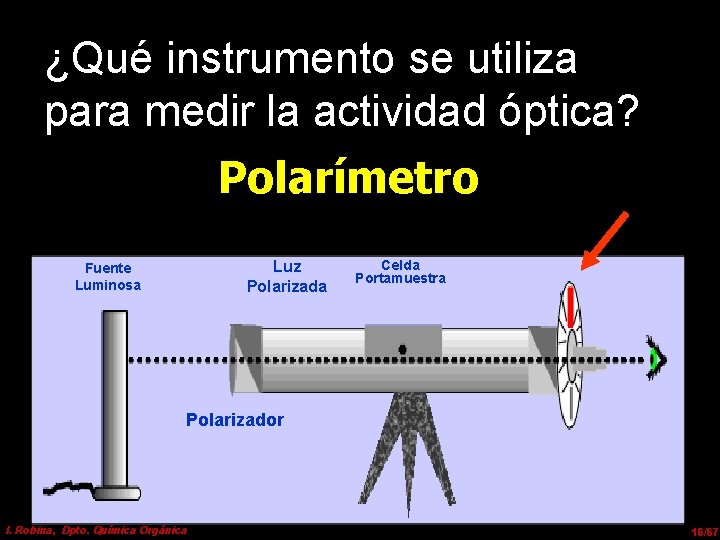
¿Qué instrumento se utiliza para medir la actividad óptica? Polarímetro Luz Polarizada Fuente Luminosa Celda Portamuestra Polarizador I. Robina, Dpto. Química Orgánica 16/67

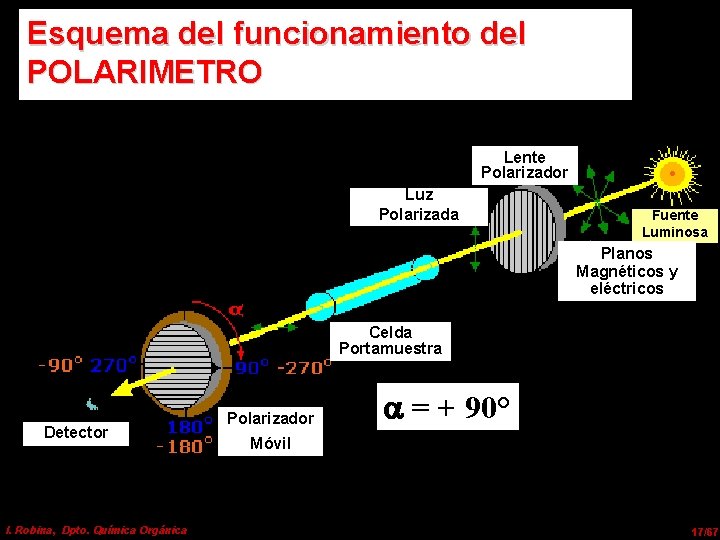
Esquema del funcionamiento del POLARIMETRO Lente Polarizador Luz Polarizada Fuente Luminosa Planos Magnéticos y eléctricos Celda Portamuestra Detector I. Robina, Dpto. Química Orgánica Polarizador = + 90° Móvil 17/67

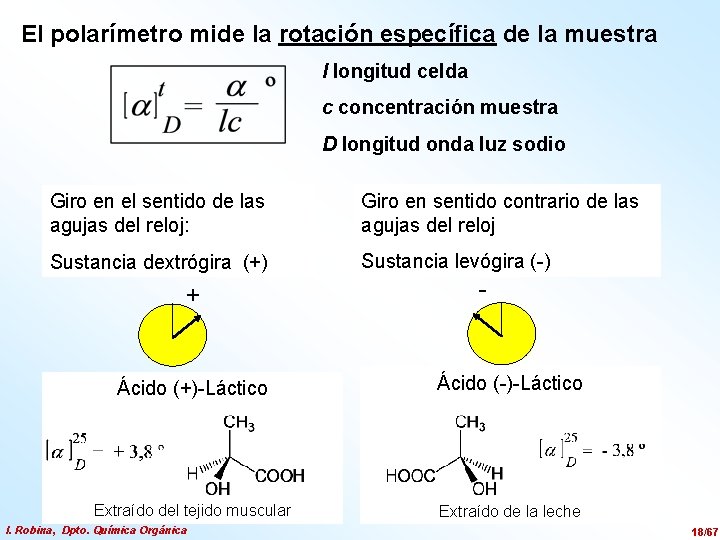
El polarímetro mide la rotación específica de la muestra l longitud celda c concentración muestra D longitud onda luz sodio Giro en el sentido de las agujas del reloj: Giro en sentido contrario de las agujas del reloj Sustancia dextrógira (+) Sustancia levógira (-) + - Ácido (+)-Láctico Ácido (-)-Láctico Extraído del tejido muscular Extraído de la leche I. Robina, Dpto. Química Orgánica 18/67

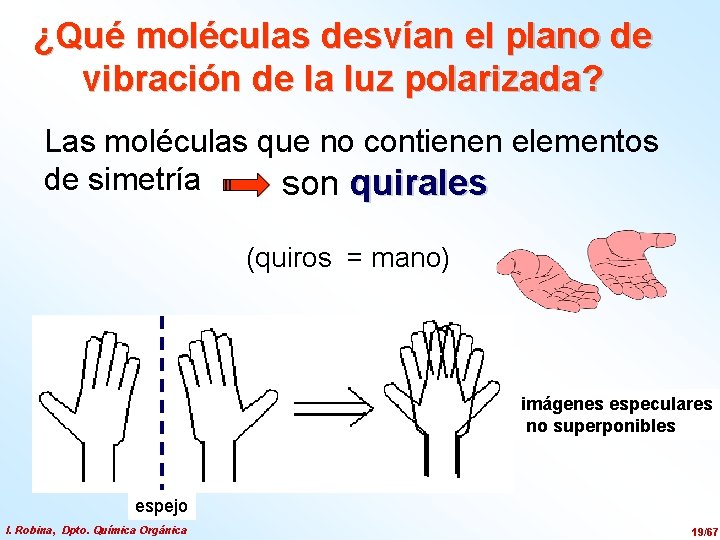
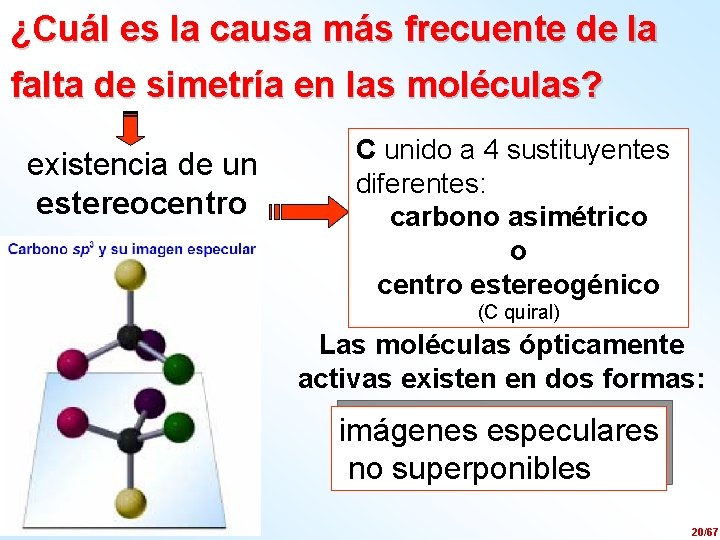
¿Qué moléculas desvían el plano de vibración de la luz polarizada? Las moléculas que no contienen elementos de simetría son quirales (quiros = mano) imágenes especulares no superponibles espejo I. Robina, Dpto. Química Orgánica 19/67

¿Cuál es la causa más frecuente de la falta de simetría en las moléculas? existencia de un estereocentro C unido a 4 sustituyentes diferentes: carbono asimétrico o centro estereogénico (C quiral) Las moléculas ópticamente activas existen en dos formas: imágenes especulares no superponibles I. Robina, Dpto. Química Orgánica 20/67

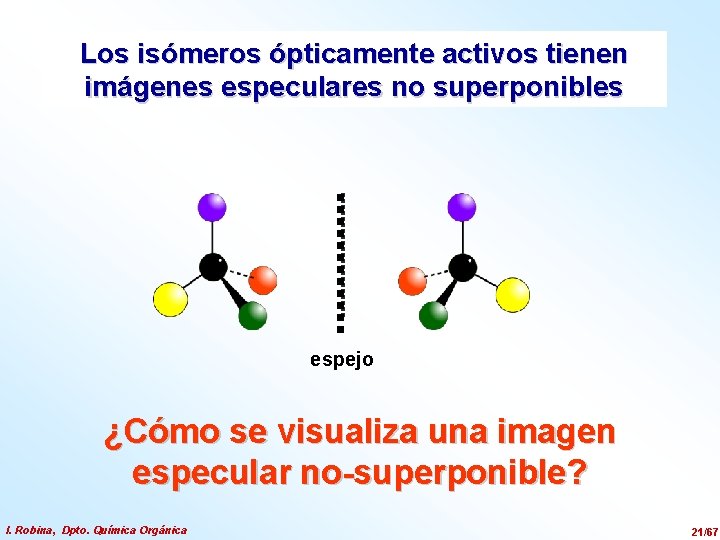
Los isómeros ópticamente activos tienen imágenes especulares no superponibles espejo ¿Cómo se visualiza una imagen especular no-superponible? I. Robina, Dpto. Química Orgánica 21/67

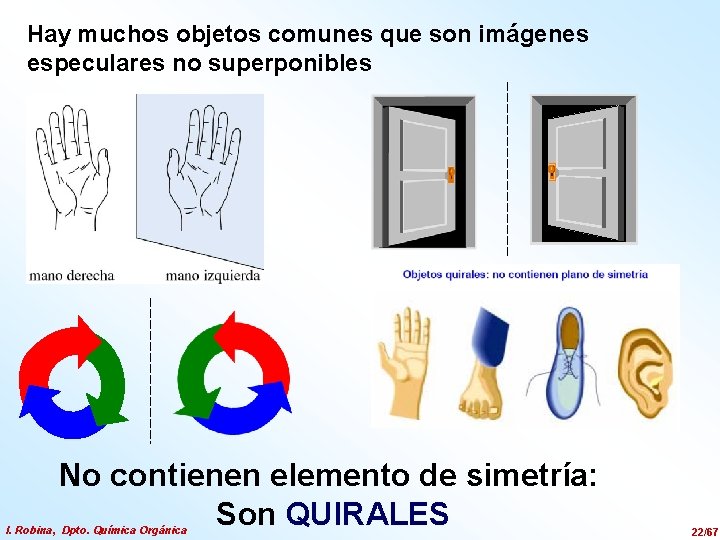
Hay muchos objetos comunes que son imágenes especulares no superponibles No contienen elemento de simetría: Son QUIRALES I. Robina, Dpto. Química Orgánica 22/67

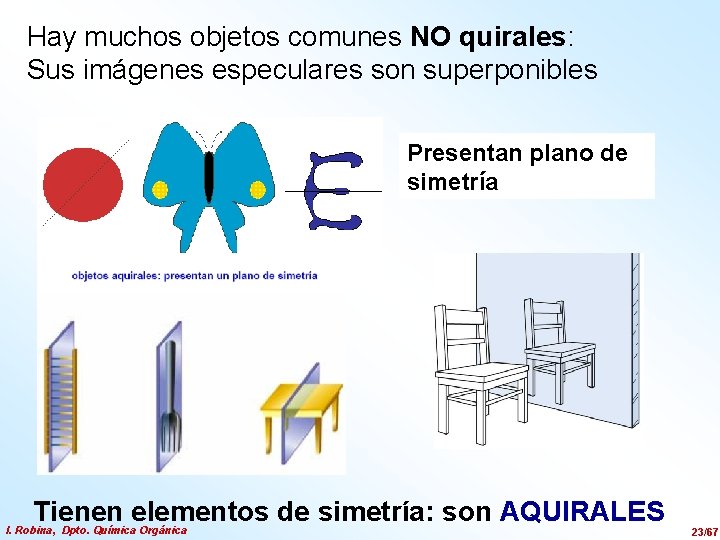
Hay muchos objetos comunes NO quirales: Sus imágenes especulares son superponibles Presentan plano de simetría Tienen elementos de simetría: son AQUIRALES I. Robina, Dpto. Química Orgánica 23/67

QUIRALIDAD Es una propiedad según la cual una molécula no es superponible con su imagen especular. La quiralidad está asociada con la actividad óptica Es una propiedad importante en la naturaleza ya que la mayoría de los compuestos biológicos son quirales I. Robina, Dpto. Química Orgánica 24/67

Moléculas Quirales en nuestro entorno Forman un grupo amplio de compuestos que forman parte de la materia viva, responsable de la mayoría de los fenómenos vitales • Glucosa, sacarosa y todos los carbohidratos • Los aminoácidos • Proteínas • ADN y ARN También son quirales: • La mayoría de los fármacos • Sustancias con determinados olores y sabores • etc… I. Robina, Dpto. Química Orgánica 25/67

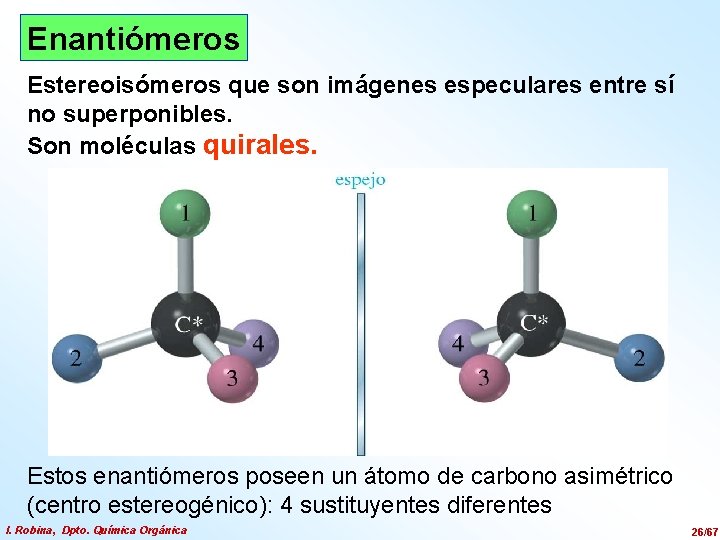
Enantiómeros Estereoisómeros que son imágenes especulares entre sí no superponibles. Son moléculas quirales. Estos enantiómeros poseen un átomo de carbono asimétrico (centro estereogénico): 4 sustituyentes diferentes I. Robina, Dpto. Química Orgánica 26/67

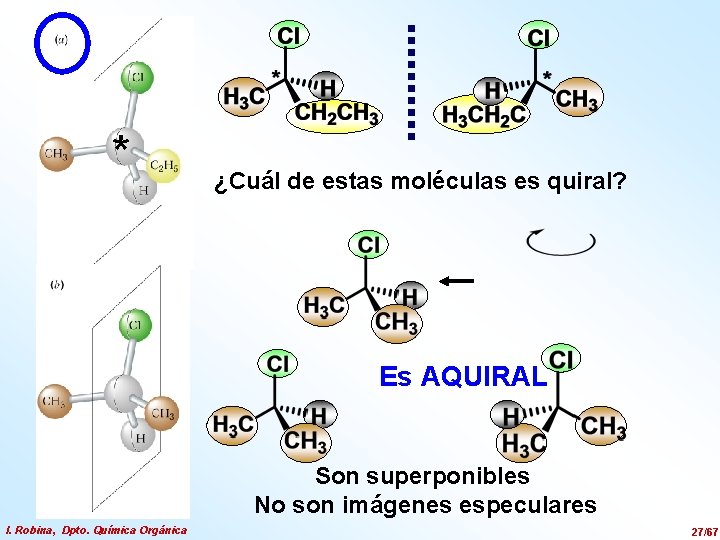
* ¿Cuál de estas moléculas es quiral? Es AQUIRAL Son superponibles No son imágenes especulares I. Robina, Dpto. Química Orgánica 27/67

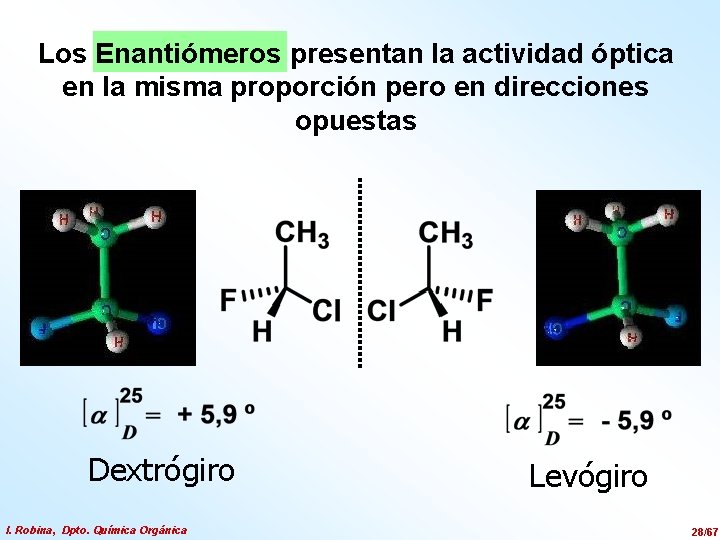
Los Enantiómeros presentan la actividad óptica en la misma proporción pero en direcciones opuestas Dextrógiro I. Robina, Dpto. Química Orgánica Levógiro 28/67

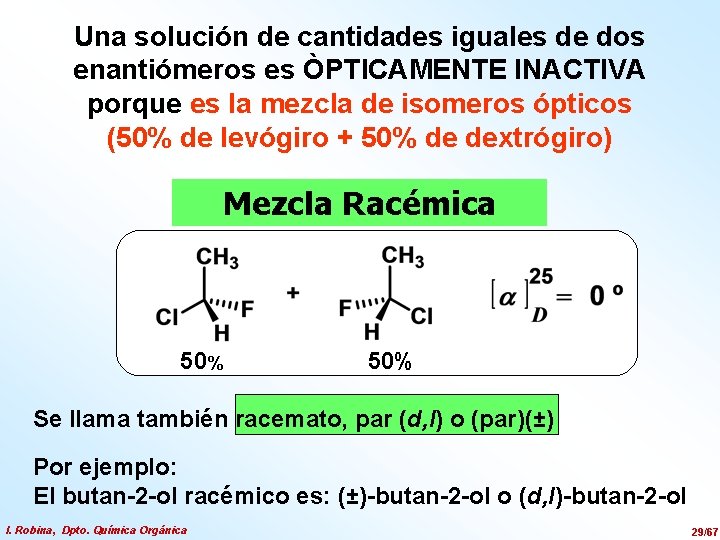
Una solución de cantidades iguales de dos enantiómeros es ÒPTICAMENTE INACTIVA porque es la mezcla de isomeros ópticos (50% de levógiro + 50% de dextrógiro) Mezcla Racémica 50% Se llama también racemato, par (d, l) o (par)(±) Por ejemplo: El butan-2 -ol racémico es: (±)-butan-2 -ol o (d, l)-butan-2 -ol I. Robina, Dpto. Química Orgánica 29/67

Propiedades de los enantiómeros: QUÍMICAS: iguales (reactividad) FÍSICAS: iguales menos la rotación específica. La rotación específica es la única propiedad física que diferencia a una par de enantiómeros. Aunque pueden tener acciones muy diferentes!! I. Robina, Dpto. Química Orgánica 30/67

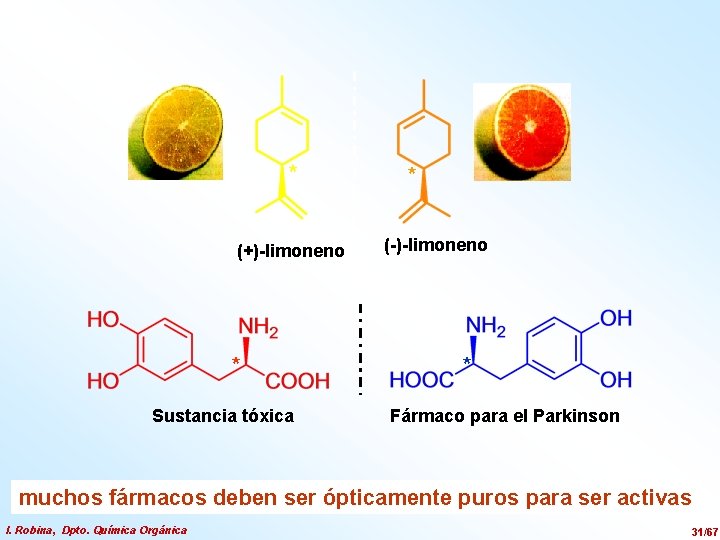
* (+)-limoneno * Sustancia tóxica * (-)-limoneno * Fármaco para el Parkinson muchos fármacos deben ser ópticamente puros para ser activas I. Robina, Dpto. Química Orgánica 31/67

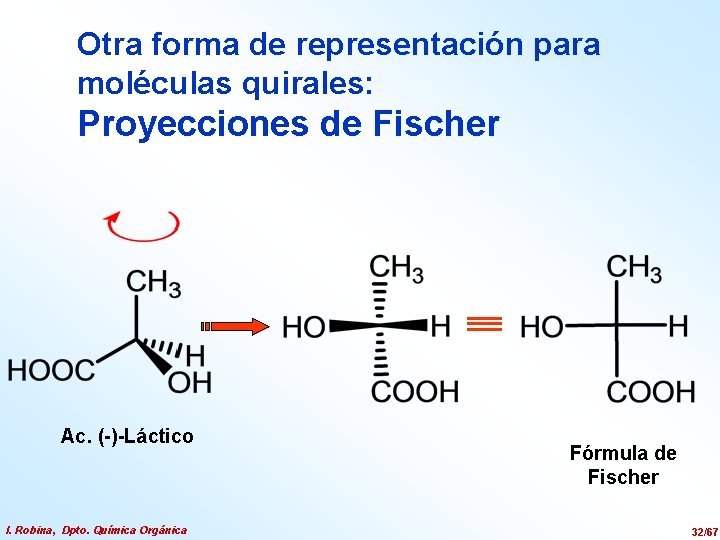
Otra forma de representación para moléculas quirales: Proyecciones de Fischer Ac. (-)-Láctico I. Robina, Dpto. Química Orgánica Fórmula de Fischer 32/67

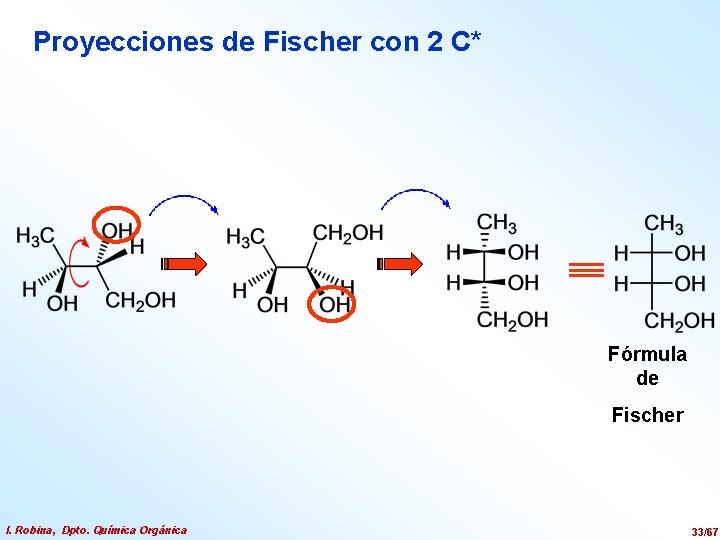
Proyecciones de Fischer con 2 C* Fórmula de Fischer I. Robina, Dpto. Química Orgánica 33/67

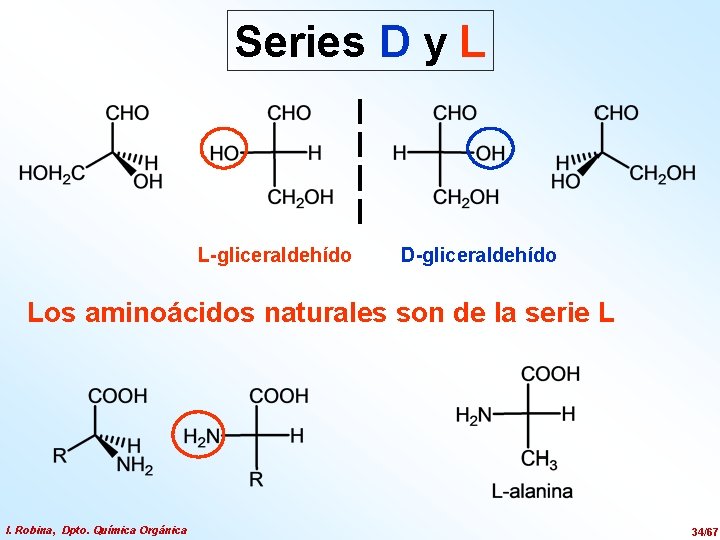
Series D y L L-gliceraldehído D-gliceraldehído Los aminoácidos naturales son de la serie L I. Robina, Dpto. Química Orgánica 34/67

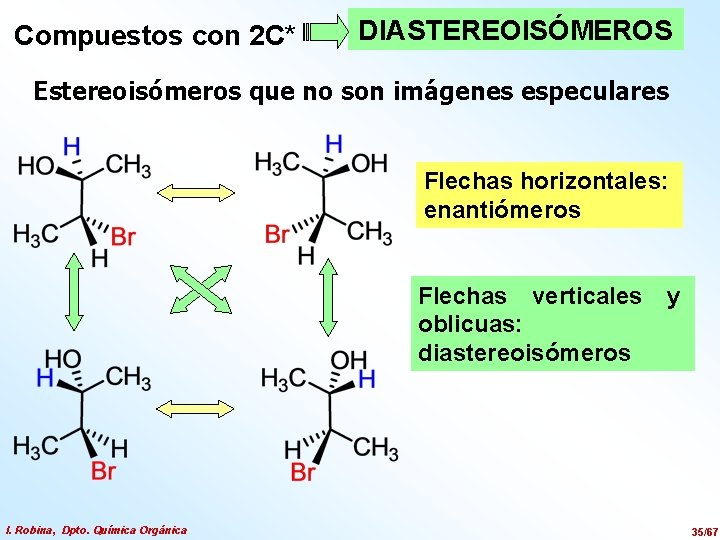
Compuestos con 2 C* DIASTEREOISÓMEROS Estereoisómeros que no son imágenes especulares Flechas horizontales: enantiómeros Flechas verticales oblicuas: diastereoisómeros I. Robina, Dpto. Química Orgánica y 35/67

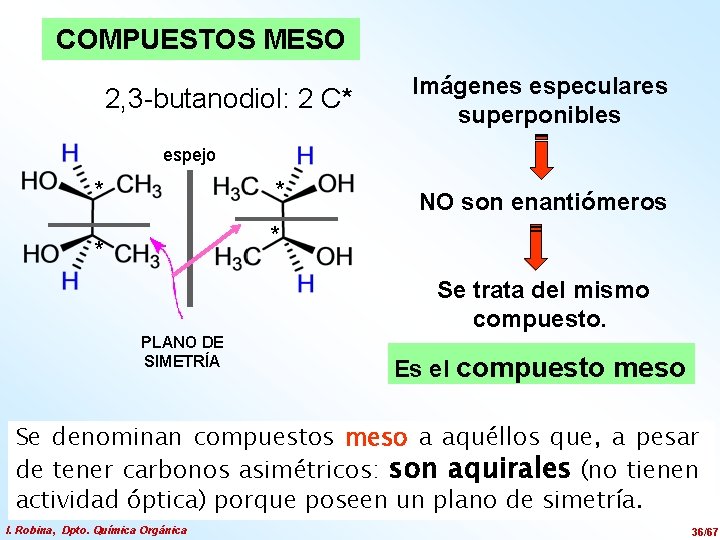
COMPUESTOS MESO 2, 3 -butanodiol: 2 C* Imágenes especulares superponibles espejo * * NO son enantiómeros * * Se trata del mismo compuesto. PLANO DE SIMETRÍA Es el compuesto meso Se denominan compuestos meso a aquéllos que, a pesar de tener carbonos asimétricos: son aquirales (no tienen actividad óptica) porque poseen un plano de simetría. I. Robina, Dpto. Química Orgánica 36/67

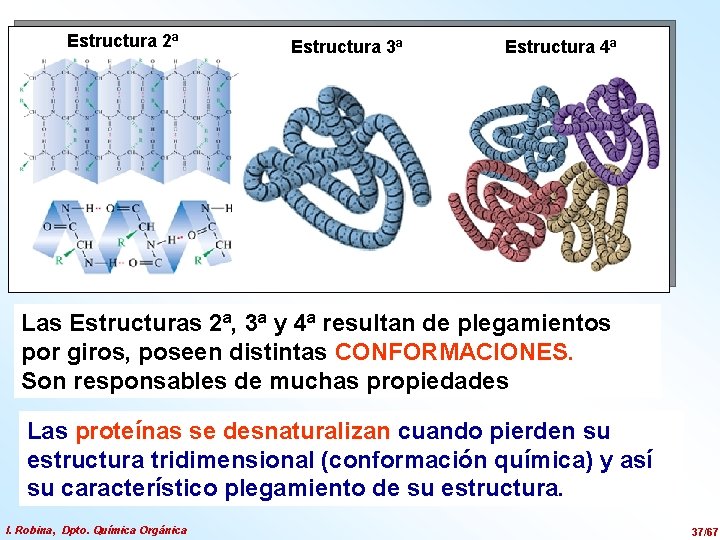
Estructura 2ª Estructura 3ª Estructura 4ª Las Estructuras 2ª, 3ª y 4ª resultan de plegamientos por giros, poseen distintas CONFORMACIONES. Son responsables de muchas propiedades Las proteínas se desnaturalizan cuando pierden su estructura tridimensional (conformación química) y así su característico plegamiento de su estructura. I. Robina, Dpto. Química Orgánica 37/67
 Las personas valen por lo que son y no por lo que tienen
Las personas valen por lo que son y no por lo que tienen Fenmeno
Fenmeno Isomera
Isomera Isomera
Isomera Diferencia entre transporte activo primario y secundario
Diferencia entre transporte activo primario y secundario Transporte activo primario y secundario
Transporte activo primario y secundario Que sustancias transporta el transporte activo
Que sustancias transporta el transporte activo Todas las mezclas son iguales
Todas las mezclas son iguales No dejar de congregarse como muchos
No dejar de congregarse como muchos Animales de cuerpo blando y alargado
Animales de cuerpo blando y alargado Diagrama de fases de sustancias puras
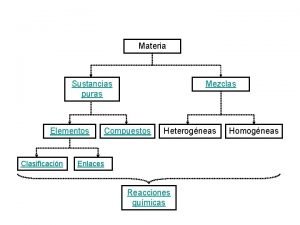
Diagrama de fases de sustancias puras Sustancias puras elementos y compuestos
Sustancias puras elementos y compuestos Ejemplos de sustancias homogéneas
Ejemplos de sustancias homogéneas Caracteristicas de los hidroxidos
Caracteristicas de los hidroxidos Sustancias nacivas
Sustancias nacivas Tres sustancias de descartes
Tres sustancias de descartes Molecula polar y apolar
Molecula polar y apolar No polar
No polar Mezclas y sustancias
Mezclas y sustancias Sustancias inertes
Sustancias inertes Tres sustancias de descartes
Tres sustancias de descartes Organizador grafico de sustancias puras y mezclas
Organizador grafico de sustancias puras y mezclas Tipos de mezclas
Tipos de mezclas Sustancias puras termodinamica
Sustancias puras termodinamica Numero 10 en circulo
Numero 10 en circulo Es la unión física de dos o más elementos o compuestos
Es la unión física de dos o más elementos o compuestos Sustancias puras
Sustancias puras Teoria de arrhenius
Teoria de arrhenius Clasificación de la materia
Clasificación de la materia Capacidad termica
Capacidad termica Sustancias puras
Sustancias puras Rotulado de sustancias quimicas
Rotulado de sustancias quimicas Cuales son las sustancias simples
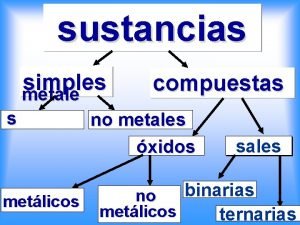
Cuales son las sustancias simples Consiste en la utilizacion de prefijos numerales grirgos
Consiste en la utilizacion de prefijos numerales grirgos Matriz de compatibilidad de sustancias químicas sura
Matriz de compatibilidad de sustancias químicas sura Sustancias reguladoras
Sustancias reguladoras Sustancias
Sustancias Anfótera
Anfótera