TEMA 5 SUSTANCIA PURAS Y MEZCLAS GUIN TEMA









- Slides: 15

TEMA 5 SUSTANCIA PURAS Y MEZCLAS

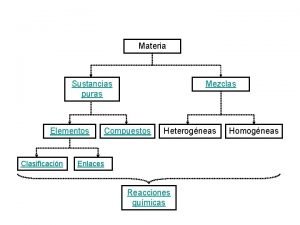
GUIÓN TEMA 5: SUSTANCIAS PURAS Y MEZCLAS 1. - SUSTANCIAS PURAS 1. 1. Definición 1. 2. Propiedades específicas 1. 3. Propiedades específicas del agua 2. - MEZCLAS 2. 1. Definición 2. 2. Componentes y propiedades 2. 3. Tipos 2. 3. 1. Mezclas heterogéneas - Definición - Ejemplos de mezclas en distintos estados - Suspensiones – Coloides - Definición - Componentes - Tipos y ejemplos 2. 3. 2. Mezclas homogéneas. Disoluciones - Definición - Componentes - Tipos. Ejemplos - Miscibilidad 2. 4. Separación de los componentes 2. 4. 1. De mezclas heterogéneas - Tamizado - Filtrado - Sedimentación y decantación - Centrifugación y decantación - Decantación de líquidos - Flotación - Lixiviación - Imantación 2. 4. 2. De mezclas homogéneas - Vaporización - Destilación - Cromatografía


1. - SUSTANCIAS PURAS • 1. 1. DEFINICIÓN. Formadas por un solo componente. Todas las sustancia puras son homogéneas , es decir, que todas sus partes comparten las mismas propiedades. Ejemplos: Agua, sal, aceite, hierro… • 1. 2. PROPIEDADES ESPECÍFICAS: Las sustancias puras poseen determinadas propiedades que son exclusivas de ellas y no comparten con ninguna otra sustancia. Estas son sus propiedades específicas: la densidad, el punto de fusión y el punto de ebullición Las propiedades específicas de las sustancias puras nos permiten identificarlas y separarlas cuando forman parte de una mezcla • 1. 3. PROPIEDADES ESPECÍFICAS DEL AGUA – DENSIDAD: 1000 Kg/m 3 – TEMPERATURA DE FUSIÓN : 0° – TEMPERATURA DE EBULLICIÓN 100°

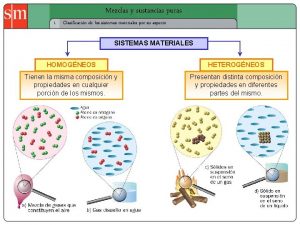
2. - MEZCLAS • 2. 1. DEFINICIÓN: Son aquellos materiales formados por la combinación física de dos o más sustancias puras. A estas sustancias se es llama componentes • 2. 2. COMPONENTES Y PROPIEDADES: Las mezclas no tienen propiedades específicas, si no que sus propiedades dependen de las proporciones de sus componentes (sustancias puras, que no pierden sus propiedades cuando se mezclan) • 2. 3 TIPOS


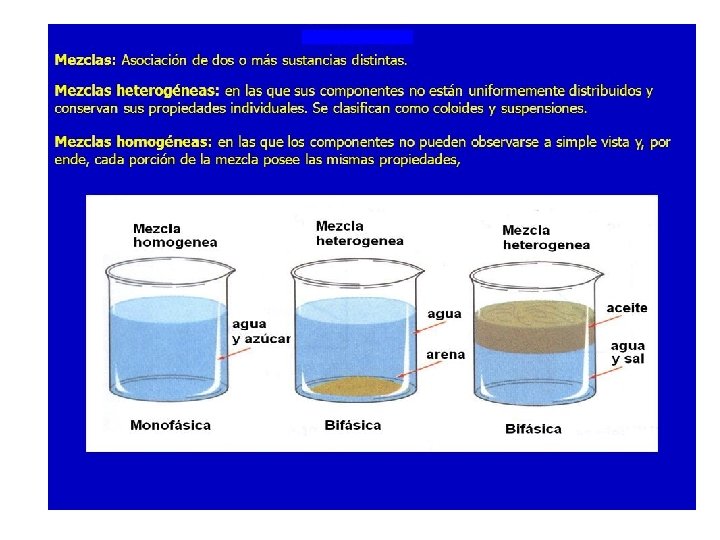
– 2. 3. 1. MEZCLAS HETEROGÉNEAS • DEFINICIÓN: Aquella en la que sus componentes se pueden diferenciar visualmente y se encuentran distribuidos de forma irregular, por lo que se pueden distinguir propiedades diferentes entre sus partes • EJEMPLOS DE MEZCLAS EN DISTINTOS ESTADOS - Hay mezclas heterogéneas en las que los componentes están en el mismo estado - Sólido: Granito, arena de la playa, ensalada, macedonia de frutas, el cubo de la basura - Líquido: Aceite y agua, miel y glicerina - Hay mezclas heterogéneas en las que los componentes están en distinto estados - Líquidos con gases: Refrescos con burbujas - Sólidos con líquidos: Sopa de fideos

• SUSPENSIONES Tipo de mezclas heterogéneas en las que pequeñas partículas sólidas se encuentran suspendidas en un líquido durante un tiempo, para al final desplazarse hacia la superficie o el fondo del líquido, según su densidad relativa. A simple vista tienen apariencia homogénea

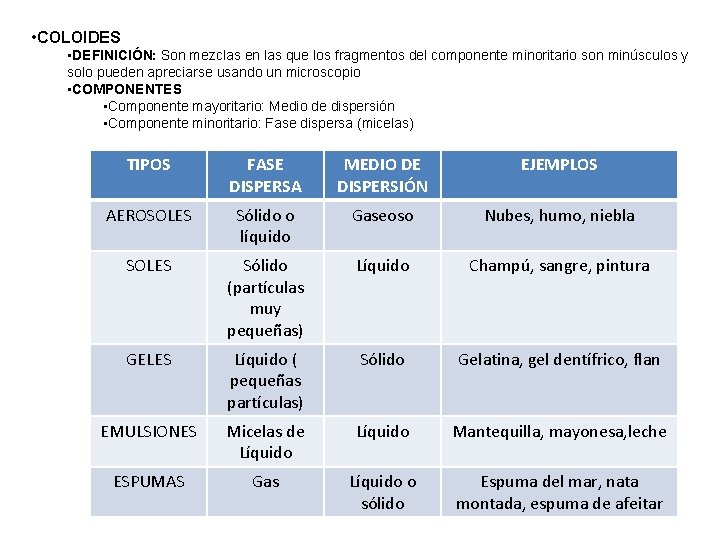
• COLOIDES • DEFINICIÓN: Son mezclas en las que los fragmentos del componente minoritario son minúsculos y solo pueden apreciarse usando un microscopio • COMPONENTES • Componente mayoritario: Medio de dispersión • Componente minoritario: Fase dispersa (micelas) TIPOS FASE DISPERSA MEDIO DE DISPERSIÓN EJEMPLOS AEROSOLES Sólido o líquido Gaseoso Nubes, humo, niebla SOLES Sólido (partículas muy pequeñas) Líquido Champú, sangre, pintura GELES Líquido ( pequeñas partículas) Sólido Gelatina, gel dentífrico, flan EMULSIONES Micelas de Líquido Mantequilla, mayonesa, leche ESPUMAS Gas Líquido o sólido Espuma del mar, nata montada, espuma de afeitar


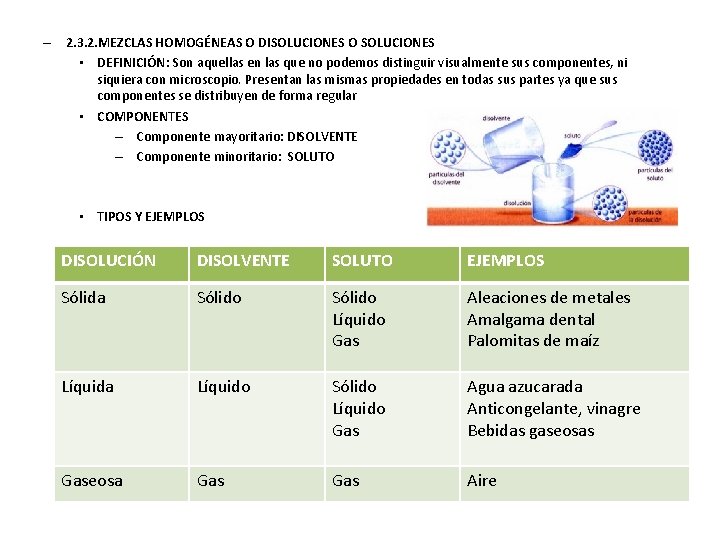
– 2. 3. 2. MEZCLAS HOMOGÉNEAS O DISOLUCIONES O SOLUCIONES • DEFINICIÓN: Son aquellas en las que no podemos distinguir visualmente sus componentes, ni siquiera con microscopio. Presentan las mismas propiedades en todas sus partes ya que sus componentes se distribuyen de forma regular • COMPONENTES – Componente mayoritario: DISOLVENTE – Componente minoritario: SOLUTO • TIPOS Y EJEMPLOS DISOLUCIÓN DISOLVENTE SOLUTO EJEMPLOS Sólida Sólido Líquido Gas Aleaciones de metales Amalgama dental Palomitas de maíz Líquida Líquido Sólido Líquido Gas Agua azucarada Anticongelante, vinagre Bebidas gaseosas Gaseosa Gas Aire

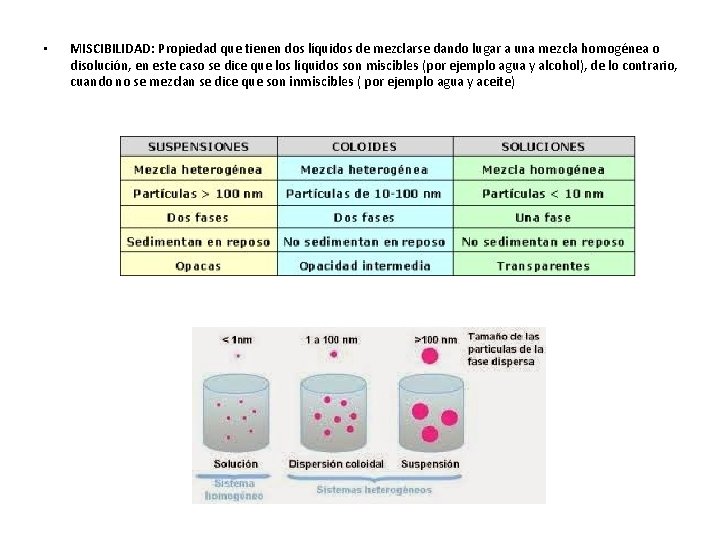
• MISCIBILIDAD: Propiedad que tienen dos líquidos de mezclarse dando lugar a una mezcla homogénea o disolución, en este caso se dice que los líquidos son miscibles (por ejemplo agua y alcohol), de lo contrario, cuando no se mezclan se dice que son inmiscibles ( por ejemplo agua y aceite)

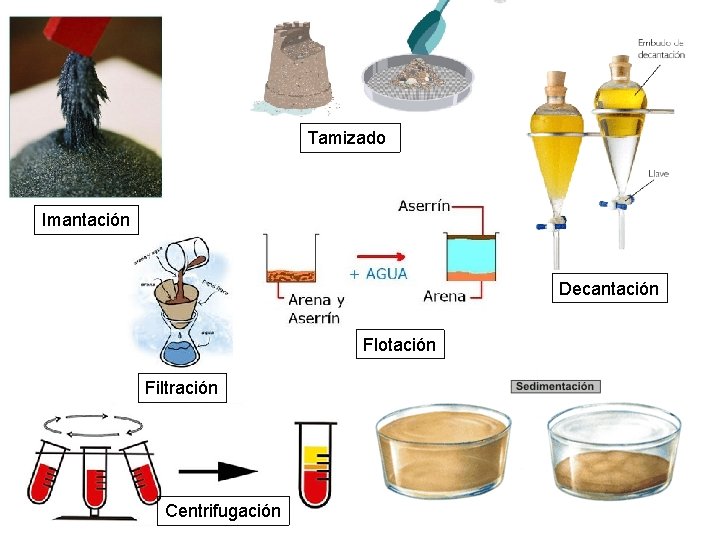
– 2. 4. SEPARACIÓN DE LOS COMPONENTES • 2. 4. 1. DE MEZCLAS HETEROGENEAS – TAMIZADO: Para separar sólidos con fragmentos de distintos tamaños. Utiliza un tamiz – FILTRADO: Para separar sólidos suspendidos en líquidos, siempre que los fragmentos sólidos sean mayores que los poros del filtro – SEDIMENTACIÓN Y DECANTACIÓN: Para separar sólidos suspendidos en líquidos. Se basa en la diferencia de densidades. Es necesario dejar reposar la suspensión hasta que se diferencien bien las dos fases, la sólida y la líquida – CENTRIFUGACIÓN Y DECANTACIÓN: Para separar los componentes de una suspensión o de un coloide líquido. Se basa en la diferencia de densidades. Utiliza una máquina centrífuga que acelera la separación – DECANTACIÓN DE LÍQUIDOS: Separa líquidos de distinta densidad. Utiliza un embudo de decantación – FLOTACIÓN: Para separar sólidos con fragmentos de tamaño similar pero de distinta densidad. Es necesario que uno de los componentes tenga una densidad menor que la del agua, para que al ponerlos en agua, flote mientras los demás se hunden – LIXIVIACIÓN: Para separar sólidos con fragmentos de tamaños similares pero distinta solubilidad en un líquido. Al mezclarlos con este líquido, uno se disolverá y los otros no – IMANTACIÓN: Para separar sólidos , cuando alguno de ellos tiene propiedades magnéticas. Utiliza un imán

Tamizado Imantación Decantación Flotación Filtración Centrifugación

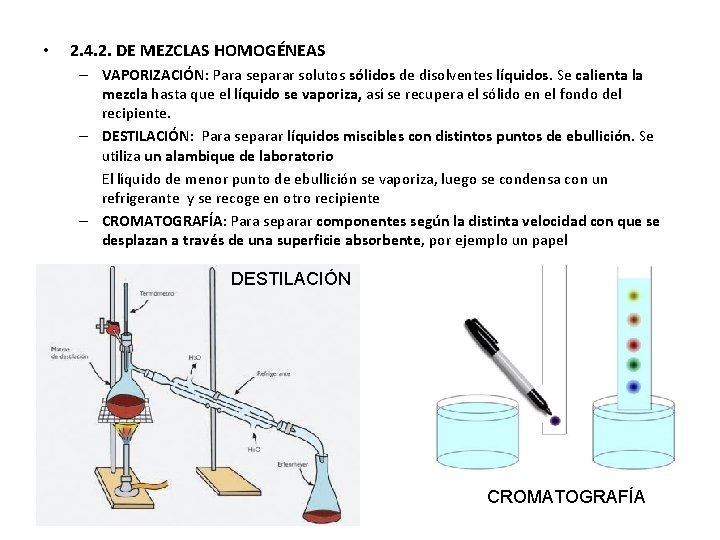
• 2. 4. 2. DE MEZCLAS HOMOGÉNEAS – VAPORIZACIÓN: Para separar solutos sólidos de disolventes líquidos. Se calienta la mezcla hasta que el líquido se vaporiza, así se recupera el sólido en el fondo del recipiente. – DESTILACIÓN: Para separar líquidos miscibles con distintos puntos de ebullición. Se utiliza un alambique de laboratorio El líquido de menor punto de ebullición se vaporiza, luego se condensa con un refrigerante y se recoge en otro recipiente – CROMATOGRAFÍA: Para separar componentes según la distinta velocidad con que se desplazan a través de una superficie absorbente, por ejemplo un papel DESTILACIÓN CROMATOGRAFÍA
 Sustancia
Sustancia Organizador grafico de sustancias puras y mezclas
Organizador grafico de sustancias puras y mezclas Metodos de separacion de mezclas homogeneas
Metodos de separacion de mezclas homogeneas Sustancia del cobre
Sustancia del cobre The wife's story quiz
The wife's story quiz El guin
El guin El guin
El guin A wifes story
A wifes story Ejemplos de conclusiones de un proyecto
Ejemplos de conclusiones de un proyecto Que es aferente y eferente
Que es aferente y eferente Sustancia de dios
Sustancia de dios Region saturada liquido vapor
Region saturada liquido vapor Tipo de mezcla de la mayonesa
Tipo de mezcla de la mayonesa Huesos largos
Huesos largos El lubricante es una sustancia pura
El lubricante es una sustancia pura Es una sustancia blanda untuosa de color negro brillante
Es una sustancia blanda untuosa de color negro brillante