PROPIEDADES COLIGATIVAS DE LAS SOLUCIONES 2 do Medio












![• n=m • PM • n Na. Cl = 60 [gr] • 58, • n=m • PM • n Na. Cl = 60 [gr] • 58,](https://slidetodoc.com/presentation_image_h2/6ec319a0fd1066a0393009f5dbec6f02/image-15.jpg)







- Slides: 22

PROPIEDADES COLIGATIVAS DE LAS SOLUCIONES 2 do Medio Profesora: Paula Céspedes D.

Objetivo • Explicar las propiedades coligativas de las disoluciones químicas. Colegio San Nicolás - Canal Chacao 2

• La concentración de las disoluciones pueden afectar sus propiedades físicas, por ejemplo, su densidad, conductividad eléctrica, viscosidad, color, entre otras. Estos cambios dependen no solo de la concentración, sino también de cuál sea la especie disuelta. Sin embargo, cuando las propiedades físicas de las disoluciones dependen exclusivamente de la concentración y no de la naturaleza del soluto disuelto, se les denomina propiedades coligativas. Colegio San Nicolás - Canal Chacao 3

• Coligativo es una palabra que proviene del latín colligatus y significa “unidos, en conjunto”; con esto resalta que las propiedades coligativas dependen del efecto colectivo del número de partículas de soluto y no de su naturaleza. Colegio San Nicolás - Canal Chacao 4

Colegio San Nicolás - Canal Chacao 5

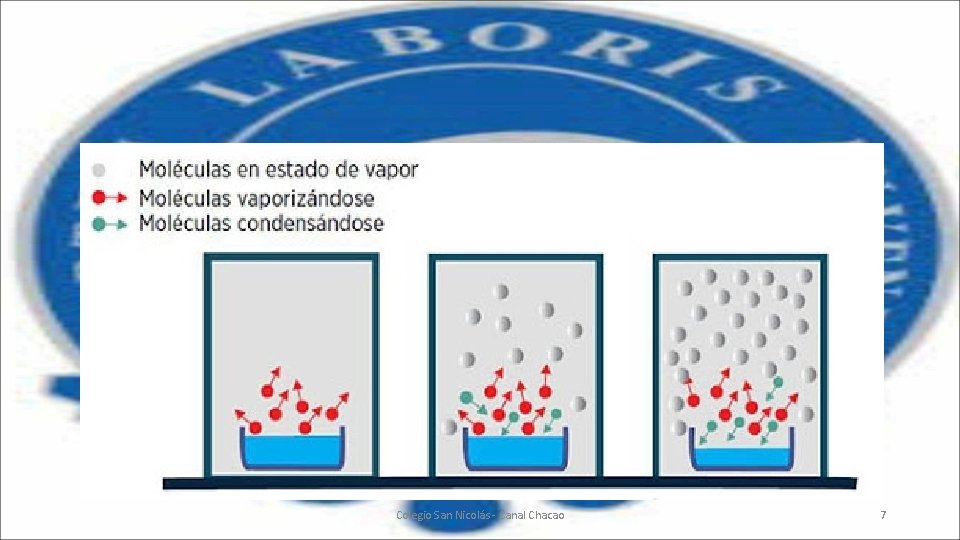
Disminución de la presión de vapor o Ley de Raoult • En 1. 882, el químico francés Fancois Marie Raoult realizó numerosos experimentos en los que estableció en la determinación de pesos moleculares de diferentes solventes, que el descenso relativo de la presión de vapor la acción de un soluto no volátil era proporcional a la concentración del soluto. • Entendiendo por Presión de vapor a la presión que ejerce la fase gaseosa o vapor sobre la fase líquida en un sistema cerrado a una temperatura determinada, en la que la fase líquida y el vapor se encuentran en equilibrio dinámico. Colegio San Nicolás - Canal Chacao 6

Colegio San Nicolás - Canal Chacao 7

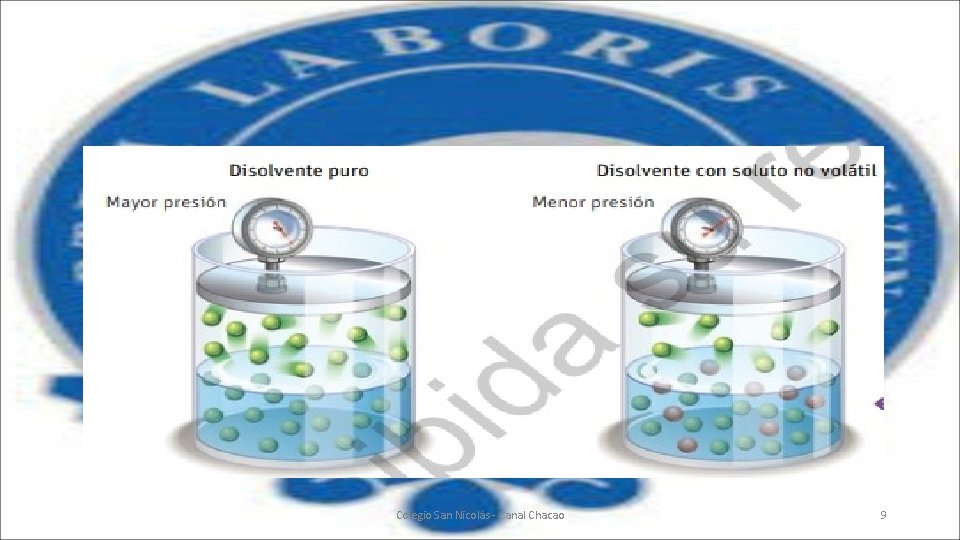
• Cuando añadimos a un solvente o disolvente un soluto no volátil obtendremos una solución o disolución; en ese caso a las moléculas del solvente les será más difícil abandonar el centro de la disolución, por ende, la presión de vapor será menor, pues la cantidad de moléculas de disolvente en fase de vapor disponibles, será menor y ejercerán una menor presión, tal como se ve en la siguiente imagen: Colegio San Nicolás - Canal Chacao 8

Colegio San Nicolás - Canal Chacao 9

• El grado en que este soluto no volátil abate la presión de vapor es proporcional a su concentración. Esta relación se expresa en la Ley de Raoult, cuyo enunciado plantea que “la relación existente entre la presión de vapor de cada componente en una disolución ideal depende de la presión de vapor del componente y de su fracción molar en la solución”. Para poder determinar la presión parcial del componente se utiliza la siguiente fórmula: Colegio San Nicolás - Canal Chacao 10

• P A = P 0 A x XA • A = componente volátil • PA = presión parcial del componente A, se mide en [k. Pa], [mm. Hg], [atm], [torr]. • XA = fracción molar del componente A en la solución. Colegio San Nicolás - Canal Chacao 11

• Recordemos que la Fracción molar de un componente A (XA) es la relación entre el número de moles de ese componente (n. A) y el número total de moles que aportan todas las sustancias presentes en la disolución (n. T). Para una disolución formada por un disolvente A y un soluto B, n. T = n. A + n. B, entonces la fracción molar del disolvente se calcula como: • X A = n. A • n. T Colegio San Nicolás - Canal Chacao 12

EJEMPLO • 1. Calcular la presión de vapor de una solución elaborada disolviendo 60 [gr] de Cloruro de sodio (Na. Cl) en 400 [gr] de agua (H 2 O). La presión del vapor de agua (PH 2 OO) A 37 °C es 47, 1 [mm. Hg]. Peso molecular H 2 O = 18 [gr/mol] y peso molecular Na. Cl = 58, 5 [gr/mol]. • Pv = ¿? • m = 60 gr de Na. Cl • m = 400 gr de H 2 O • PH 2 O° = 47, 1 [mm. Hg] • PM H 2 O = 18 [gr/mol] PM Na. Cl = 58, 5 [gr/mol] Colegio San Nicolás - Canal Chacao 13

• Calcularemos primero los moles de agua y de cloruro de sodio para poder determinar las fracciones molares: • n=m • PM • n H 2 O = 400 [gr] • 18 [gr/mol] • n H 2 O = 22, 22 [mol] Colegio San Nicolás - Canal Chacao 14
![nm PM n Na Cl 60 gr 58 • n=m • PM • n Na. Cl = 60 [gr] • 58,](https://slidetodoc.com/presentation_image_h2/6ec319a0fd1066a0393009f5dbec6f02/image-15.jpg)
• n=m • PM • n Na. Cl = 60 [gr] • 58, 5 [gr/mol] • n Na. Cl = 1, 03 [mol] • Calculamos los moles de la solución: • n. T = n H 2 O + n Na. Cl • n. T = 22, 22 + 1, 03 n. T = 24, 28 [mol] Colegio San Nicolás - Canal Chacao 15

• Determinamos las Fracción Molar del H 2 O: • XH 2 O = n H 2 O • n. T • X H 2 O = 22, 22 • 24, 28 • XH 2 O = 0, 92 Colegio San Nicolás - Canal Chacao 16

• Ahora puedo calcular la Presión de vapor de la Solución: • Pv = P° H 2 O x X H 2 O • Pv = 47, 1 [mm. Hg] x 0, 92 • Pv = 43, 33 [mm. Hg] • Siendo el descenso de la presión de vapor la presencia de cloruro de sodio. • ΔPv = 47, 1 [mm. Hg] - 43, 33 [mm. Hg] • ΔPv = 3, 77 [mm. Hg] Colegio San Nicolás - Canal Chacao 17

EJEMPLO • 2. A una temperatura de -100 °C el etano (CH 3) y el propano (CH 3 CH 2 CH 3) son líquidos. A esa temperatura, la presión del vapor del etano puro (P etano°) es de 394 [mm. Hg], mientras que la presión de vapor del propano puro (P propano °) es de 22 [mm. Hg]. ¿Cuál será la presión de vapor sobre una solución que contiene cantidades equimolares de ambos compuestos: • Al decir que contiene cantidades equimolares de los compuestos. Esto implica que la fracción molar de los compuestos etano y propano es forzosamente igual a 0, 5. Colegio San Nicolás - Canal Chacao 18

• Calculamos las presiones parciales tanto del etano como el propano: • P etano = P etano ° x X etano • P etano = 394 [mm. Hg] x 0, 5 • P etano = 197 [mm. Hg] • Ppropano = P propano ° x X propano • P propano = 22 [mm. Hg] x 0, 5 • P propano = 11 [mm. Hg] Colegio San Nicolás - Canal Chacao 19

• Ahora podemos calcular la Presión de vapor de la solución: • Pv = P etano + P propano • Pv = 197 [mm. Hg] + 11 [mm. Hg] • Pv = 208 [mm. Hg] Colegio San Nicolás - Canal Chacao 20

EJERCICIOS • 1. A 40 °C, la presión de vapor del heptano puro es de 92, 0 [torr] y la presión de vapor del octano puro es de 31, 0 [torr]. Considera una disolución que contiene 1, 00 [mol] de heptano y 4, 00 [moles] de octano. Calcule la presión de vapor de cada componente y la presión de vapor total sobre la disolución. (respuestas: Xn heptano: 0, 20; Xn octano: 0, 80; P heptano: 18, 4 [torr]; P octano: 24, 8 [torr]; P total: 43, 2 [torr]. Colegio San Nicolás - Canal Chacao 21

• 2. Hallar la presión de vapor de una disolución que contiene 4, 32 [gr] de anilina (C 6 H 5 NH 2), en 100 [gr] de éter (C 4 H 10 O), si a 20° C la presión del éter es igual a 440, 0 [mm. Hg]. (respuesta: moles de anilina: 0, 047; moles de éter: 1, 35; Xn éter: 0, 97; Xn anilina: 0, 03; P vapor de la solución: 426, 8 [mm. Hg]). Colegio San Nicolás - Canal Chacao 22
 Propiedades coligativas
Propiedades coligativas Objetivo de la clase
Objetivo de la clase Propiedades coligativas de soluciones electroliticas
Propiedades coligativas de soluciones electroliticas Soluciones amortiguadoras
Soluciones amortiguadoras Propiedades de las soluciones
Propiedades de las soluciones Solidificação
Solidificação Propiedades coligativas
Propiedades coligativas Curvas de solubilidad
Curvas de solubilidad Area de superficie corporal adultos
Area de superficie corporal adultos Tonoscopia
Tonoscopia Efeitos coligativos
Efeitos coligativos Medio informatico
Medio informatico Sustancia puras elementos
Sustancia puras elementos Potencia y fracciones
Potencia y fracciones Propiedades de las sumatorias
Propiedades de las sumatorias Las propiedades visuales de la forma
Las propiedades visuales de la forma Propiedad de la luz reflexión
Propiedad de la luz reflexión Variables que afectan el comportamiento de los gases
Variables que afectan el comportamiento de los gases Modelo de bohr de hidrogeno
Modelo de bohr de hidrogeno Valor absoluto propiedades
Valor absoluto propiedades Recta numerica
Recta numerica Cuales son las propiedades de los materiales
Cuales son las propiedades de los materiales Que son las propiedades sensoriales de los materiales
Que son las propiedades sensoriales de los materiales