NTE MADDENN YAPISINA YOLCULUK MADDELERN SINIFLANDIRILMASI VE DNMLER















































- Slides: 49

ÜNİTE : MADDENİN İÇ YAPISINA YOLCULUK MADDELERİN SINIFLANDIRILMASI VE DÖNÜŞÜMLERİ ÇÖZELTİLER VE ÇÖZÜNÜRLÜK ATOMUN YAPISI VE PERİYODİK ÇİZELGE Hazırlayan : 7/D Sınıfı Sincaplar Grubundan Bahadır ÇALIŞKAN

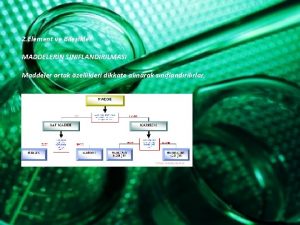
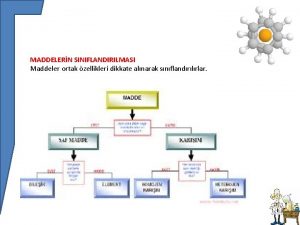
MADDENİN TANIMI VE SINIFLANDIRILMASI MADDE TANIMI Kütlesi, hacmi ve eylemsizliği olan bütün varlıklar maddedir. Çevremizde gördüğümüz hava, su, toprak, masa her şey maddedir. MADDENİN SINIFLANDIRILMASI a) Elementler b) Bileşikler c) Karışımlar

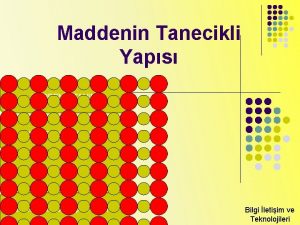
MADDENİN KATI, SIVI VE GAZ OLARAK SINIFLANDIRILMASI MADDENİN HALLERİ Maddenin katı, sıvı ve gaz olmak üzere üç hâli vardır. Genel olarak madde ya katı ya sıvı ya da gaz hâlinde bulunur. İstenildiğinde ortam şartları elverişli hâle getirilerek bir hâlden diğerine dönüştürülebilir.

MADDENİN KATI H Lİ n Belirli bir şekle ve hacime sahiptir. n Katı maddeyi oluşturan atom ve moleküller birbirine çok yakındır. n Aralarındaki boşluklar çok azdır. Atom ve moleküller arasında bir düzenlilik vardır. n

MADDENİN SIVI H Lİ Belirli bir şekile sahip değildir. Sıvılar akışkan olduklarından bulundukları kabın şeklini alır. Sıvı hâlde atom veya moleküller katılardan daha düzensiz olup tanecikler arası boşluklar katılardan daha fazladır.

MADDENİN GAZ H Lİ n Atom veya molekülleri arasında boşlukların çok olduğu durumdur. n Gaz tanecikleri düzensiz olarak hareket ederler. n Bu hareketleri sırasında gaz molekülleri birbiri ile homojen olarak karışabilirler. n Bunların yayılmaları hissedilebilir veya gözle takip edilebilir. n Bir odaya damlatılan bir kolonyanın kokusu kısa sürede hissedilirken, bir sigara dumanının yayılması da gözle takip edilebilir. n Gazların belirli bir şekil ve hacimleri yoktur. Konuldukları kabı dolduracak şekilde genleşerek kabın şeklini ve hacmini alırlar.

Süblimleşme n n Katı haldeki bir maddenin gaz fazına geçme olayı süblimleşme olarak adlandırılır. Naftalin ve iyot süblimleşen maddelere örnek verilebilir.

MADDENİN ORTAK VE AYIRT EDİCİ ÖZELLİKLERİ n Maddenin n Ortak Özellikleri Kütle Hacim Eylemsizlik

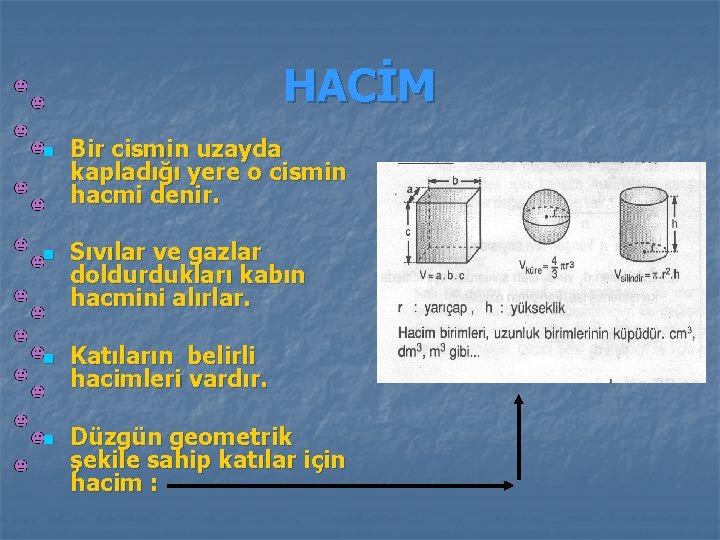
HACİM n n Bir cismin uzayda kapladığı yere o cismin hacmi denir. Sıvılar ve gazlar doldurdukları kabın hacmini alırlar. Katıların belirli hacimleri vardır. Düzgün geometrik şekile sahip katılar için hacim :

KÜTLE n Kütle , bir cismin içerdiği madde miktarının ölçüsüdür. n Sıcaklık ve bulunulan yere göre değişmez. n Eşit kollu terazi ile ölçülür. n Birimi g-kütle veya kg-kütle dir.

AĞIRLIK n n n n Bir gezegenin cisimlere uyguladığı kuvvete ağırlık denir. Çekim kuvvetinin olmadığı yerde ağırlık yoktur. G ile gösterilir. Dünyada 60 N ağırlığındaki bir adam Ayda, yerçekimi ivmesi 6 kat daha küçük olduğu için, 10 N ağırlığındadır. Birimi Newton dur. G=m. g Ağırlık= Kütle X Yerçekimi ivmesi

MADDENİN AYIRT EDİCİ ÖZELLİKLERİ n Öz kütle n Erime ve kaynama noktası n Çözünürlük n Sıcaklıkla genleşme n Esneklik n İletkenlik

ÖZ KÜTLE n Maddelerin 1 cm 3 ünün gram cinsinden ağırlığına öz kütle denir.

YALNIZ ÖZ KÜTLESİ BİLİNEN BİR MADDENİN HANGİ MADDE OLDUĞU ANLAŞILABİLİR Mİ? n Nikelin öz kütlesi 8, 9 g/cm 3’tür. Acaba öz kütlesi 8, 9 g/cm 3 olan bir madde nikel midir? Öz kütle demir 7, 86 g/cm 3 ve gümüş 10, 5 g/cm 3 ’tür. n Belli bir oran da demir ve gümüşten karıştırarak öz kütlesi 8, 9 g/cm 3 olan alaşım hazırlanabilir. n Bu durumda öz kütleleri 8, 9 g/cm 3 olan madde nikel de olabilir, demir – gümüş alaşımı da olabilir. n Demek ki, öz kütle yalnız başına tam anlamıyla ayırt edici olma özelliği göstermeyebiliyor.

ERİME VE KAYNAMA NOKTASI n n Katı maddelerin ısıtıldığında sıvı hale geçtiği sıcaklık erime noktası, sıvı maddelerin gaz haline geçtiği sıcaklık kaynama noktasıdır. Kaynama noktasında sıvının buhar basıncı açık hava basıncına eşittir.

ERİME VE KAYNAMA NOKTASINA ETKİ EDEN FAKTÖRLER n n n Basınç : saf su 1 atm basınç altında 100 C’ de kaynamaktadır. Ortamın basıncı düşerse kaynama noktası da düşer. Safsızlık : içerisinde çözünmüş madde bulunduran çözeltiler saf maddeye göre daha yüksek sıcaklıkta kaynar.

ÇÖZÜNÜRLÜK n n Sabit bir sıcaklıkta 100 gram suda çözünebilen maksimum madde miktarına o maddenin o sıcaklığındaki çözünürlüğü denir. Çözünürlük, çözücü ve çözünenin cinsine, basınç ve sıcaklığa bağlıdır.

SICAKLIKLA GENLEŞME n Genleşme, ısıtılan cisimlerin boyunda, yüzeyinde veya hacmindeki değişmedir. n Genleşme katı ve sıvılar için ayıt edici bir özelliktir. n Sıcaklığın artmasıyla maddelerdeki hacimce genleşme miktarı sıvılarda katılardan fazla, gazlarda da sıvılardan fazladır.

ESNEKLİK n Esneklik, yalnız katılar için ayırt edici bir özelliktir. n Sıvı ve gazların esneme özelliği yoktur. n n n Katı maddelerin biçim değiştirmeksizin etkisinde kalacağı en yüksek gerilme değeri esneklik sınırıdır. Bu değer geçildiğinde katı maddede eski haline döndürülemeyecek değişiklikler gözlenir. Esneklik sınırı aşıldığında binaların göçmesi gibi.

İLETKENLİK n n İletkenlik, üzerinden geçen elektrik akımına karşı maddelerin gösterdiği kolaylıktır. Madde elektrik akımına karşı ne kadar az direnç gösterirse o kadar iyi iletkendir.

MADDENİN SINIFLANDIRILMASI n n - ELEMENTLER Ve Özellikleri - Metallerin Özellikleri - Ametallerin Özellikleri - Soy Gazların Özellikleri

ELEMENTLER VE ÖZELLİKLERİ Bazı elementlerin sembolleri n n n n Sembolü Adı H Hidrojen O Oksijen N Azot Aynı cins atomlardan Na meydana gelen saf maddelere C element denir. Au Günümüzde 110 çeşit element Fe bilinmektedir. Cl En küçük yapı taşları atomdur. Kimyasal ve fiziksel yollarla ayrıştırılamazlar. Erime ve kaynama noktaları sabittir. Homojendirler. Sembollerle gösterilir. Sodyum Karbon Altın Demir Klor He Helyum Cu Bakır S Kükürt U Uranyum Si Silisyum K Potasyum Hg Civa Ar Argon Kr Kripton Pb Kurşun

Metallerin Özellikleri Alüminyum (Al) Bazı metallerin isimleri ve sembolleri n Çinko (Zn)iletirler. Gümüş Isı ve elektrik akımını Adı (Ag) Oda sıcaklığında katıdır. ( Hg hariç). Sodyum U Uranyum Altın Yüzeyleri parlaktır. Si Silisyum Demir K Potasyum Tel. Bakır ve levha haline getirilebilirler. Sembol ü n Na Au n Fe n n Cu Kalsiyum (Ca) Hg Civa Pb Kurşun

Ametallerin Özellikleri n n Elektrik akımını iletmez. Oda sıcaklığında üç halde de bulunur. Yüzeyleri mattır. Kırılgandır. Tel ve levha haline getirilemez. Kükürt (S) Bazı metallerin isimleri ve sembolleri Sembolü Adı H Hidrojen O Oksijen N Azot Cl Klor Br Brom I İyot S Kükürt P Fosfor F Fluor Oksijen (O) Brom( Br)

Soy Gazların Özellikleri Soygazların isimleri ve sembolleri n n n Helyum (He) Kripton (Kr) istekleri yok Kimyasal reaksiyona girme Adı gibidir. He Hidrojen Radon Neon Hepsi. Neon gaz halindedir. (Rn) (Ne) Ne Ar Argon Kriptonolarak bulunurlar. Tabiatta tek. Kr atomlu Sembol ü Xe Ksenon Rn Radon

MADDENİN FİZİKSEL VE KİMYASAL ÖZELLİKLERİ n Maddenin n n Fiziksel Özellikleri Bir maddenin bir başka maddeye dönüşmeksizin gözlenebilen ve ölçülebilen özellikleri fiziksel özelliktir. Maddenin rengi, kokusu, tadı, çözünürlüğü, sertliği, hacmi, ısı ve elektrik iletkenliği, katı, sıvı ve gaz halleri, erime noktası, kaynama noktası fiziksel özelliklerdendir.

Fiziksel özelliğe örnek n n n Bir maddenin fiziksel özelliklerini cıva metali üzerinde inceleyelim. Oda koşullarında sıvıdır. Metalik parlaklığa sahiptir. Kokusuzdur. Normal erime noktası -38, 87 C ve normal kaynama noktası 356, 58 C ’dir. Elektrik ve ısı akımını iyi iletir. 20 C ’de öz kütlesi 13, 55 g/cm 3’tür.

MADDENİN KİMYASAL ÖZELLİKLERİ n n Bir maddenin reaksiyon verebilmesi veya başka maddeler ile birleşerek yeni bir madde oluşturabilme kapasitesi kimyasal özelliktir. Yanıcı olup olmaması, asidik ya da bazik olması, herhangi bir madde ile reaksiyona girip girmemesi maddenin kimyasal özelliğidir.

FİZİKSEL DEĞİŞME n n Maddenin dış görünüşü ile ilgili olan özelliklerdir. Yoğunluk, sertlik, renk, koku, tad. . . gibi. Maddenin dış görünüşündeki değişiklikler fiziksel olaydır. Şekerin suda erimesi, kağıdın yırtılması, buzun erimesi. . . gibi. Kaynama olayı Kağıdın buruşturulm ası Tuzun çözünmesi Camın kırılması Erime olayı Yumurtanın kırılması

KİMYASAL DEĞİŞME n Maddenin iç yapısı ile ilgili olan özellikler kimyasal özelliklerdir. Yanıcı olup olmaması, asidik yada bazik özellik. . . gibi. Maddelerin atom ve moleküllerinde meydana gelen değişikler kimyasal değişmedir. Kağıdın yanması, hidrojen ve oksijenin birleşerek su oluşturması, demirin paslanması. . . gibi. Yumurtanın pişirilmesi Dinamitin patlaması Mumun yanması Kibritin yanması Amonyumdikromatın yanması Demirin paslanması

BİLEŞİKLER n n Birden fazla atomun belirli oranlarda kimyasal reaksiyon sonucu bir araya gelmesiyle oluşan yeni saf maddeye bileşik denir. Su , karbondioksit, yemek tuzu bileşiğe örnek olarak verilebilir. Bazı bileşiklerin formülleri ve isimleri Formülü Bileşiğin Adı H 2 O Su CO 2 Karbondioksit HCI Hidroklorik asit Na. CI Sodyum klorür Na. OH Sodyum hidroksit H 2 S 04 Sülfürik asit Su- yemek tuzu Sirke- karbondioksit

BİLEŞİKLERİN ÖZELLİKLERİ n n n Saf ve homojendirler. Kimyasal yollarla bileşenlerine ayrılabilir. Erime ve kaynama noktaları, öz kütleleri sabittir. Bileşiği oluşturan elementler sabit kütle oranlarında birleşirler. Formüllerle gösterilir. Kendisini oluşturan elementlerin kimyasal özelliklerinden farklıdır.

KARIŞIMLAR n Birden fazla maddenin kimyasal özellikleri değişmeyecek şekilde bir araya getirilmesiyle oluşturulan madde topluluğuna karışım denir.

KARIŞIMLARIN ÖZELLİKLERİ n n n Saf değildir. Fiziksel yollarla ayrıştırılırlar. Karışımı oluşturan maddelerin kimyasal özelliklerinde değişiklik olmaz. Karışımın yapısında farklı cins atom ya da molekül vardır. Karışımı oluşturan maddelerin miktarı arasında sabit bir oran yoktur.

Karışım ve Karışımın Özkütlesi n n Birbirine karışan maddelerin özkütlelerinden farklı özkütleli bir karışım elde edilir. Karışımın özkütlesi karışan maddelerin özkütlelerine ve karışma oranına bağlıdır. Karşımın özkütlesi;

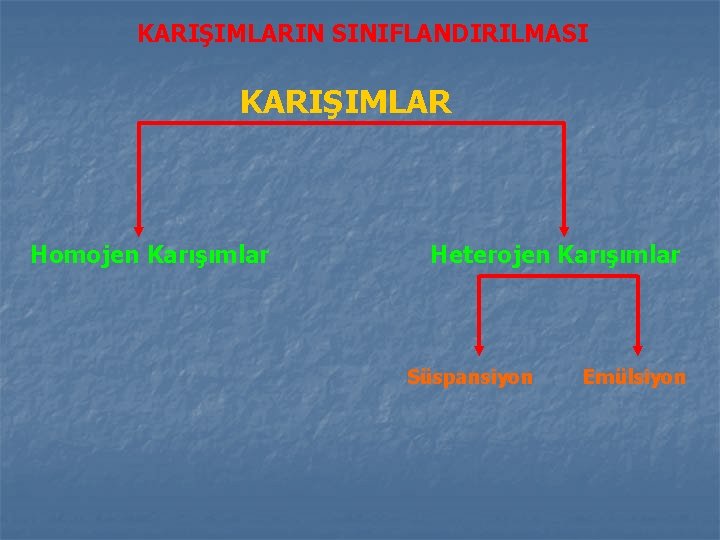
KARIŞIMLARIN SINIFLANDIRILMASI KARIŞIMLAR Homojen Karışımlar Heterojen Karışımlar Süspansiyon Emülsiyon

HOMOJEN KARIŞIMLAR n n n Her tarafında aynı özelliği gösteren, tek bir madde gibi gözüken karışımlardır. Homojen karışımlara genel olarak çözeltiler denir. Örnek : tuzlu su, şekerli su, hava, çeşme suyu.

HETEROJEN KARIŞIMLAR n n n Her tarafında farklı özellik gösteren karışımlar heterojendir. Örnek : maden filizleri, sis, kaya parçaları, odun parçaları, bitki yaprağı, ayran ve su -petrol karışımı Çıplak gözle bakıldığında homojen gibi gözükmesine rağmen mikroskopla bakıldığında heterojen olduğu gözlenen maddelerde vardır. Süt gibi

EMÜLSİYON n n Bir sıvıda çözünmeyen başka bir sıvının heterojen olarak bulanık bir şekilde dağılmış haline emülsiyon denir. Örnek: su-zeytin yağı karışımı, subenzin karışımı. Su-zeytin Yağı

SÜSPANSİYON n n Bir sıvıda çözünmeyen katının heterojen olarak dağılmış haline süspansiyon denir. Su-kum karışımı, su-tebeşir tozu karışımı örnek verilebilir. Sutoprak karışımı

MADDELERİN AYRIŞTIRILMASI n Maddelerin ayrıştırılmasını bileşiklerin ayrıştırılması ve karışımların ayrıştırılması olmak üzere 2 kısımda inceleyelim.

BİLEŞİKLERİN AYRIŞTIRILMASI n n Isı Enerjisi İle Ayrıştırma Bazı bileşikler ısı etkisi ile parçalanır. Yeni bileşik veya elementler oluşur. Kireç taşı olarak bilinen kalsiyum karbonatın ısı etkisi ile ayrıştırılmasından kalsiyum oksit ve karbondioksit oluşur Caco 3 Ca. O + CO 2

ELEKTRİK ENERJİSİ İLE AYRIŞTIRMA n n Sıvı halde ya da çözelti halinde bulunan maddeler elektroliz edilerek elementlerine ayrıştırılır. Suyun elektrolizinden katotta hidrojen, anotta oksijen gazı açığa çıkar.

KARIŞIMLARIN AYRIŞTIRILMASI n Elektriklenme n n İle Ayrılma Sürtünen bir kısım maddeler elektriklenir. Elektriklenen maddeler hafif bazı maddeleri çekerler. Kırmızı pul biber-yemek tuzu karışımına elektrik yüklü ebonit çubuk yaklaştırıldığında çubuk pul biberleri çeker.

Öz Kütle Farkı İle Ayrılma n n Öz kütlesi farklı iki katı karışımını ayırmak için bu karışım katıların çözünmediği bir sıvıya atılır. Öz kütlesi küçük olan kabın üst yüzeyinde, büyük olan da alt yüzeyinde bulunur. Üstteki madde süzülerek alınır. Kum-naftalin karışımı suya atıldığında kum dibe çöker, naftalin suyun yüzeyinde kalır.

Hal Değiştirme Sıcaklıkları Farkı İle Ayrılma n n n Erime noktası farklı katı-katı karışımları, kaynama noktası farklı sıvı-sıvı karışımları ve yoğunlaşma noktaları farklı gaz-gaz karışımları hal değiştirme sıcaklığı farkından yararlanarak ayrılır. Demir ve kurşundan oluşan karışımı ayırmak için, karışım bir potada ısıtılır. Sıcaklık 327, 5 C ye geldiğinde kurşun erir. Karışımdan süzülerek ayrılır. Geriye demir kalır.

Ayrımsal Damıtma n Su-alkol karışımı kaynama noktası farkından yararlanarak ayrılır. n Karışım ısıtıldığında kaynama noktası 78 C olan alkol önce kaynar. n Karışımdan uzaklaşır. Alkol buharlaşıncaya kadar sıcaklık sabit kalır. n Alkol buharlaşıp bitince sıcaklık tekrar yükselir. n Kaynama noktası farkından yararlanarak sıvı-sıvı karışımını ayırma işlemine ayrımsal damıtma denir.

SES Bahadır ÇALIŞKAN FEN BİLGİSİ DERS ÖĞRETMENİ GÜRSEL GEDİK SENERYO 7/D SINIFI SİNCAPLAR GRUBU ÜYELERİ

SON
 Taif yolculuğu sebepleri
Taif yolculuğu sebepleri Mekke'ye yolculuk
Mekke'ye yolculuk Manevi ve ruhi yolculuk
Manevi ve ruhi yolculuk Ornitin protein
Ornitin protein Yüklem nedir
Yüklem nedir Hallmark damga etkinlikleri
Hallmark damga etkinlikleri Nte bredbånd status
Nte bredbånd status Brb medical abbreviation
Brb medical abbreviation Nte testing
Nte testing Kavram çeşitleri
Kavram çeşitleri Gezip.nte
Gezip.nte Karışımları ayırma yöntemleri slayt
Karışımları ayırma yöntemleri slayt Yarı sentetik polimerler
Yarı sentetik polimerler Metinlerin sınıflandırılması
Metinlerin sınıflandırılması Mesleklerin sınıflandırılması
Mesleklerin sınıflandırılması Verilerin sınıflandırılması
Verilerin sınıflandırılması Hastanelerin sınıflandırılması
Hastanelerin sınıflandırılması Ateşsiz silahların sınıflandırılması
Ateşsiz silahların sınıflandırılması Karbonhidratların sınıflandırılması
Karbonhidratların sınıflandırılması Sıfatların sınıflandırılması
Sıfatların sınıflandırılması Protozoonların genel özellikleri
Protozoonların genel özellikleri Yarı asetal hidroksili
Yarı asetal hidroksili Kennedy modifikasyonları
Kennedy modifikasyonları Sekonder metabolitlerin sınıflandırılması
Sekonder metabolitlerin sınıflandırılması Psikolojik testlerin sınıflandırılması
Psikolojik testlerin sınıflandırılması Hedeflerin aşamalı sınıflandırılması
Hedeflerin aşamalı sınıflandırılması Anormal davranışların sınıflandırılması
Anormal davranışların sınıflandırılması Cupromag
Cupromag Sterinler
Sterinler Soluduğumuz gaz halindeki madde nedir
Soluduğumuz gaz halindeki madde nedir Parazitlerin sınıflandırılması
Parazitlerin sınıflandırılması Güzel sanatları sınıflandırma
Güzel sanatları sınıflandırma Ziyafet türleri
Ziyafet türleri Programlama dillerinin sınıflandırılması
Programlama dillerinin sınıflandırılması Yapıların sınıflandırılması
Yapıların sınıflandırılması önlük artlık uyumu
önlük artlık uyumu Carl linnaeus animal kingdom
Carl linnaeus animal kingdom Katıların sınıflandırılması
Katıların sınıflandırılması Kuşların sınıflandırılması
Kuşların sınıflandırılması Perferk
Perferk Projektif identifikasyon
Projektif identifikasyon Pratik sanatlar
Pratik sanatlar Dental seramiklerin sınıflandırılması
Dental seramiklerin sınıflandırılması Efsane nedir ve özellikleri
Efsane nedir ve özellikleri Isimlerin sınıflandırılması
Isimlerin sınıflandırılması Itme ve çekme stratejileri
Itme ve çekme stratejileri Saf maddeler örnek
Saf maddeler örnek Kollektif şirket
Kollektif şirket Nervus vii
Nervus vii Anomerik karbon
Anomerik karbon