MOLTEPLICI MECCANISMI DI ATTIVAZIONE DEI RECETTORI TK sovraespressione




























- Slides: 35








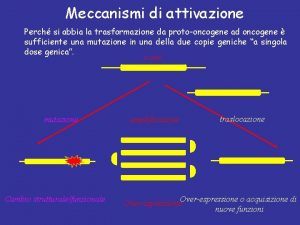
MOLTEPLICI MECCANISMI DI ATTIVAZIONE DEI RECETTORI TK ü ü ü ü sovraespressione della proteina recettoriale espressione del ligando loop autocrino eterodimerizzazione cross-talk con altri sistemi recettoriali espressione di recettori mutanti costitutivamente attivati alterazione dell’attività fosfatasica alterazioni delle vie di trasduzione di segnali a valle del recettore







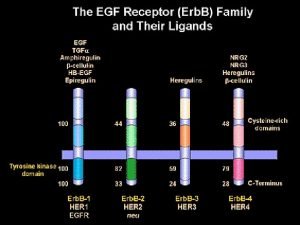
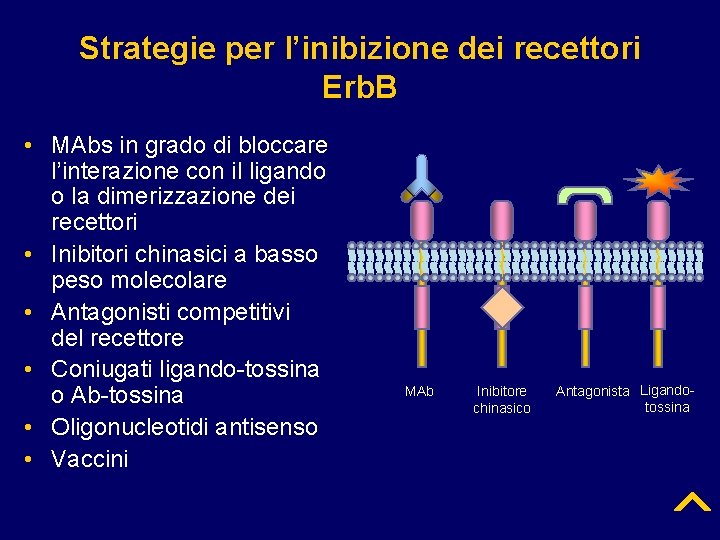
Strategie per l’inibizione dei recettori Erb. B • MAbs in grado di bloccare l’interazione con il ligando o la dimerizzazione dei recettori • Inibitori chinasici a basso peso molecolare • Antagonisti competitivi del recettore • Coniugati ligando-tossina o Ab-tossina • Oligonucleotidi antisenso • Vaccini MAb Inibitore chinasico Antagonista Ligandotossina

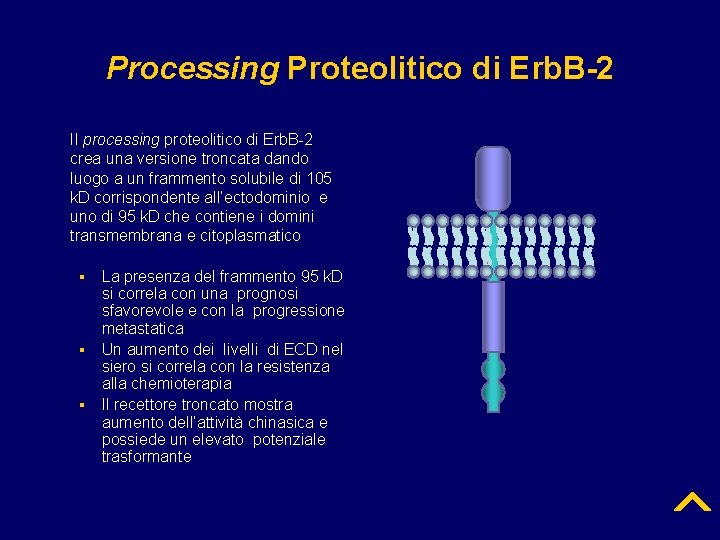
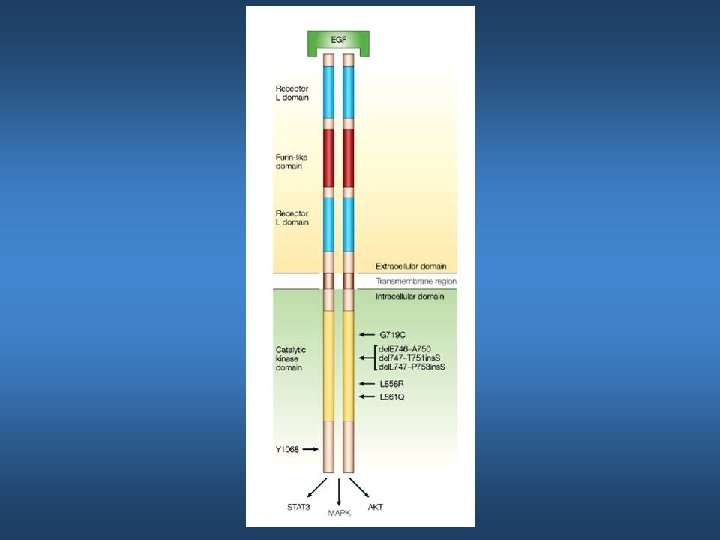
Processing Proteolitico di Erb. B-2 Il processing proteolitico di Erb. B-2 crea una versione troncata dando luogo a un frammento solubile di 105 k. D corrispondente all’ectodominio e uno di 95 k. D che contiene i domini transmembrana e citoplasmatico ▪ ▪ ▪ La presenza del frammento 95 k. D si correla con una prognosi sfavorevole e con la progressione metastatica Un aumento dei livelli di ECD nel siero si correla con la resistenza alla chemioterapia Il recettore troncato mostra aumento dell’attività chinasica e possiede un elevato potenziale trasformante

Meccanismi dell’azione antiproliferativa del Trastuzumab (Herceptin ) Induzione di morte cellulare immuno-mediata Diminuzione dello “shedding” dell’ectodominio di HER 2 Aumento dell’internalizzazione recettoriale Aumento dell’espressione e/o della funzionalità di inibitori delle chinasi ciclina-dipendenti Inibizione di pathways anti-apoptotici

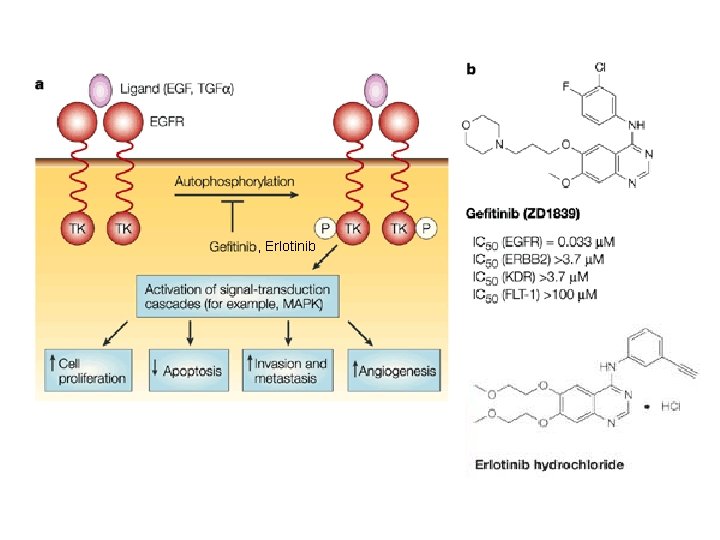
, Erlotinib

Gefitinib (Iressa ) ü Classe chimica: chinazoline ü somministrabile per via orale ü inibitore selettivo dell’attività TK del EGFr IC 50 =0. 023 mol/L erb. B 2 IC 50 = 1. 2 -3. 7 mol/L ü inibitore competitivo dell’ATP ü inibisce la proliferazione cellulare indotta da ligandi di EGFr IC 50 = 80 nmol/L ü induce la completa regressione di carcinomi umani xenotrapiantati nel topo nudo




Altri anticorpi diretti contro recettori della famiglia Erb. B Cetuximab (Erbitux®): anticorpo chimerico diretto contro Erb. B 1 (EGFr) Matuzumab: anticorpo umanizzato, diretto contro Erb. B 1 Panitumumab (Vectibix ): anticorpo completamente umano, diretto contro Erb. B 1







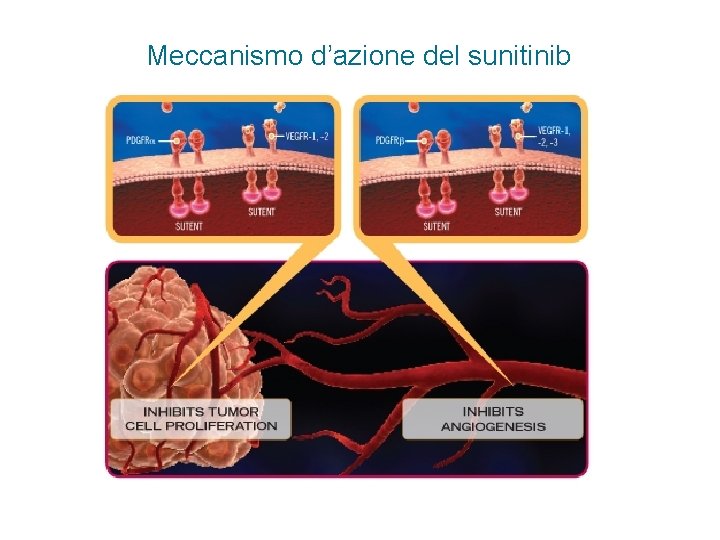
Multitargeted agents • Lapatinib (Tykerb®): inibitore a basso peso molecolare dell’attività chinasica di Erb. B 1 e Erb. B 2 • Sunitinib (Sutent®): inibitore a basso peso molecolare dell’attività chinasica di VEGFR, PDGFR e KIT • Sorafenib (Nexavar®): inibitore a basso peso molecolare dell’attività chinasica di VEGFR, PDGFR, KIT, RET e Raf-1

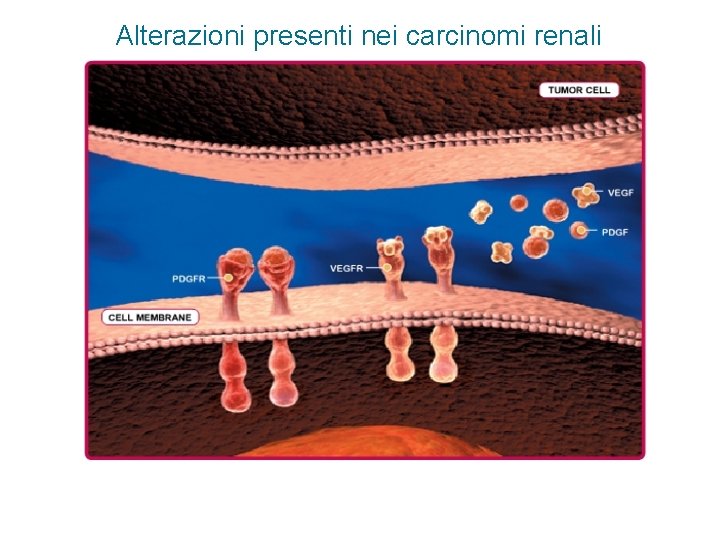
Alterazioni presenti nei carcinomi renali 1 MUTAZIONE DI VHL 2 STABILIZZAZIONE E ACCUMULO DI HIF-1α TRASCRIZIONE DEI GENI PER VEGF E PDGF 3 4 SOVRAESPRESSIONE DI VEGF E PDGF

Meccanismo d’azione del sunitinib

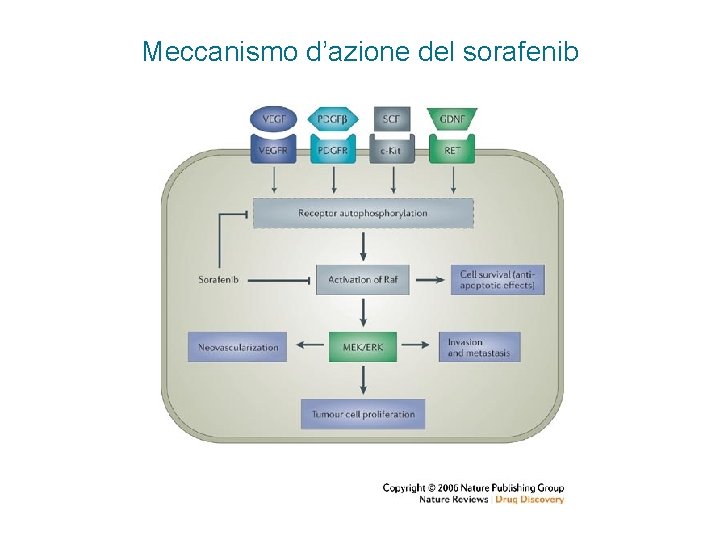
Meccanismo d’azione del sorafenib

Potenziali benefici di nuovi inibitori dei recettori Erb. B Ø Aumento della potenza e/o miglioramento delle proprietà farmacocinetiche Ø Inibizione di forme mutate dei recettori, resistenti agli inibitori già in uso clinico Ø Inibizione di più di un membro della famiglia di recettori Erb. B Ø Inibizione simultanea di EGFr e VEGFR Ø Attività additiva o sinergica con gli effetti della chemioterapia

 Enhancer trap
Enhancer trap Attivazione coagulativa
Attivazione coagulativa Via alternativa complemento
Via alternativa complemento Codice attivazione symwriter
Codice attivazione symwriter Grafico energia di attivazione
Grafico energia di attivazione Meccanismi antireflusso
Meccanismi antireflusso Meccanismi locali di ribaltamento
Meccanismi locali di ribaltamento Schema mintzberg
Schema mintzberg Test appercezione tematica
Test appercezione tematica Meccanismi energetici mappa concettuale
Meccanismi energetici mappa concettuale Meccanismi epigenetici
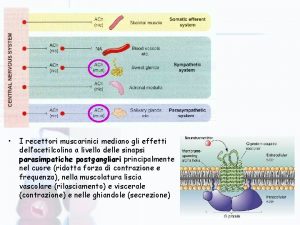
Meccanismi epigenetici Recettori muscarinici
Recettori muscarinici Prrs recettori
Prrs recettori Recettori adrenergici
Recettori adrenergici Recettori nicotinici dove si trovano
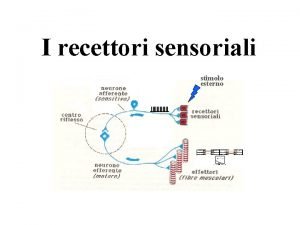
Recettori nicotinici dove si trovano Stimolo esterno
Stimolo esterno Rodhopsin
Rodhopsin Neurotrasmettitori
Neurotrasmettitori Pachicurari
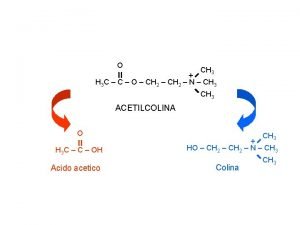
Pachicurari Transcitosi
Transcitosi Adrenalina alfa agonista puro
Adrenalina alfa agonista puro Recettori decoy
Recettori decoy Recettori muscarinici
Recettori muscarinici Vmat trasportatore
Vmat trasportatore Recettori dopaminergici
Recettori dopaminergici Tutti i poligoni
Tutti i poligoni Agnus dei agnus dei qui tollis peccata peccata mundi
Agnus dei agnus dei qui tollis peccata peccata mundi La marcia dei diritti dei bambini testo da stampare
La marcia dei diritti dei bambini testo da stampare Legge punti coniugati
Legge punti coniugati Ad altare dei answers chapter 1
Ad altare dei answers chapter 1 Sub tutela dei significato
Sub tutela dei significato Apparato riproduttivo femminile
Apparato riproduttivo femminile Crisi dei fondamenti
Crisi dei fondamenti Percy jackson racconta gli dei greci
Percy jackson racconta gli dei greci Il mot
Il mot Regola di cartesio
Regola di cartesio