Meccanismi effettori dellimmunit innata I principali meccanismi effettori




- Slides: 12

Meccanismi effettori dell’immunità innata I principali meccanismi effettori dell’immunità innata nelle difese antimicrobiche sono: • • L’infiammazione La fagocitosi L’attivazione della cascata del complemento La citossicità mediata dalle cellule NK Produzione di interferone L’apoptosi L’autofagia Le cellule dendritiche fanno da ponte fra immunità innata e immunità adattativa

Classificazione funzionale delle citochine • • • Citochine che regolano l’immunità innata. Sono prodotte principalmente dai macrofagi in risposta ad agenti infettivi. Anche le cellule dendritiche, le cellule natural killer (NK), le cellule epiteliali ed endoteliali producono citochine. Principali citochine: TNF-α (fattore di crescita tumorale), IL 1, IL 6, IL 10, IL 12, IL 15, IL 18, IFN- e , IFN- (svolge ruoli specifici sia nell’immunità innata che nell’immunità adattativa) + chemochine (es. CCL 2 (richiamo di leucociti) e CXCL 8 (richiamo di neutrofili). Citochine che regolano l’immunità adattativa. Sono prodotte soprattutto dai linfociti T in risposta al riconoscimento dell’antigene. Alcune regolano la crescita e la differenziazione dei linfociti; altre attivano cellule effettrici (macrofagi e neutrofili), contribuendo all’eliminazione dell’antigene. Principali citochine: IL 2, IL 4, IL 5 e IL 13, IL 17, IFN- . Citochine che stimolano l’ematopoiesi. Sono prodotte principalmente dalle cellule stromali del midollo osseo. Stimolano la crescita e la differenziazione dei leucociti. IL 3, IL 7

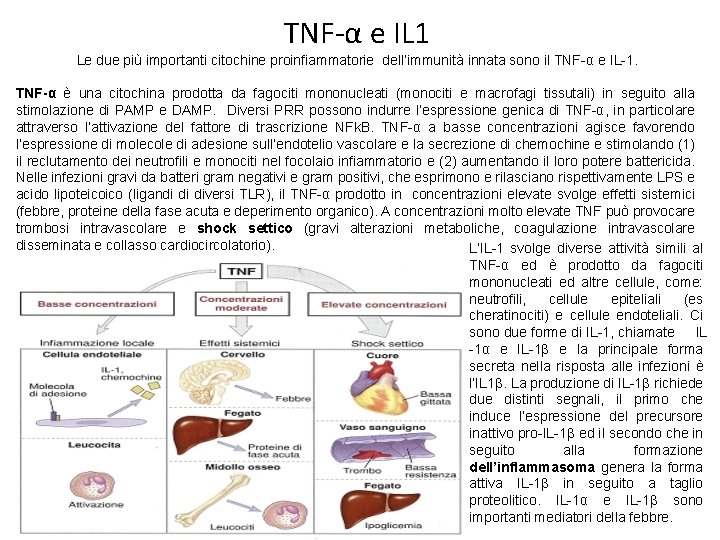
TNF-α e IL 1 Le due più importanti citochine proinfiammatorie dell’immunità innata sono il TNF-α e IL-1. TNF-α è una citochina prodotta da fagociti mononucleati (monociti e macrofagi tissutali) in seguito alla stimolazione di PAMP e DAMP. Diversi PRR possono indurre l’espressione genica di TNF-α, in particolare attraverso l’attivazione del fattore di trascrizione NFk. B. TNF-α a basse concentrazioni agisce favorendo l’espressione di molecole di adesione sull’endotelio vascolare e la secrezione di chemochine e stimolando (1) il reclutamento dei neutrofili e monociti nel focolaio infiammatorio e (2) aumentando il loro potere battericida. Nelle infezioni gravi da batteri gram negativi e gram positivi, che esprimono e rilasciano rispettivamente LPS e acido lipoteicoico (ligandi di diversi TLR), il TNF-α prodotto in concentrazioni elevate svolge effetti sistemici (febbre, proteine della fase acuta e deperimento organico). A concentrazioni molto elevate TNF può provocare trombosi intravascolare e shock settico (gravi alterazioni metaboliche, coagulazione intravascolare disseminata e collasso cardiocircolatorio). L’IL-1 svolge diverse attività simili al TNF-α ed è prodotto da fagociti mononucleati ed altre cellule, come: neutrofili, cellule epiteliali (es cheratinociti) e cellule endoteliali. Ci sono due forme di IL-1, chiamate IL -1α e IL-1β e la principale forma secreta nella risposta alle infezioni è l’IL 1β. La produzione di IL-1β richiede due distinti segnali, il primo che induce l’espressione del precursore inattivo pro-IL-1β ed il secondo che in seguito alla formazione dell’inflammasoma genera la forma attiva IL-1β in seguito a taglio proteolitico. IL-1α e IL-1β sono importanti mediatori della febbre.

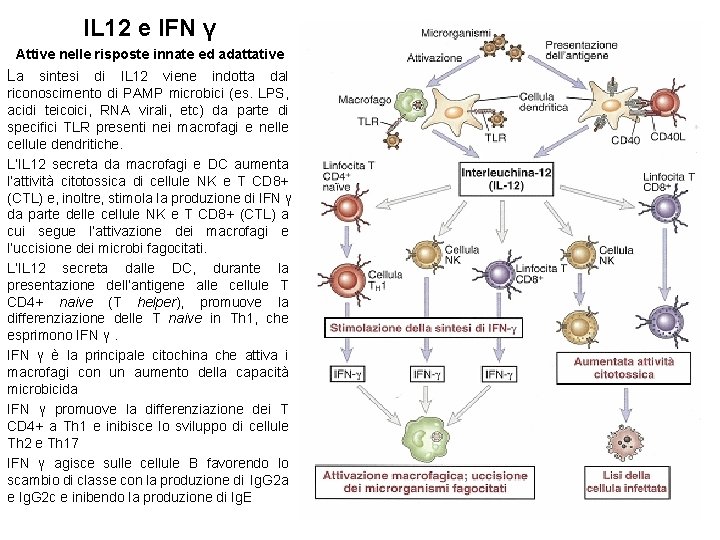
IL 12 e IFN γ Attive nelle risposte innate ed adattative La sintesi di IL 12 viene indotta dal riconoscimento di PAMP microbici (es. LPS, acidi teicoici, RNA virali, etc) da parte di specifici TLR presenti nei macrofagi e nelle cellule dendritiche. L’IL 12 secreta da macrofagi e DC aumenta l’attività citotossica di cellule NK e T CD 8+ (CTL) e, inoltre, stimola la produzione di IFN γ da parte delle cellule NK e T CD 8+ (CTL) a cui segue l’attivazione dei macrofagi e l’uccisione dei microbi fagocitati. L’IL 12 secreta dalle DC, durante la presentazione dell’antigene alle cellule T CD 4+ naive (T helper), promuove la differenziazione delle T naive in Th 1, che esprimono IFN γ è la principale citochina che attiva i macrofagi con un aumento della capacità microbicida IFN γ promuove la differenziazione dei T CD 4+ a Th 1 e inibisce lo sviluppo di cellule Th 2 e Th 17 IFN γ agisce sulle cellule B favorendo lo scambio di classe con la produzione di Ig. G 2 a e Ig. G 2 c e inibendo la produzione di Ig. E

IL-6, prodotta dai macrofagi, cellule endoteliali e cellule T agisce come citochina multifunzionale, sia pro-infiammatoria, sia anti-infiammatoria. La IL-6 è uno dei più importanti mediatori della febbre e delle risposte di fase acuta. È in grado di attraversare la barriera emato-encefalica e iniziare la sintesi di PGE 2 nell'ipotalamo, provocando quindi l'aumento della temperatura corporea. IL -10, prodotta da macrofagi e DC, attivati dal legame con PAMP, Th 1 e Th 2. Limita un potenziale danno cellulare inibendo l’eccessiva produzione di IL-1 e TNF IL-15, prodotta da macrofagi e altre cellule stimola la crescita e le funzioni delle cellule NK e T. Il-18, citochina dell’immunità innata prodotta da monociti, macrofagi, cellule DC, cheratinociti e altre cellule agisce sulle cellule NK e T con la produzione di IFN γ, sui monociti con l’espressione di IL-1 β e TNF, attiva i neutrofili. La produzione di IL-18, come IL-1β, dipende dagli inflammasomi IL 4, rappresenta il principale stimolo per la produzione di anticorpi Ig. E, l’attività di mastociti e eosinofili e per lo sviluppo di cellule Th 2 da linfociti T helper CD 4+ naive. Le Ig. E sono i principali effettori della difesa mediata dagli eosinofili contro le infezioni da elminti, che rappresenta anche la principale funzione dei Th 2. Le Ig. E sono anche il principale mediatore delle reazioni di ipersesibilità immediata (allergia). IL-2 Principale citochina dell’immunità adattativa IL-2 è la principale citochina prodotta dai linfociti Tnaive CD 4+, CD 8+ e di memoria, attivati in seguito all’incontro con l’antigene associato ad MHCI. L’attivazione dei linfociti T porta all’espressione della IL-2 e del suo recettore IL-2 R e, pertanto, la citochina agisce principalmente sulle cellule che l’hanno prodotta o su quelle vicine , con un meccanismo sia autocrino che paracrino. • • • IL-2 stimola la sopravvivenza, proliferazione e differenziazione dei linfociti attivati dall’antigene. IL-2 induce proliferazione e differenziazione di cellule NK IL-2 è necessaria per la sopravvivenza e per le funzioni dei linfociti T regolatori (Treg) che sopprimono le risposte immunitarie verso gli antigeni self

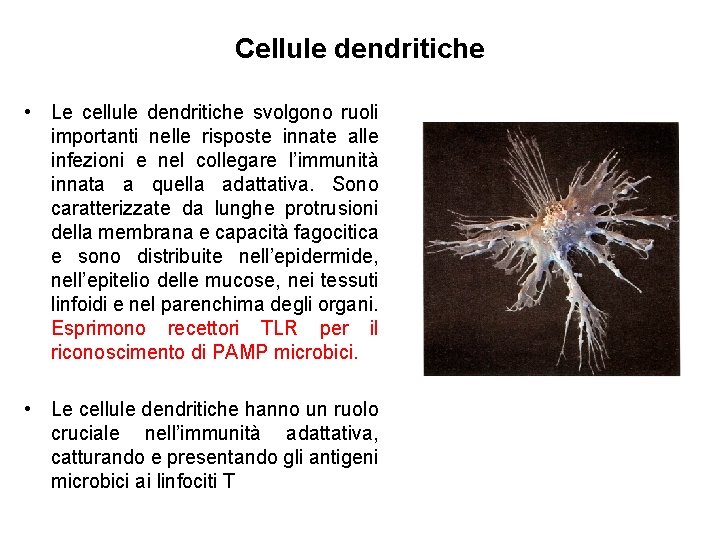
Cellule dendritiche • Le cellule dendritiche svolgono ruoli importanti nelle risposte innate alle infezioni e nel collegare l’immunità innata a quella adattativa. Sono caratterizzate da lunghe protrusioni della membrana e capacità fagocitica e sono distribuite nell’epidermide, nell’epitelio delle mucose, nei tessuti linfoidi e nel parenchima degli organi. Esprimono recettori TLR per il riconoscimento di PAMP microbici. • Le cellule dendritiche hanno un ruolo cruciale nell’immunità adattativa, catturando e presentando gli antigeni microbici ai linfociti T

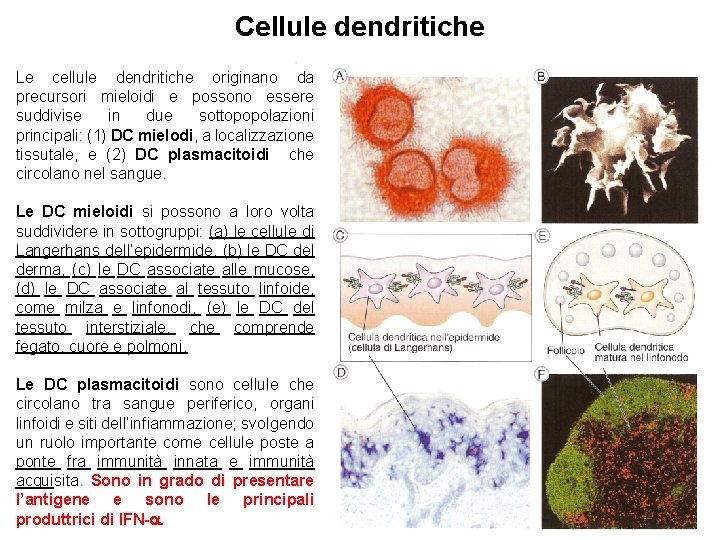
Cellule dendritiche Le cellule dendritiche originano da precursori mieloidi e possono essere suddivise in due sottopopolazioni principali: (1) DC mielodi, a localizzazione tissutale, e (2) DC plasmacitoidi che circolano nel sangue. Le DC mieloidi si possono a loro volta suddividere in sottogruppi: (a) le cellule di Langerhans dell’epidermide, (b) le DC del derma, (c) le DC associate alle mucose, (d) le DC associate al tessuto linfoide, come milza e linfonodi, (e) le DC del tessuto interstiziale, che comprende fegato, cuore e polmoni. Le DC plasmacitoidi sono cellule che circolano tra sangue periferico, organi linfoidi e siti dell’infiammazione; svolgendo un ruolo importante come cellule poste a ponte fra immunità innata e immunità acquisita. Sono in grado di presentare l’antigene e sono le principali produttrici di IFN-.

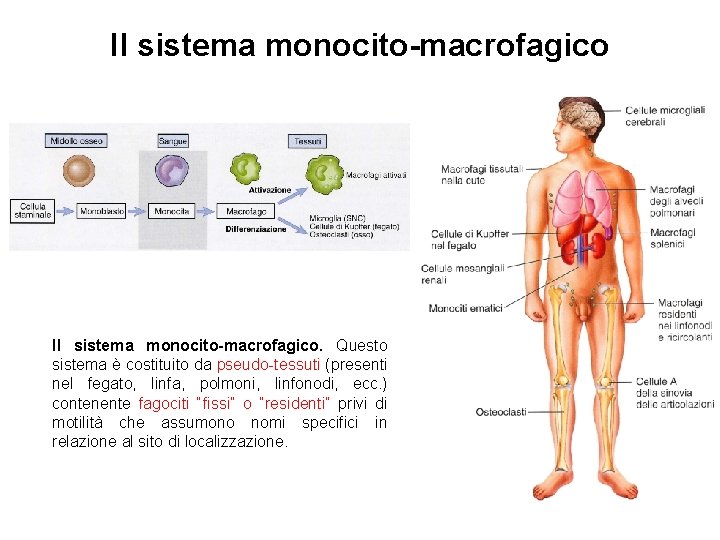
Il sistema monocito-macrofagico. Questo sistema è costituito da pseudo-tessuti (presenti nel fegato, linfa, polmoni, linfonodi, ecc. ) contenente fagociti “fissi” o “residenti” privi di motilità che assumono nomi specifici in relazione al sito di localizzazione.

Fagocitosi (1) I fagociti riconoscono i microrganismi attraverso due meccanismi: (1) opsonina indipendente e (2) opsonina dipendente Processo di fagocitosi. (a) recettori presenti sul fagocita, (b) ingestione con formazione di un fagosoma, (c) fusione con il lisosoma a formare un fagolisosoma, (d) digestione intracellulare ad opera di idrolasi (nucleasi, proteasi , ecc) ed enzimi ossigeno-dipendenti che producono intermedi tossici dell’ossigeno (specie reattive dell’ossigeno-ROS), come H 2 O 2, OH-, O 2 - ecc. e i. NOS con produzione di monossido di azoto (e) morte cellulare e esocitosi. Proteine della fase acuta. A seguito della fagocitosi di batteri i macrofagi rilasciano citochine (TNF, IL 12) che favoriscono l’infiammazione e stimolano il fegato a produrre proteine della fase acuta. Queste comprendono la proteina C reattiva (CRP) o pentrassina, le collectine e la lectina legante il mannosio (MPL). L’MPL attiva la via lectinica del complemento.

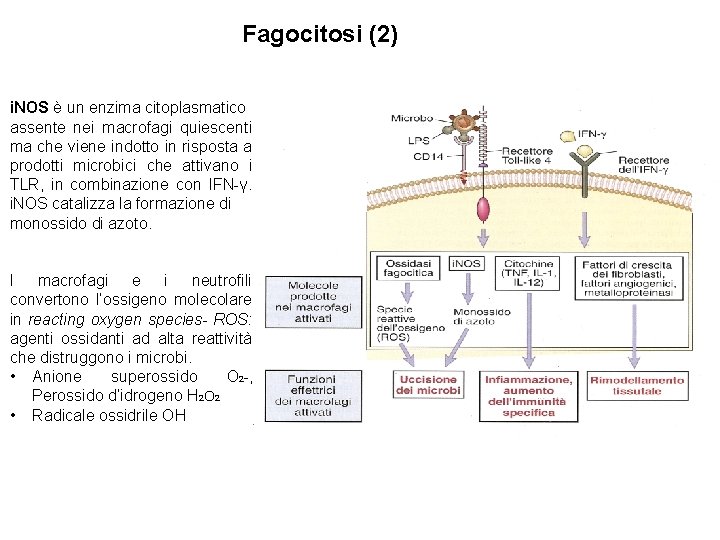
Fagocitosi (2) i. NOS è un enzima citoplasmatico assente nei macrofagi quiescenti ma che viene indotto in risposta a prodotti microbici che attivano i TLR, in combinazione con IFN-γ. i. NOS catalizza la formazione di monossido di azoto. I macrofagi e i neutrofili convertono l’ossigeno molecolare in reacting oxygen species- ROS: agenti ossidanti ad alta reattività che distruggono i microbi. • Anione superossido O 2 -, Perossido d’idrogeno H 2 O 2 • Radicale ossidrile OH

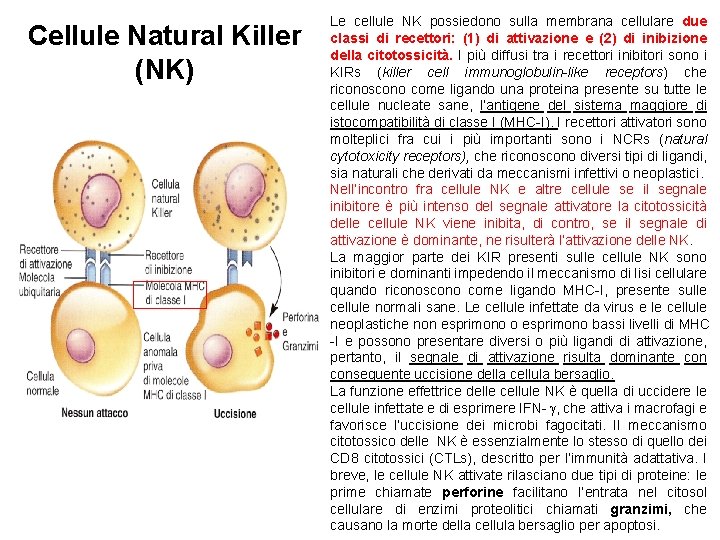
Cellule Natural Killer (NK) Le cellule NK possiedono sulla membrana cellulare due classi di recettori: (1) di attivazione e (2) di inibizione della citotossicità. I più diffusi tra i recettori inibitori sono i KIRs (killer cell immunoglobulin-like receptors) che riconoscono come ligando una proteina presente su tutte le cellule nucleate sane, l’antigene del sistema maggiore di istocompatibilità di classe I (MHC-I). I recettori attivatori sono molteplici fra cui i più importanti sono i NCRs (natural cytotoxicity receptors), che riconoscono diversi tipi di ligandi, sia naturali che derivati da meccanismi infettivi o neoplastici. Nell’incontro fra cellule NK e altre cellule se il segnale inibitore è più intenso del segnale attivatore la citotossicità delle cellule NK viene inibita, di contro, se il segnale di attivazione è dominante, ne risulterà l’attivazione delle NK. La maggior parte dei KIR presenti sulle cellule NK sono inibitori e dominanti impedendo il meccanismo di lisi cellulare quando riconoscono come ligando MHC-I, presente sulle cellule normali sane. Le cellule infettate da virus e le cellule neoplastiche non esprimono o esprimono bassi livelli di MHC -I e possono presentare diversi o più ligandi di attivazione, pertanto, il segnale di attivazione risulta dominante conseguente uccisione della cellula bersaglio. La funzione effettrice delle cellule NK è quella di uccidere le cellule infettate e di esprimere IFN- , che attiva i macrofagi e favorisce l’uccisione dei microbi fagocitati. Il meccanismo citotossico delle NK è essenzialmente lo stesso di quello dei CD 8 citotossici (CTLs), descritto per l’immunità adattativa. I breve, le cellule NK attivate rilasciano due tipi di proteine: le prime chiamate perforine facilitano l’entrata nel citosol cellulare di enzimi proteolitici chiamati granzimi, che causano la morte della cellula bersaglio per apoptosi.

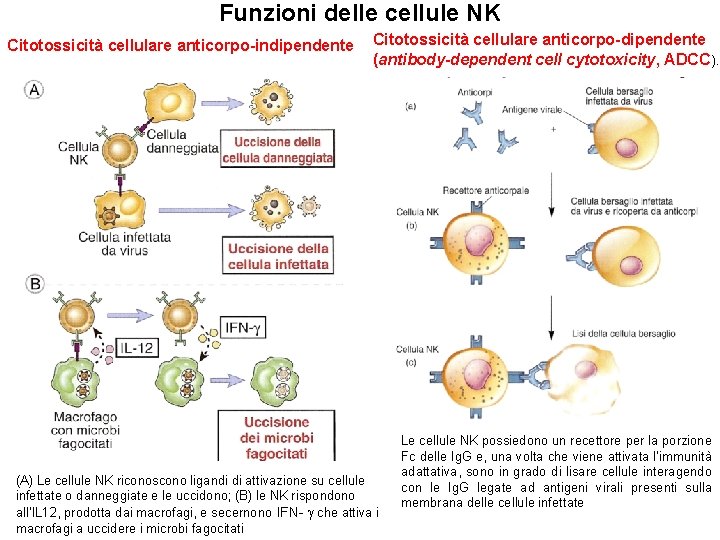
Funzioni delle cellule NK Citotossicità cellulare anticorpo-indipendente Citotossicità cellulare anticorpo-dipendente (antibody-dependent cell cytotoxicity, ADCC). (A) Le cellule NK riconoscono ligandi di attivazione su cellule infettate o danneggiate e le uccidono; (B) le NK rispondono all’IL 12, prodotta dai macrofagi, e secernono IFN- che attiva i macrofagi a uccidere i microbi fagocitati Le cellule NK possiedono un recettore per la porzione Fc delle Ig. G e, una volta che viene attivata l’immunità adattativa, sono in grado di lisare cellule interagendo con le Ig. G legate ad antigeni virali presenti sulla membrana delle cellule infettate
 Meccanismi epigenetici
Meccanismi epigenetici Valvola di von gubaroff
Valvola di von gubaroff Meccanismi locali di ribaltamento
Meccanismi locali di ribaltamento Grafico de mintzberg
Grafico de mintzberg Test di appercezione tematica
Test di appercezione tematica Fabbisogno energetico
Fabbisogno energetico Momento d inerzia polare
Momento d inerzia polare Eternatore
Eternatore Alessandro manzoni opere principali
Alessandro manzoni opere principali Quali sono le principali risorse energetiche in islanda
Quali sono le principali risorse energetiche in islanda Leopardi opere principali
Leopardi opere principali Ritratto di monsieur bertin analisi
Ritratto di monsieur bertin analisi Forze endogene
Forze endogene