Principali Propriet dei Colloidi Le principali caratteristiche dei





















- Slides: 21




Principali Proprietà dei Colloidi Le principali caratteristiche dei sistemi colloidali possono essere attribuite all'esistenza di un'interfaccia tra fase dispersa e mezzo disperdente. Ogni particella ha infatti una superficie ben definita che presenta le tipiche proprietà interfacciali: l'adsorbimento, lo stato elettrico, la coalescenza, ecc. Pertanto il rapporto superficie/volume delle particelle disperse ha una notevolissima influenza nel determinare il comportamento dei sistemi colloidali. Le principali proprietà dei sistemi colloidali sono: -Coagulazione -Effetto Tyndall -Adsorbimento -Viscosità -Dialisi -Elettroforesi -Moto browniano

Coagulazione Le particelle della fase dispersa, venendo a contatto tra loro, interagiscono mutuamente per formare aggregati di massa maggiore che precipitano per azione della forza di gravità. Effetto Tyndall Quando le particelle di polvere disperse nell'aria sono investite da un raggio di luce solare che penetra attraverso le fessure di una finestra, diventano visibili ed appaiono come punti brillanti. Questo fenomeno è detto effetto Tyndall e consiste appunto nella diffusione della luce che attraversa una soluzione colloidale.

Effetto Tyndall quando un raggio luminoso investe una soluzione, la attraversa direttamente: notare il puntino rosso del laser che colpisce lo schermo e la traccia del laser (per diffusione trasversale) nella soluzione. quando un raggio luminoso investe una dispersione, la luce viene diffusa in tutte le direzioni: notare che il puntino rosso del laser non colpisce lo schermo L'effetto Tyndall è dovuto al fatto che il diametro medio delle particelle disperse è maggiore della lunghezza d'onda della radiazione luminosa (nello spettro visibile). Questo effetto è evidente per un osservatore disposto perpendicolarmente alla direzione del fascio luminoso; al contrario, un raggio luminoso è invisibile, qualunque sia la posizione dell'osservatore, se passa attraverso una soluzione vera e propria o un liquido puro in quanto il diametro medio delle particelle è minore della lunghezza d'onda dei raggi luminosi (l'interazione materia-radiazione è quindi minima o nulla).

Adsorbimento Questo fenomeno consiste nell'adesione di molecole, atomi o ioni sulla superficie di altre sostanze. Le particelle adsorbite (termine da non confondere con "assorbito") si uniscono ad una superficie con forze di Van der Waals o con legami di valenza, formando uno strato mono o bimolecolare. Ad esempio, i gas entrano raramente in soluzione con i solidi, e anche raramente penetrano all'interno dei cristalli; tuttavia, possono aderire alla loro superficie. Ci si può convincere facilmente dell'importanza del fenomeno dell'adsorbimento considerando l'enorme superficie complessiva delle particelle che costituiscono un sistema disperso. L'adsorbimento è impiegato nella catalisi: le molecole di gas diversi, adsorbite su una superficie, reagiscono più facilmente in quanto vengono a trovarsi in stretto contatto tra loro. Un'altra applicazione, di natura farmacologica, è offerta dal carbone in polvere, che è in grado di adsorbire ammoniaca, anidride carbonica ed altri gas tossici (per questo è usato per ridurre i gas intestinali).



Elettroforesi Questo fenomeno consiste nella migrazione di particelle colloidali immerse in un campo elettrico. I colloidi possono possedere cariche elettriche sia perché sono essi stessi carichi, sia perché adsorbono elettroliti sulla loro superficie. Moto browniano Questo fenomeno osservando all'ultramicroscopio una soluzione colloidale, si nota che le particelle in essa disperse si muovono continuamente a "zig-zag". Questo movimento (schematizzato nell'animazione a destra) è dovuto alle continue collisioni con le molecole circostanti del mezzo disperdente: poiché la risultante di questi urti può essere non nulla ed orientata in una qualsiasi direzione, le particelle disperse si muovono ora da una parte ora dall'altra, del tutto a caso. In particolare, il moto browniano è più rapido quanto più piccole sono le particelle, aumenta con la temperatura (in quanto aumenta l'energia cinetica del sistema) e diminuisce con la viscosità del mezzo. La velocità delle particelle è un importante parametro per decidere quando una dispersione abbia carattere colloidale; infatti, tanto più lento è il moto browniano, tanto più la dispersione esaminata si avvicina allo stato di sospensione, le cui particelle hanno dimensioni sufficientemente grandi da rendere nulla la risultante degli urti dovuti alle molecole del mezzo disperdente, e non presentano moto browniano. Il moto browniano concorre alla stabilità delle dispersioni colloidali in quanto contrasta l'azione della gravità che tende a far sedimentare le particelle disperse.

Viscosità Le soluzioni di colloidi liofili presentano un'elevata viscosità, a differenza delle sospensioni, la cui viscosità per concentrazioni moderate è quasi uguale a quelle del mezzo disperdente (basta pensare alla viscosità di soluzioni di gomma anche molto dluite). Gli emulsoidi diminuiscono la tensione superficiale dell'acqua e pertanto le particelle disperse, come vuole la legge di Gibbs, si dovranno concentrare prevalentemente alla superficie del liquido. Pertanto, sottili strati di soluzioni colloidali si presentano molto viscosi e resistenti (schiume saponose). Dialisi Il fatto che le le membrane naturali o sintetiche, tipo pergamena, cellophan e nitrocellulosa, si lascino attraversare dalle soluzioni vere, mentre costituiscono una barriera per le dispersioni colloidali, fornisce un mezzo per la loro separazione. Questo processo è detto dialisi e l'apparecchio utilizzatore, dializzatore.

Classificazione e caratteristiche delle soluzioni colloidali Il termine di colloide richiama alla mente soprattutto sostanze dalla consistenza simile a quella di una colla, la cui fase disperdente è quindi liquida. D'altra parte, sono colloidi anche sostanze quali i fumi e gli aerosol, la cui fase disperdente è aeriforme e che possiamo chiamare anche sospensioni gassose. Sono infine colloidi anche alcune sostanze solide, nelle quali la fase disperdente è solida e che possiamo chiamare anche sospensioni solide. La dimensione delle particelle in una soluzione colloidale varia da 10 -5 a 10 -7 cm. Per quanto riguarda le forme farmaceutiche speciali, questo significa che solo le microcapsule (variano da circa 10 µm a pochi mm) di dimensioni più piccole possono dare dispersioni colloidali; al contrario, i liposomi (50 - 500 nm) si presentano spesso come dispersioni colloidali.

I sistemi colloidali sono caratterizzati da un elevato rapporto area/volume fra la superficie delle particelle e il loro volume e questo conferisce loro proprietà particolari. Infatti, poichè nei colloidi il numero di particelle disperse è molto elevato, la loro superficie complessiva è anch'essa molto grande e di conseguenza l'interazione fra le due fasi è importante. Per esempio, un cubo di 1 cm di lato ha una superficie di 6 cm 2; lo stesso cubo ridotto a cubetti di 0, 002 µm per lato, ha una superficie di 3000 m 2. A causa della grande superficie di contatto fra le due fasi, i colloidi vengono spesso studiati insieme con i fenomeni di superficie e la disciplina che li studia prende il nome di SCIENZA DEI FENOMENI DI SUPERFICIE E DEI SISTEMI COLLOIDALI (surface and colloid science). Un sol è una dispersione finissima di particelle solide in un liquido. Ha una consistenza fluida ed è simile alle soluzioni vere. Un sol acquoso appare limpido e del tutto simile all'acqua comune. Se però viene attraversato da un intenso fascio luminoso, parte della luce verrà diffusa dalle particelle che sono in sospensione. Queste particelle, benché molto piccole, sono ancóra abbastanza grandi da deviare la luce e diffonderla. Questo fenomeno si chiama effetto Tyndall. Esso si osserva nei sol, ma non nelle soluzioni vere.

SOL LIOFILI: sono quelli le cui particelle disperse presentano affinità con il loro solvente (se il mezzo disperdente è l'acqua, si parla di sol idrofili) e sono sistemi stabili. I sol liofili sono generalmente costituiti da dispersioni di macromolecole (gomma, amido, proteine, polimeri sintetici, ecc. ); questi sistemi presentano caratteristiche simili a quelle delle vere soluzioni. Infatti, passano facilmente in soluzione per semplice miscelazione con un adatto solvente e risultano molto stabili; questo è, ad es. , il comportamento della gelatina in acqua, della gomma in benzene, del polivinilacetato in acetone. Caratteristica dei sol liofili è pure la tendenza a solidificare in masse soffici e leggermente elastiche note come gel (v. foto a destra), che possono nuovamente essere trasformati in sol per semplice addizione del mezzo disperdente dal quale erano stati aggregati (flocculati): sono pertanto detti colloidi reversibili.

Sol liofobi: sono quelli le cui particelle disperse non presentano affinità con un solvente (se il mezzo disperdente è l'acqua, si parla di sol idrofobi) e sono sistemi instabili. I sol liofobi sono generalmente costituiti da sospensioni di micelle di sostanze inorganiche, quali: metalli, zolfo, acido salicilico, ossidi, solfuri ed altri sali. Sono relativamente instabili o metastabili e possono dare luogo a coagulazione per addizione di piccole quantità di elettroliti o leggeri aumenti di temperatura. Anche alcuni sol liofobi (idrossico ferrico, idrossido di alluminio, acido salicilico) vengono precipitati in forma di gel dalla rispettive dispersioni colloidali. Tutti questi sistemi però non ritornano a sol per semplice addizione del solvente: pertanto sono detti colloidi irreversibili.

Tra i due tipi di dispersioni colloidali esistono anche altre differenze: la tensione superficiale viene notevolmente modificata solo nei colloidi liofili e la viscosità del mezzo disperdente aumenta nei sol liofili, mentre non è quasi influenzata nei sol liofobi. Aumentando la concentrazione delle particelle, un sol può passare allo stato di gel: una dispersione finissima di particelle solide che ha una consistenza gelatinosa. Al contrario, diluendo un gel si può tornare ad un sol. Quindi, ciò che differenzia un sol da un gel è la sua consistenza rispettivamente fluida o gelatinosa. Anche la temperatura può determinare il passaggio da sol a gel e viceversa. Per esempio, la gelatina di brodo è gelatinosa a temperatura ambiente, ma diventa liquida quando viene scaldata. La gelatina animale è un gel reversibile, perché con la temperatura può passare da gel a sol e viceversa. Invece, l'albume dell'uovo non è reversibile dal momento che se viene portato a una certa temperatura coagula e non torna più allo stato di sol. Il gel di silice tende ad assorbire umidità e conserva le proprie caratteristiche con ampie variazioni di concentrazione d'acqua. Data la sua avidità di acqua viene usato come disidratante. Un sol, lasciato a riposo, può gelificare spontaneamente e ritornare allo stato di sol per semplice agitazione (es, sospensioni acquose di caolino). Il comportamento delle sostanze organiche capaci di dare sistemi gel-sol reversibili si spiega considerando che queste molecole (tannini - formula grezza approssimata: C 76 H 52 O 46, glicogeno, amido, albumine, saponi, ecc. ) sono già di per sé molto grandi e, possedendo una lunga catena ramificata, possono intrecciarsi tra loro in modo da costituire un insieme entro il quale il solvente può essere richiamato per capillarità (rigonfiamento delle gelatine).

Mentre per le molecole organiche lo stato colloidale dipende dalla dimensione e dalla struttura di certe molecole, per le sostanze inorganiche lo stato colloidale si può ottenere con un adatto disperdente e può esistere se le particelle disperse non si riuniscono fra loro: per questo è necessario fare in modo da impedirne la coalescenza. Questa forza è di natura elettrostatica; e questo permette un'altra distinzione tra sol liofili e sol liofobi: i liofili hanno sempre una carica elettrica, che non è necessaria per i liofobi.


La Condensazione è il metodo più frequente in analisi qualitativa. Questo fenomeno avviene attraverso reazioni molto rapide: processi più lenti favorirebbero la crescita di cristalli.


N. B. la coagulazione va più propriamente intesa come la destabilizzazione esercitata da una sostanza chimica ( agente coagulante) su un sistema colloidale, mentre la f è la fase immediatamente successiva alla coagulazione, cioè la riunione dei colloidi destabilizzati in aggregati di maggiori dimensioni ( flocculi) per effetto del moto browniano o di uno stato di controllata agitazione promossa in seno alla massa fluida al fine di favorire le collisioni fra i colloidi. I flocculi sedimentano, in genere, con una velocità abbastanza elevata nella successiva fase di riposo Flocculazione La flocculazione è un processo chimico-fisico attraverso il quale ha luogo la sedimentazione delle parti solide nei colloidi. Le particelle solide disperse nelle soluzioni colloidali presentano, sulla loro superficie, cariche di segno uguale che ne impediscono l’agglomerazione. La variazione di questo stato di equilibrio, attraverso la modificazione del p. H della soluzione, il cambio di temperatura oppure l’impiego di agenti coagulanti (detti anche flocculanti) provoca l’aggregazione delle particelle. La neutralizzazione delle cariche superficiali agevola la formazione dei primi piccoli aggregati solidi che successivamente tendono a ingrossarsi per adsorbimento di particelle fino alla formazione dei primi fiocchi in sospensione.
 Sistema puro
Sistema puro Materia liceo classico
Materia liceo classico Montale nasce
Montale nasce Relazione educativa caratteristiche principali
Relazione educativa caratteristiche principali I principali metodi di separazione dei miscugli
I principali metodi di separazione dei miscugli Malavoglia temi principali
Malavoglia temi principali Cosa sono i poligoni
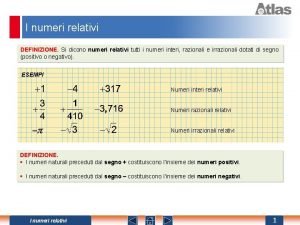
Cosa sono i poligoni Numeri relativi rappresentazione grafica
Numeri relativi rappresentazione grafica Reticolo cristallino cubico a corpo centrato
Reticolo cristallino cubico a corpo centrato Personaggi tipo o individuo
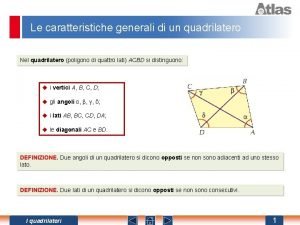
Personaggi tipo o individuo Caratteristiche dei quadrilateri
Caratteristiche dei quadrilateri Definizione quadrilatero
Definizione quadrilatero Alessandro manzoni opere principali
Alessandro manzoni opere principali Uno nessuno centomila schema
Uno nessuno centomila schema Islanda energia rinnovabile
Islanda energia rinnovabile Ritratto di monsieur bertin
Ritratto di monsieur bertin Quali sono le principali forze esogene
Quali sono le principali forze esogene Iperbato
Iperbato Fiumi e laghi europei
Fiumi e laghi europei Dante vita e opere
Dante vita e opere Subordinata indipendente
Subordinata indipendente Ugo foscolo opere principali
Ugo foscolo opere principali