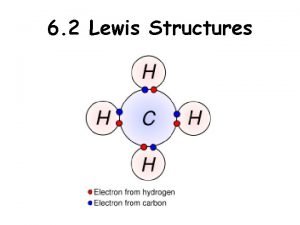
La reprsentation de Lewis La reprsentation de Lewis































- Slides: 41

La représentation de Lewis • La représentation de Lewis permet de représenter un atome et ses électrons de valence. • Le symbole de l’élément tient la place du noyau et des électrons de la couche intérieure. Les électrons de la couche de valence sont représentés par des points tracés autour du symbole. • Les représentations de Lewis sont utiles pour décrire, prévoir et expliquer la formation des composés.

Bohr-Rutherford • Le néon Ne Numéro atomique : 10 Nombre d’électrons : 10 Nombre de couche électroniques : 2

De Bohr-Rutherford à Lewis Ne

Représentation de Lewis • Voici l’ordre dans lequel on ajoute les électrons de valence : 3 6 2 1 Ne 7 4 8 5

Représentation de Lewis du fluor Numéro atomique : 9 Nombre d’électrons de valence: 7 F

Représentation de Lewis EXERCICE • Fais la notation de Lewis des 20 premiers éléments du tableau périodique. • Assure-toi de respecter l’ordre dans lequel les électrons doivent être placés.

Représentation de Lewis EXERCICE – corrigé

Exercices • Page 146 • Copier les questions et y répondre. • Faire la feuille de travail (tableau à remplir)

La formation de composés • La façon dont les atomes des éléments peuvent réagir ensemble pour former des composés dépend de leur nombre d’électrons de valence. • Une liaison chimique a lieu entre les atomes si leurs électrons de valence forment un nouvel arrangement (un composé ou une molécule) qui a moins d’énergie que le précédent (stabilité).

La formation de composés • Rappel: Il y a trois façons dont un atome peut obtenir une couche de valence semblable à celle du gaz rare le plus près. 1 e: Un atome peut donner des électrons : Lorsqu’un atome cède un électron ou plus, il forme un ion à charge positive, c’est-à-dire un cation. 2 e: Un atome peut gagner des électrons : Lorsqu’un atome gagne un électron ou plus, il forme un ion à charge négative, c’est-à-dire un anion. 3 e: Deux atomes peuvent partager une, deux ou trois paires d’électrons. Cela ne forme pas des ions mais plutôt des groupes d’atomes appelés molécules.

La formation de composés • Les substances composées d’anions et de cations sont des composés ioniques. Ils se transfèrent un ou plusieurs électrons. • L’attraction entre des ions de charges opposées est une liaison ionique. • La nouvelle substance formée est un composé ionique.

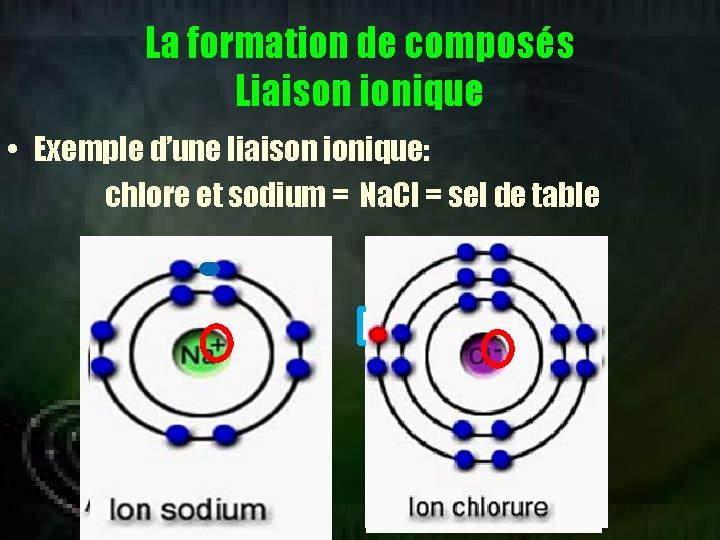
La formation de composés Liaison ionique • Exemple d’une liaison ionique: chlore et sodium = Na. Cl = sel de table

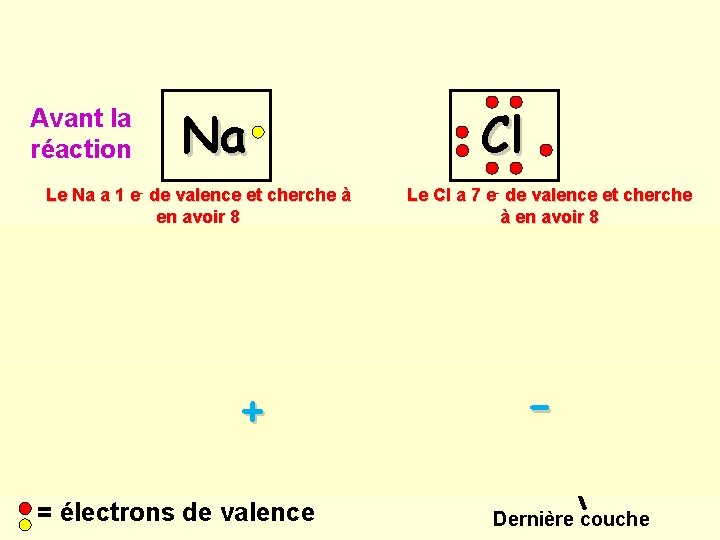
Avant la réaction Na Cl Le Na a 1 e- de valence et cherche à en avoir 8 Pendant la réaction Na Le Cl a 7 e- de valence et cherche à en avoir 8 Cl Le Na donne son e- de valence au chlore pour que celui-ci ait 8 e- de valence Après la réaction + Na Avant dernière couche = électrons de valence Cl Dernière couche

La formation de composés Liaison ionique • Les liaisons ioniques se produisent lorsqu’un métal réagit avec un non-métal. • Pourquoi? - Car les cations sont métalliques et les anions sont non métalliques.

La formation de composés « Les composés ioniques » • Exemple avec du magnésium et du chlore +2 Mg =0 Cl Cl -1 -1 • Remarquez les métaux et non-métaux. . .

La formation de composés « Les composés ioniques » • Exemple avec du magnésium et du chlore Mg + Cl +2 -1 Mg + 2 Cl

La formation de composés « Les composés ioniques » Exemple avec oxygène et calcium Ca +2 O -2 =0 • Remarquez les métaux et non-métaux. . .

La formation de composés « Les composés ioniques » • Exemple avec du magnésium et du chlore Ca + O +2 -2 Ca + O

Les propriétés des composés ioniques - Ont des points de fusion élevés car cela demande beaucoup d’énergie pour briser les forces d’attraction intenses. - Conduisent l’électricité lorsqu’ils sont dissous dans l’eau puisque les ions deviennent libres et peuvent transporter une charge. À l’état solide, ils ne conduisent pas. . . Exemples de composés ioniques: Na. Cl, Ca. Cl 2, Li. Br, Mg. O, Ca. F 2. . .

La formation de composés « la liaison covalente » • Lorsque les atomes n’ont pas suffisamment de force pour arracher un électron d’un autre atome, il vont plutôt partager leurs électrons. • Lorsque deux non-métaux se partagent des électrons, il s’agit d’une liaison covalente. • La substance formée est un composé moléculaire.

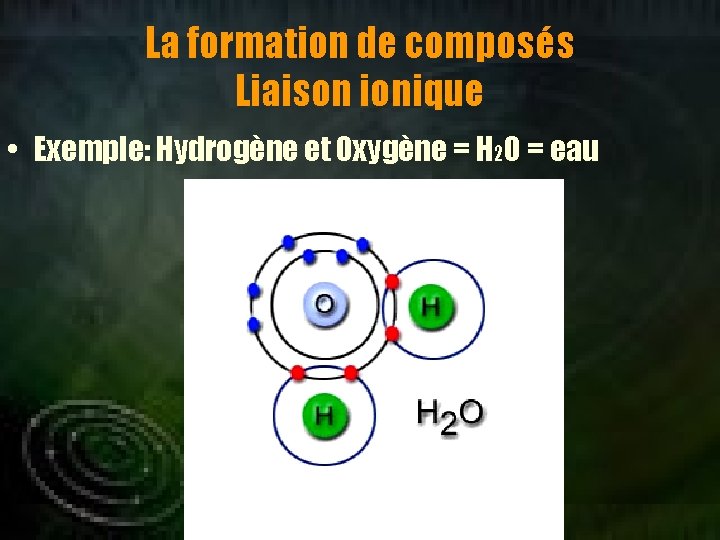
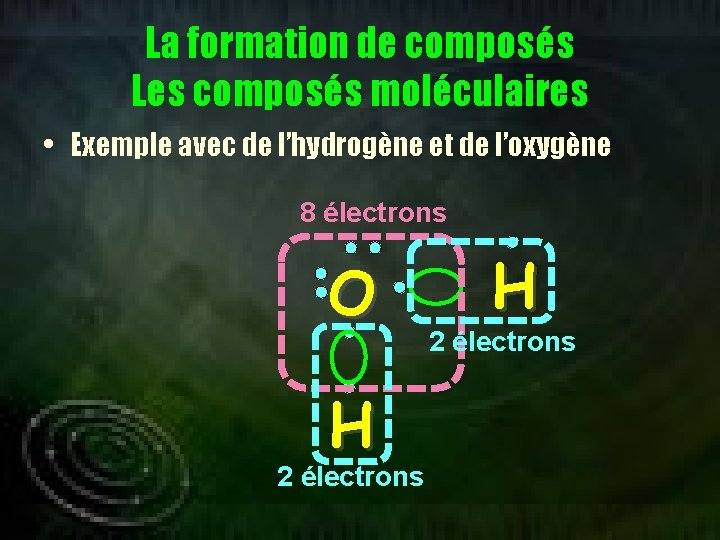
La formation de composés Liaison ionique • Exemple: Hydrogène et Oxygène = H 2 O = eau

La formation de composés Les composés moléculaires • Exemple avec de l’hydrogène et de l’oxygène 8 électrons O H 2 électrons

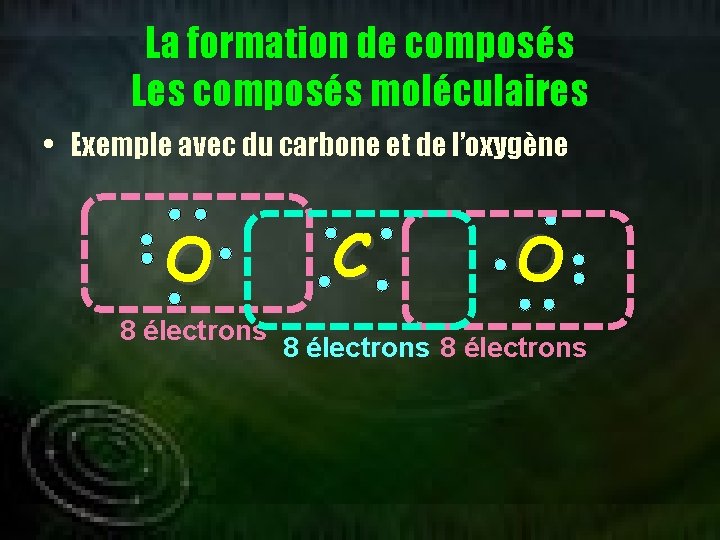
La formation de composés Les composés moléculaires • Exemple avec du carbone et de l’oxygène O C O

La formation de composés Les composés moléculaires • Exemple avec du carbone et de l’oxygène O C O

La formation de composés Les composés moléculaires • Exemple avec du carbone et de l’oxygène 8 électrons C O O 8 électrons

La formation de composés Les composés moléculaires • Exemple avec du carbone et de l’oxygène Regardez Ecrivez C O O

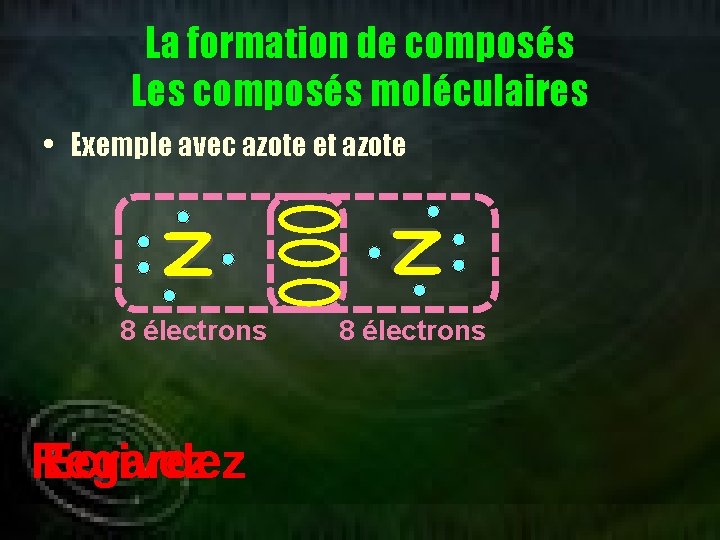
La formation de composés Les composés moléculaires • Exemple avec azote et azote N N

La formation de composés Les composés moléculaires • Exemple avec azote et azote N N

La formation de composés Les composés moléculaires N • Exemple avec azote et azote N 8 électrons Regardez Ecrivez

Les propriétés des composés moléculaires - Ont des points de fusion relativement faibles car les liens sont faciles à briser (demande peu d’énergie). - Ont tendance à ne pas conduire l’électricité car ils ne forment pas d’ions dans l’eau. Exemples de composés moléculaires: CO 2, H 2 O, Cl 2, H 2. . .

Exercice • • Illustre la liaison ionique entre les atomes suivants à l’aide de la notation de Lewis. Écris sur la ligne la formule chimique du composé formé. a) Na et Br • • b) Be et F c) K et O Illustre la liaison covalente entre les atomes suivants à l’aide de la notation de Lewis. Écris sur la ligne la formule chimique du composé formé. a) H et O b) Cl et Cl c) H et N

Exercice • Illustre la liaison ionique entre les atomes suivants à l’aide de la notation de Lewis. Écris sur la ligne la formule chimique du composé formé. Regardez • +1 Na Br =0 -1 Na. Br

Exercice • • Illustre la liaison ionique entre les atomes suivants à l’aide de la notation de Lewis. Écris sur la ligne la formule chimique du composé formé. Na + Br Ecrivez +1 -1 Na + Br Na. Br

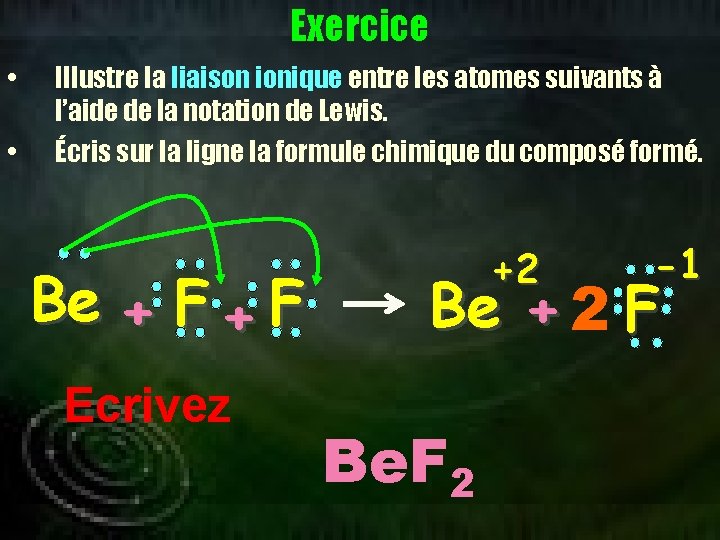
• Illustre la liaison ionique entre les atomes suivants à l’aide de la notation de Lewis. Écris sur la ligne la formule chimique du composé formé. Regardez • Exercice +2 Be =0 F F -1 -1 Be. F 2

Exercice • • Illustre la liaison ionique entre les atomes suivants à l’aide de la notation de Lewis. Écris sur la ligne la formule chimique du composé formé. Be + F Ecrivez +2 -1 Be + 2 F Be. F 2

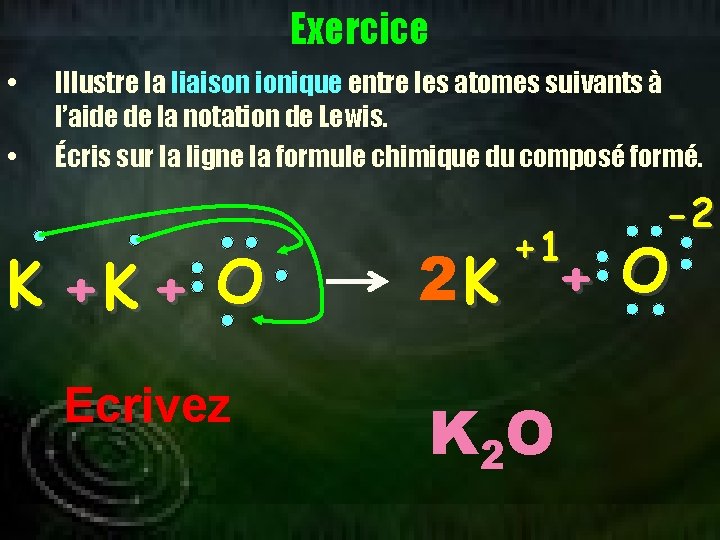
Exercice • Illustre la liaison ionique entre les atomes suivants à l’aide de la notation de Lewis. Écris sur la ligne la formule chimique du composé formé. Regardez • K +1 =0 O -2 K 2 O

Exercice • • Illustre la liaison ionique entre les atomes suivants à l’aide de la notation de Lewis. Écris sur la ligne la formule chimique du composé formé. K +K + O Ecrivez +1 -2 2 K + O K 2 O

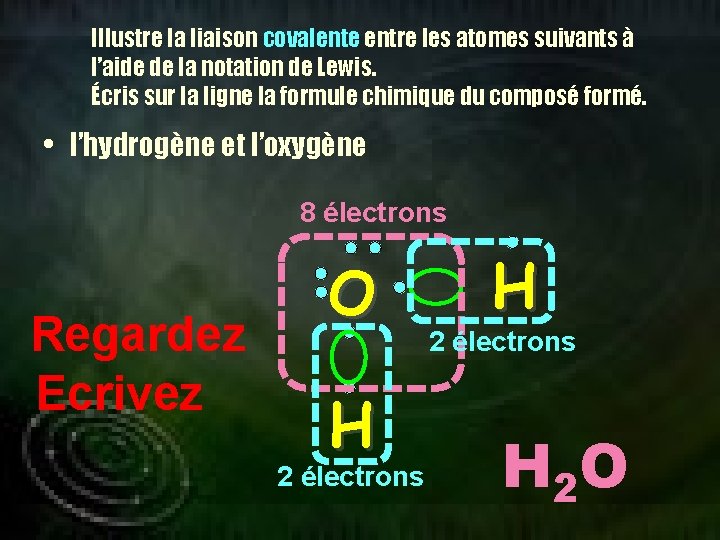
Illustre la liaison covalente entre les atomes suivants à l’aide de la notation de Lewis. Écris sur la ligne la formule chimique du composé formé. • l’hydrogène et l’oxygène 8 électrons Regardez Ecrivez O H 2 électrons H 2 O

Illustre la liaison covalente entre les atomes suivants à l’aide de la notation de Lewis. Écris sur la ligne la formule chimique du composé formé. Ecrivez Regardez 8 électrons Cl Br 2

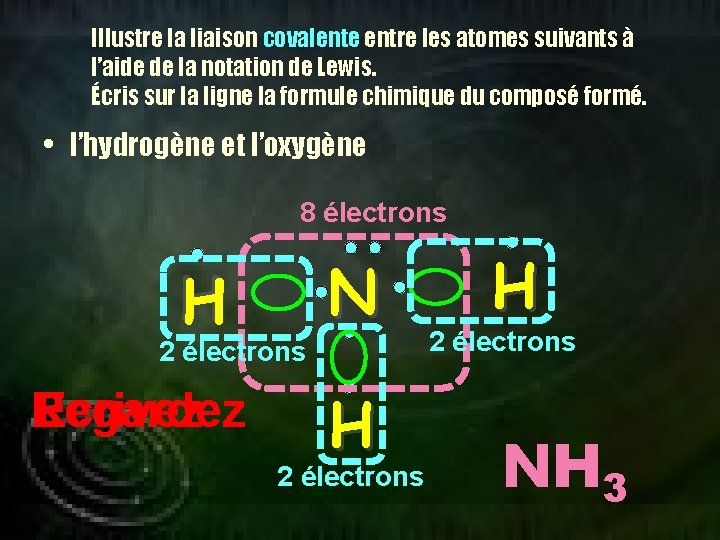
Illustre la liaison covalente entre les atomes suivants à l’aide de la notation de Lewis. Écris sur la ligne la formule chimique du composé formé. • l’hydrogène et l’oxygène 8 électrons N H 2 électrons Regardez Ecrivez H 2 électrons NH 3

Travail à faire • Travail 5 : La formation des composés Lewis et liaisons
 Lewis structure quiz
Lewis structure quiz Chop irb
Chop irb Saunders lewis and thornhill research onion
Saunders lewis and thornhill research onion Lewis faircon
Lewis faircon Xef2 lewis structure
Xef2 lewis structure Lewis and clark expedition
Lewis and clark expedition Hc2cl lewis structure
Hc2cl lewis structure Cs lewis dot structure
Cs lewis dot structure Nfh2 lewis structure
Nfh2 lewis structure Struktur geometri if2-
Struktur geometri if2- Methyl fluoride lewis structure
Methyl fluoride lewis structure Ib to ossd
Ib to ossd Ncl3o lewis structure
Ncl3o lewis structure Who is this
Who is this Anfigeno
Anfigeno Ca lewis dot structure
Ca lewis dot structure Diagrama de orbitales del azufre
Diagrama de orbitales del azufre How to draw lewis structures
How to draw lewis structures Walking away c day lewis
Walking away c day lewis Socl4 lewis structure
Socl4 lewis structure Lewis and clark journal project
Lewis and clark journal project C-s lewis structure
C-s lewis structure Covalent bonding chapter 8
Covalent bonding chapter 8 Lewis carroll elementary school calendar
Lewis carroll elementary school calendar Tylenol absorption
Tylenol absorption Sarrah lewis mega
Sarrah lewis mega Csi 3140
Csi 3140 Lewis structure h2co
Lewis structure h2co Formal charge of hcn
Formal charge of hcn Foh lewis structure
Foh lewis structure The greatest real estate deal in history answer key
The greatest real estate deal in history answer key Biopsicologico definicion
Biopsicologico definicion Lewis acid vs bronsted acid
Lewis acid vs bronsted acid Karen lewis liverpool
Karen lewis liverpool Clive staples lewis biografia
Clive staples lewis biografia Ch2os lewis structure
Ch2os lewis structure Ocl2 lewis structure
Ocl2 lewis structure Simple bonding theory
Simple bonding theory Gallium lewis dot structure
Gallium lewis dot structure Lewis structure for mgo
Lewis structure for mgo Estructura de lewis de libr
Estructura de lewis de libr John lewis keyboard and mouse
John lewis keyboard and mouse