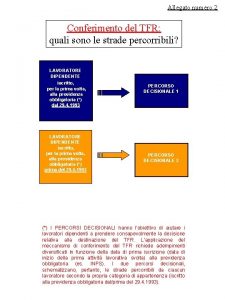
La misura del p H Quali sono le








![giallo rosso Quando [H 3 O+] >> Ka la soluzione appare gialla Quando [H giallo rosso Quando [H 3 O+] >> Ka la soluzione appare gialla Quando [H](https://slidetodoc.com/presentation_image_h/b54707f809010a86d7e0da6b727ba870/image-13.jpg)
![Indicator Behavior rearranging Equation (1) gives [In-] Ka ------ = -----[HIn] [H 3 O+] Indicator Behavior rearranging Equation (1) gives [In-] Ka ------ = -----[HIn] [H 3 O+]](https://slidetodoc.com/presentation_image_h/b54707f809010a86d7e0da6b727ba870/image-15.jpg)
![[HInd] = [Ind-] [H 3 O+] = Kind p. H=p. Kind [HInd]>=10[Ind-] [H 3 [HInd] = [Ind-] [H 3 O+] = Kind p. H=p. Kind [HInd]>=10[Ind-] [H 3](https://slidetodoc.com/presentation_image_h/b54707f809010a86d7e0da6b727ba870/image-16.jpg)















- Slides: 42

La misura del p. H Quali sono le unità di misura del p. H e che significato hanno Le unità di misura del p. H sono le unità p. H con il significato implicito nella definizione p. H = -log[H+] Una unità p. H corrisponde ad una variazione di 10 volte nella concentrazione di idrogenioni 1

La misura del p. H Quale è il significato pratico della misura del p. H Il p. H da l'indicazione numerica della acidità o della basicità di una soluzione Alcuni esempi: p. H 0 Acido cloridrico 1 N p. H 2 Succo di limone p. H 4 Birra p. H 6 Latte p. H 8 Albume d'uovo p. H 10 Latte di Magnesio p. H 12 Soda 0, 01 N p. H 14 Soda 1 N p. H 1 p. H 3 p. H 5 p. H 7 p. H 9 p. H 11 p. H 13 Acido cloridrico 0, 1 N Acido acetico 0, 1 N Formaggio Acqua pura Borace Ammoniaca 1 N Soda 0, 1 N 2

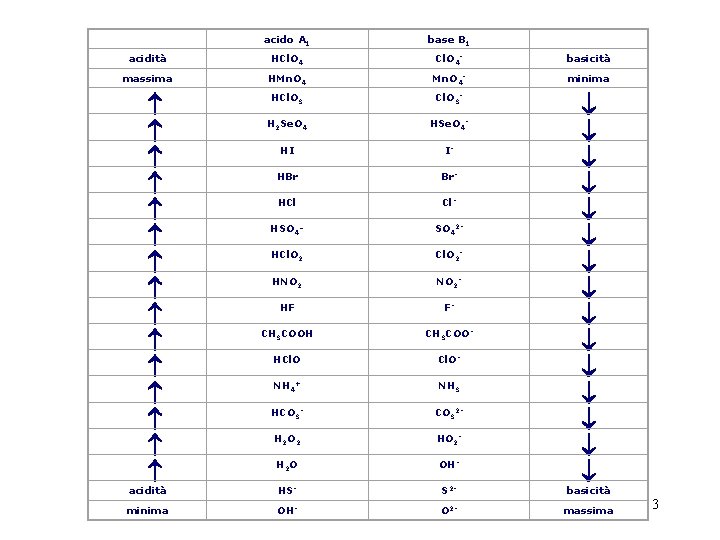
acido A 1 base B 1 acidità HCl. O 4 - basicità massima HMn. O 4 - minima HCl. O 3 - H 2 Se. O 4 HSe. O 4 - HI I- HBr Br- HCl Cl- HSO 4 - SO 42 - HCl. O 2 - HNO 2 - HF F- CH 3 COOH CH 3 COO- HCl. O- NH 4+ NH 3 HCO 3 - CO 32 - H 2 O 2 HO 2 - H 2 O OH- acidità HS- S 2 - ¯ ¯ ¯ ¯ basicità minima OH- O 2 - massima 3

Misura del p. H / 1 Con cartine o strisce indicatrici: 4

Misura del p. H / 2 La determinazione potenziometrica misura il potenziale di una cella galvanica in cui è impedito il passaggio di corrente impiegando un elettrodo il cui potenziale dipende dall’attività dello ione H+ in soluzione. E = cost + 59. 15 p. H (con E misurato in m. V) 5

Determinazione del p. H della carta per misura diretta con elettrodo speciale 6

INDICATORI DI p. H Un indicatore acido/base è un acido organico o una base debole la cui forma indissociata differisce nella colorazione della forma della sua base o del suo acido coniugato.

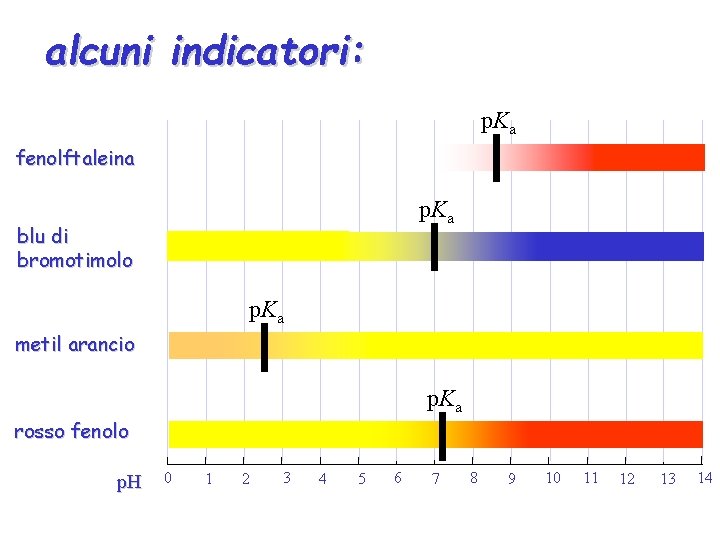
alcuni indicatori: p. Ka fenolftaleina p. Ka blu di bromotimolo p. Ka metil arancio p. Ka rosso fenolo p. H 0 1 2 3 4 5 6 7 8 9 10 11 12 13 14

Indicatori di p. H v. Coloranti organici; vp. Hmetri Coloranti organici I coloranti organici sono indicatori di p. H, che disciolti in piccolissima quantità nella soluzione di cui si vuol conoscere il p. H, indicano il valore di questo mediante ben definite colorazioni che essi impartiscono alla soluzione (che deve essere originariamente incolore o quasi). Gli indicatori di p. H sono acidi o basi deboli, e, a seconda del p. H della soluzione, le loro molecole od ioni assumono strutture ben diverse, a ciascuna delle quali corrisponde una ben determinata colorazione. Es. Indicatore Metilarancio (Acido para-dimetilammino) Questo indicatore in soluzioni a p. H > 4. 4 struttura I giallo In soluzioni a p. H < 3. 1 struttura II rosso Struttura II giallo rosso 9

Es. Si consideri un generico indicatore acido RH che in soluzione acquosa dà luogo al generico equilibrio: RH + H 2 O Rosso R - + H 3 O+ 1) giallo per il quale sono valide le relazioni: Ka = ([R-] [H 3 O+]) / [RH] e [H 3 O+] = Ka [RH] / [R-] L’aggiunta di un indicatore non altera la pre-esistente concentrazione di H 3 O+ , poiché: • Esso viene aggiunto a concentrazioni bassissime • E’ un acido debole. Quindi, gli ioni H 3 O+ che compaiono nell’equilibrio 1) sono quelli già presenti prima dell’aggiunta dell’indicatore. E’ la concentrazione di questi che determina il colore della soluzione, spostando l’equilibrio a destra (giallo). Se l’equilibrio fosse spostato a sinistra, la soluzione sarebbe rossa, mentre se [RH] = [R-], la soluzione risulterebbe color arancio. Per RH, essendo un acido debole, si può scrivere: p. H = p. Ka + log [R-] / [RH] equazione di Henderson – Hasselbach Da cui si ricavano informazioni sul p. H della soluzione 10

Riassumendo: Un indicatore consente di determinare il p. H di una soluzione solo se p. H p. Ka e questo, quindi richiede di avere a disposizione tutta una serie di indicatori con valori diversi di p. K per poter misurare con il metodo degli indicatori il p. H di una generica soluzione N. B. più che il punto di viraggio, difficile da apprezzare ad occhio nudo, si considera il CAMPO DI VIRAGGIO di un indicatore, indicando con tale termine l’intervallo di p. H che separa, per quel certo indicatore, le due colorazioni estreme nettamente distinguibili fra loro da ogni operatore. Il campo di viraggio per un indicatore si definisce, in generale: p. H (viraggio) = p. Ka ± 1 11

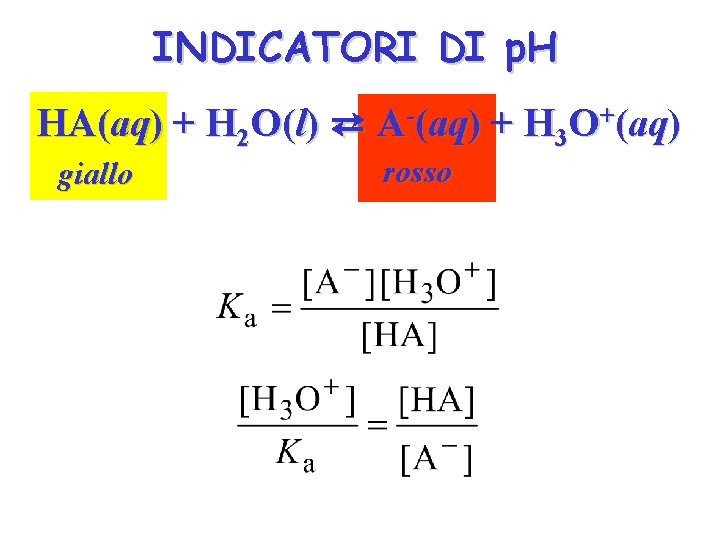
INDICATORI DI p. H HA(aq) + H 2 O(l) ⇄ A-(aq) + H 3 O+(aq) giallo rosso
![giallo rosso Quando H 3 O Ka la soluzione appare gialla Quando H giallo rosso Quando [H 3 O+] >> Ka la soluzione appare gialla Quando [H](https://slidetodoc.com/presentation_image_h/b54707f809010a86d7e0da6b727ba870/image-13.jpg)
giallo rosso Quando [H 3 O+] >> Ka la soluzione appare gialla Quando [H 3 O+] << Ka la soluzione appare rossa Quando [H 3 O+] Ka la soluzione appare arancione p. Ka = - log 10 Ka p. H 0 1 2 3 4 5 6 7 8 9 10 11 12 13 14

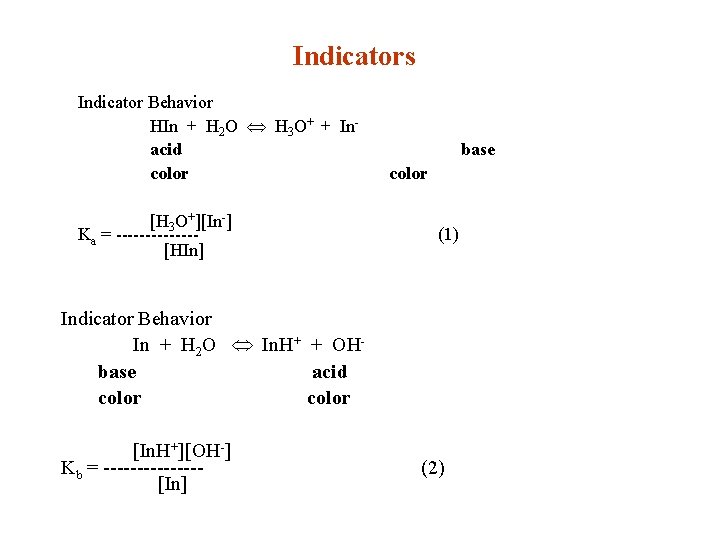
Indicators Indicator Behavior HIn + H 2 O Û H 3 O+ + Inacid color [H 3 O+][In-] Ka = -------[HIn] base color (1) Indicator Behavior In + H 2 O Û In. H+ + OHbase acid color [In. H+][OH-] Kb = -------[In] (2)
![Indicator Behavior rearranging Equation 1 gives In Ka HIn H 3 O Indicator Behavior rearranging Equation (1) gives [In-] Ka ------ = -----[HIn] [H 3 O+]](https://slidetodoc.com/presentation_image_h/b54707f809010a86d7e0da6b727ba870/image-15.jpg)
Indicator Behavior rearranging Equation (1) gives [In-] Ka ------ = -----[HIn] [H 3 O+] Indicator Behavior acid color shows when [In-] 1 [H 3 O+][In-] 1 ------ £ -------- = ---*[H 3 O+] = Ka [HIn] 10 base color shows when [In-] 1 [H 3 O+][In-] ------ ³ -------- = 10*[H 3 O+] = Ka [HIn] 10 [HIn]
![HInd Ind H 3 O Kind p Hp Kind HInd10Ind H 3 [HInd] = [Ind-] [H 3 O+] = Kind p. H=p. Kind [HInd]>=10[Ind-] [H 3](https://slidetodoc.com/presentation_image_h/b54707f809010a86d7e0da6b727ba870/image-16.jpg)
[HInd] = [Ind-] [H 3 O+] = Kind p. H=p. Kind [HInd]>=10[Ind-] [H 3 O+] >= 10 Kind p. H<=p. Kind – 1 [HInd]<=0. 1[Ind-] [H 3 O+] <= 0. 1 Kind p. H>=p. Kind + 1

Indicatori Universali Sono costituiti da miscele di indicatori che assumono 10 ÷ 12 tonalità di colore diversi a seconda del p. H della soluzione e che evitano di ripetere più volte il procedimento con più indicatori. Il valore del p. H viene determinato per confronto della colorazione assunta dalla soluzione dopo l’aggiunta dell’indicatore universale con una scala cromatica fornita insieme all’indicatore stesso. 17

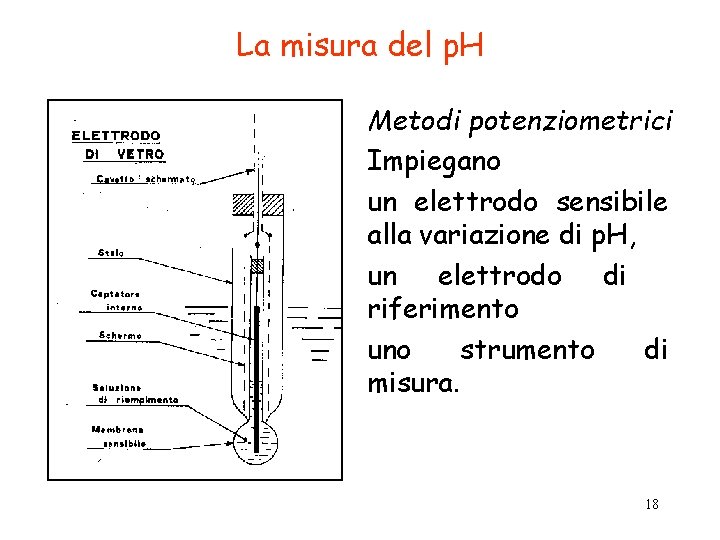
La misura del p. H Metodi potenziometrici Impiegano un elettrodo sensibile alla variazione di p. H, un elettrodo di riferimento uno strumento di misura. 18

Potenziometria Definizione Misura del potenziale elettrochimico di una cella galvanica, a corrente zero. Il potenziale di cella è governato dal potenziale di un elettrodo indicatore che risponde ai cambiamenti di attività (quindi di concentrazione) delle specie in esame. Strumentazione v. Elettrodo indicatore v. Elettrodo di riferimento v. Potenziometro v. Registratore Cella Galvanica Cella elettrochimica che produce spontaneamente corrente (od energia) quando gli elettrodi vengono collegati esternamente attraverso un filo conduttore. Trasformazione Energia Chimica Energia Elettrica 19

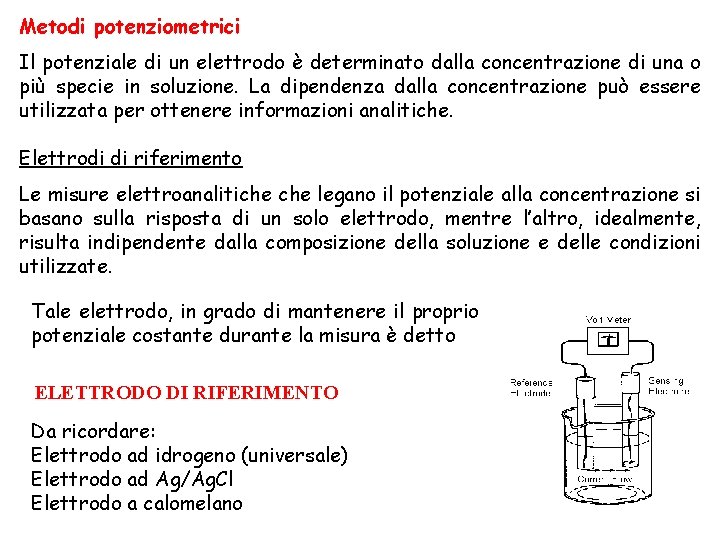
Metodi potenziometrici Il potenziale di un elettrodo è determinato dalla concentrazione di una o più specie in soluzione. La dipendenza dalla concentrazione può essere utilizzata per ottenere informazioni analitiche. Elettrodi di riferimento Le misure elettroanalitiche legano il potenziale alla concentrazione si basano sulla risposta di un solo elettrodo, mentre l’altro, idealmente, risulta indipendente dalla composizione della soluzione e delle condizioni utilizzate. Tale elettrodo, in grado di mantenere il proprio potenziale costante durante la misura è detto ELETTRODO DI RIFERIMENTO Da ricordare: Elettrodo ad idrogeno (universale) Elettrodo ad Ag/Ag. Cl Elettrodo a calomelano 20

Elettrodo standard a idrogeno. Perché sia standard occorre che la pressione di H 2 sia 1 atmosfera e che la concentrazione di H+ sia 1 molare. Il suo potenziale standard viene preso, per convenzione, come lo zero della scala dei potenziali ed è perciò un riferimento importante per definire la scala, benché esso sia piuttosto delicato da usare e sia difficile mantenerne le condizioni standard (se procede la reazione cambia infatti la concentrazione della soluzione). In effetti, anche se nella scala dei potenziali usata normalmente, i valori si considerano misurati rispetto a questo elettrodo in pratica se ne utilizzano altri, più semplici, stabili e riproducibili. 21

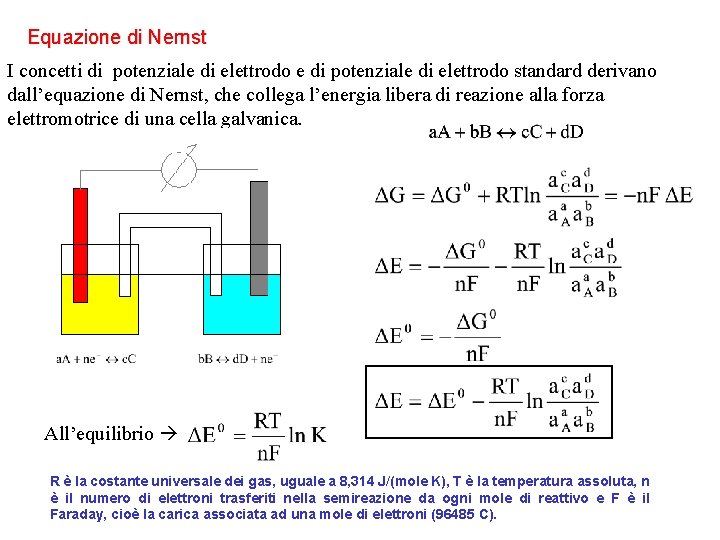
Equazione di Nernst I concetti di potenziale di elettrodo e di potenziale di elettrodo standard derivano dall’equazione di Nernst, che collega l’energia libera di reazione alla forza elettromotrice di una cella galvanica. All’equilibrio R è la costante universale dei gas, uguale a 8, 314 J/(mole K), T è la temperatura assoluta, n è il numero di elettroni trasferiti nella semireazione da ogni mole di reattivo e F è il Faraday, cioè la carica associata ad una mole di elettroni (96485 C).

L’elettrodo più comunemente usato come unità indipendente dal p. H è l’elettrodo a vetro L’azione è basata sul fenomeno per cui alcuni tipi di borosilicati sono permeabili agli ioni H+ ma non ad altri cationi o anioni Il passaggio di ioni H+ da un lato all’altro della membrana di vetro determina lo sviluppo di un potenziale elettrico attraverso la membrana

Il voltaggio misurato sarà la differenza tra i potenziali costanti ed il potenziale dell’elettrodo a vetro V E 0 – 2. 303 RT/F log [H+]1/[H+]2 [H+]1 è posta pari a 0. 1 M V E 0 + 2. 303 RT/F - 2. 303 RT/F p. H Se la concentrazione di ioni H+ di una delle soluzioni è fissa, il potenziale sarà proporzionale al p. H dell’altra soluzione V cost - 2. 303 RT/F p. H Il voltaggio generato è direttamente proporzionale al p. H

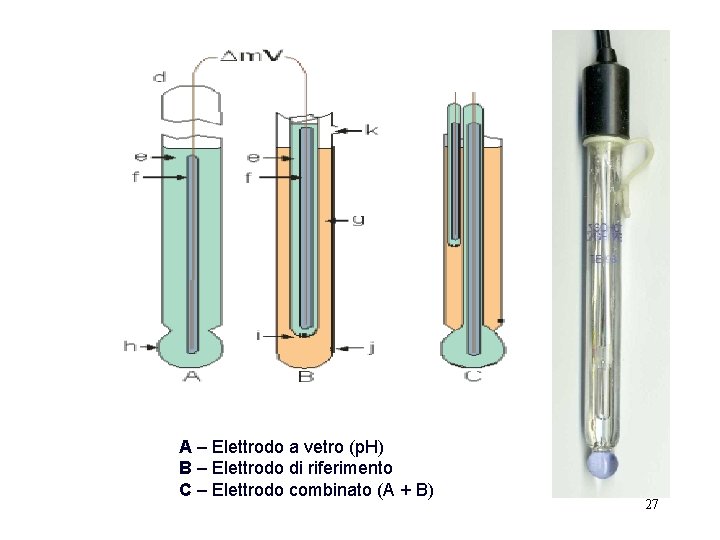
Elettrodo a vetro per la misura del p. H L'elettrodo a vetro è un particolare elettrodo a membrana che rappresenta il tipo di sonda più usato nei laboratori chimici per la misura del p. H di soluzioni acquose tramite un potenziometro. Essendo necessari due elettrodi per la misura del p. H (uno di misura e uno di riferimento), gli elettrodi a vetro disponibili sul mercato combinano in un unico corpo sia l'elettrodo a vetro vero e proprio, che funge da elettrodo di misura, con un secondo elettrodo interno, di riferimento. Un elettrodo a vetro di questo genere viene detto "combinato". L'elettrodo a vetro deve il nome al fatto che sua la parte sensibile al p. H è una sottile membrana di vetro (sensibile agli ioni H+); il potenziale elettrico che si viene a creare sui due lati - interno e esterno - della membrana è funzione del p. H della soluzione in cui la sonda viene immersa. 25

Elettrodo di lavoro H+ H+ Membrana di vetro Setto poroso H+, Cl-, Ag. Cl (HCl 0, 1 M) (saturo) Ag Elettrodo di riferimento Potenziale dovuto a differenze di concentrazione di H+ tra la parete interna e esterna della membrana Esso è costituito da un piccolo tubo di vetro molto sottile (membrana di vetro) terminante con un bulbo. All'interno del tubo è posta una soluzione tampone (cioè a p. H noto) nella quale è posto un filo di platino necessario per il collegamento elettrico. Tra le due superfici della sottile membrana di vetro si crea una differenza di potenziale che è funzione della differenza di p. H esistente fra la soluzione interna (a p. H noto) e quella esterna (a p. H incognito) (vedi figura lucido seguente) I due elettrodi sono collegati al p. Hmetro, nel quale un'apposita amplificazione della differenza di potenziale viene evidenziata tramite segnale analogico e misurata in m. V. 26

A – Elettrodo a vetro (p. H) B – Elettrodo di riferimento C – Elettrodo combinato (A + B) 27

Elettrodi ad argento / argento cloruro Un elettrodo di argento in una soluzione di cloruro di potassio saturata con argento cloruro (potenziale + 0, 199 V a 25 °C ) Potenziale o fem di un riferimento Ag/Ag. Cl/Cl- elettrodo di Equazione di Nerst 28

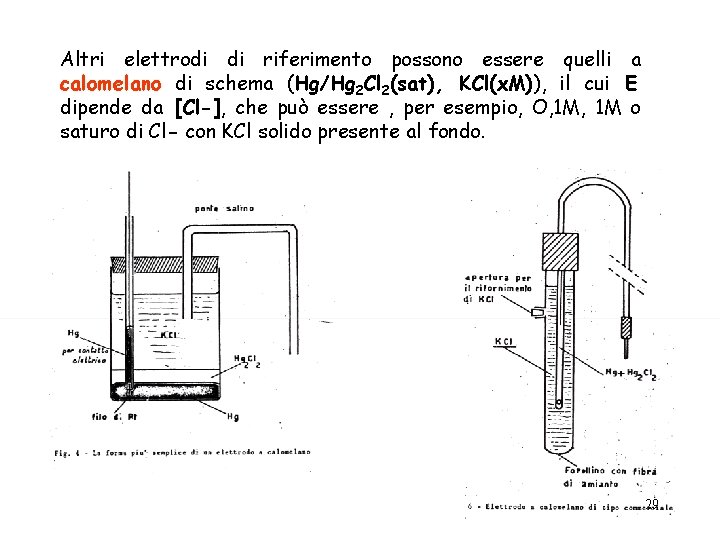
Altri elettrodi di riferimento possono essere quelli a calomelano di schema (Hg/Hg 2 Cl 2(sat), KCl(x. M)), il cui E dipende da [Cl-], che può essere , per esempio, O, 1 M o saturo di Cl- con KCl solido presente al fondo. 29

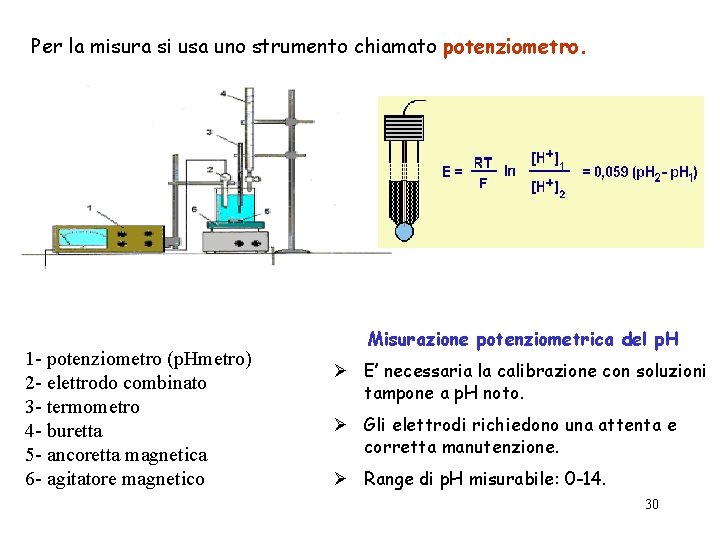
Per la misura si usa uno strumento chiamato potenziometro. 1 - potenziometro (p. Hmetro) 2 - elettrodo combinato 3 - termometro 4 - buretta 5 - ancoretta magnetica 6 - agitatore magnetico Misurazione potenziometrica del p. H Ø E’ necessaria la calibrazione con soluzioni tampone a p. H noto. Ø Gli elettrodi richiedono una attenta e corretta manutenzione. Ø Range di p. H misurabile: 0 -14. 30

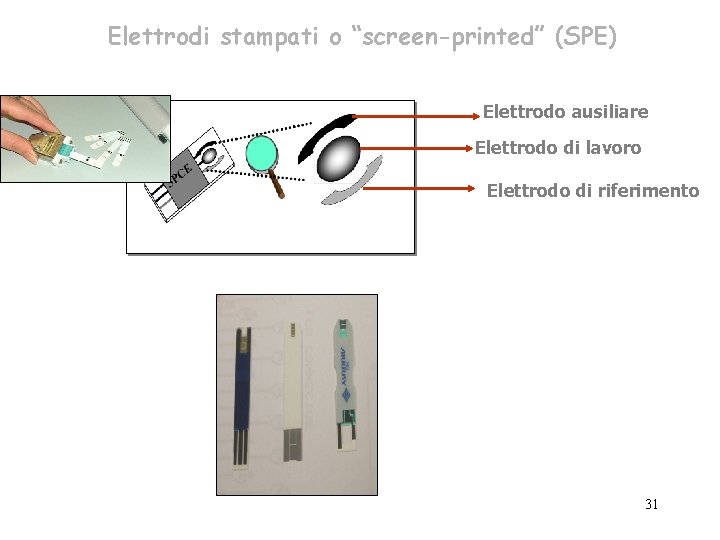
Elettrodi stampati o “screen-printed” (SPE) Elettrodo ausiliare Elettrodo di lavoro Elettrodo di riferimento 31

CLASSIFICAZIONE DEGLI ELETTRODI Gli elettrodi impiegati per la misurazione dell'attività di un certo analita sono chiamati elettrodi indicatori. Per misurarne il potenziale, gli elettrodi indicatori devono essere accoppiati ad un elettrodo di riferimento, cioè ad un elettrodo a potenziale noto, Vrif, in modo che dal valore sperimentale della differenza di potenziale misurata ai capi della cella elettrochimica così realizzata, DV, si possa risalire per differenza al potenziale dell'elettrodo indicatore. Gli elettrodi di riferimento ideali dovrebbero avere un potenziale noto e costante (anche qualora la cella sia attraversata da una corrente elettrica di bassa intensità) oltre che indipendente dalla composizione della soluzione in cui deve essere immerso. Entrambi i tipi di elettrodi dovrebbero essere di facile costruzione e robusti. Non tutte queste condizioni possono essere rispettate rigorosamente. 32

Tipi di semielementi Semielementi di PRIMA SPECIE: elettrodo metallico immerso in una soluzione elettrolitica contenente i suoi ioni (pila Daniell) Semielementi di SECONDA SPECIE: elettrodo metallico a contatto con una fase solida formata da un sale poco solubile del metallo e con una soluzione elettrolitica avente l’anione in comune con il sale poco solubile (elettrodi a calomelano e ad argento-cloruro d’argento) Semielementi A GAS: elettrodo inerte (Pt, Au) a contatto con un gas e immerso in una soluzione elettrolitica contenente l’anione o il catione corrispondente al gas (elettrodi ad idrogeno e ad ossigeno) Pt H 2(s) Ag Me Cl-(aq) Ag. Cl(s Mez+(a ) H 3 O+(aq) q) Prima specie Seconda specie A gas

Gli elettrodi sono classificabili come elettrodi di Ia e IIa specie, elettrodi di ossidoriduzione ed elettrodi a membrana. Gli elettrodi di Ia specie M/Mn+ sono costituiti da un metallo immerso in una soluzione di suoi ioni. La corrispondente reazione elettrodica è la seguente Mn+ + ne- = M L'elettrodo di zinco e quello di rame usati nella pila Daniell sono di Ia specie. Il potenziale degli elettrodi di Ia specie dipende quindi dall'attività dei cationi del metallo elettrodico. Un elettrodo di Ia specie ad Ag/Ag+ può essere utilizzato per 34 misurare il p. Ag nel corso di una titolazione di precipitazione dei cloruri.

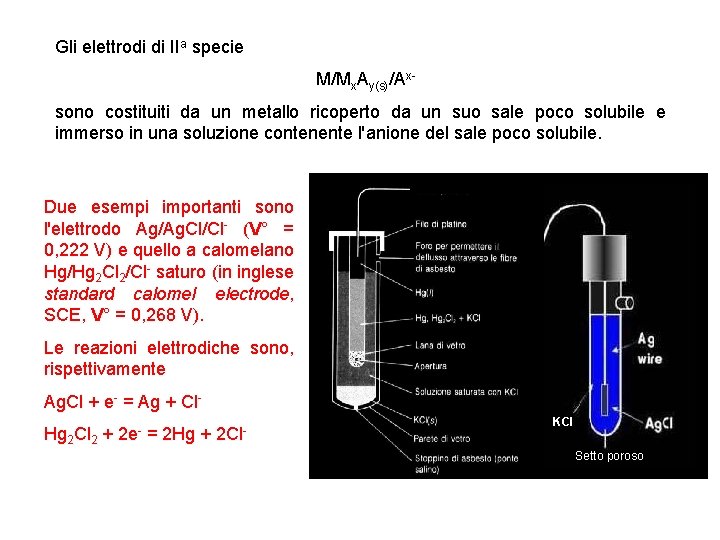
Gli elettrodi di IIa specie M/Mx. Ay(s)/Axsono costituiti da un metallo ricoperto da un suo sale poco solubile e immerso in una soluzione contenente l'anione del sale poco solubile. Due esempi importanti sono l'elettrodo Ag/Ag. Cl/Cl- (V° = 0, 222 V) e quello a calomelano Hg/Hg 2 Cl 2/Cl- saturo (in inglese standard calomel electrode, SCE, V° = 0, 268 V). Le reazioni elettrodiche sono, rispettivamente Ag. Cl + e- = Ag + Cl. Hg 2 Cl 2 + 2 e- = 2 Hg + 2 Cl- KCl Setto poroso 35

Gli elettrodi di IIa specie sono usati spesso come elettrodi di riferimento. Si pensi ad un elettrodo ad Ag/Ag. Cl/Cl- immerso in una soluzione satura di KCl: dato che la concentrazione di cloruro è costante in quanto determinata dal prodotto di solubilità del KCl, il potenziale elettrodico è costante (e tale rimane ammesso che l'elettrodo non venga attraversato da una quantità di corrente così elevata da modificare significativamente la concentrazione del cloruro). Gli elettrodi a gas sono elettrodi di ossidoriduzione nei quali uno dei componenti della coppia di ossidoriduzione è presente allo stato gassoso a pressione e temperatura ambiente. L'elettrodo a idrogeno è il più noto tra quelli a gas. 36

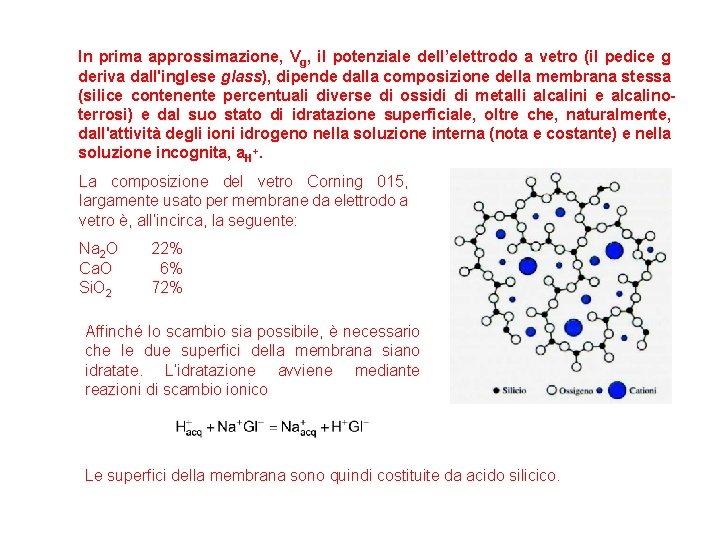
In prima approssimazione, Vg, il potenziale dell’elettrodo a vetro (il pedice g deriva dall'inglese glass), dipende dalla composizione della membrana stessa (silice contenente percentuali diverse di ossidi di metalli alcalini e alcalinoterrosi) e dal suo stato di idratazione superficiale, oltre che, naturalmente, dall'attività degli ioni idrogeno nella soluzione interna (nota e costante) e nella soluzione incognita, a. H+. La composizione del vetro Corning 015, largamente usato per membrane da elettrodo a vetro è, all’incirca, la seguente: Na 2 O Ca. O Si. O 2 22% 6% 72% Affinché lo scambio sia possibile, è necessario che le due superfici della membrana siano idratate. L’idratazione avviene mediante reazioni di scambio ionico Le superfici della membrana sono quindi costituite da acido silicico.

MISURAZIONI POTENZIOMETRICHE DEL p. H CON ELETTRODO A VETRO Gli elettrodi a vetro sono uno strumento notevolmente versatile per la misura del p. H nelle condizioni più diverse: possono essere usati in soluzioni contenenti ossidanti forti, riducenti forti, proteine e gas; possono essere usati per determinare il p. H di fluidi viscosi o anche semisolidi; per applicazioni speciali sono disponibili microelettrodi per la misura del p. H in una goccia (o meno) di soluzione, nella cavità di un dente, o nel sudore sulla pelle, o che permettono la misura del p. H all'interno di una cellula vivente, elettrodi robusti da inserire in un flusso di liquido corrente per garantire un monitoraggio continuo del p. H (on-line); elettrodi miniaturizzati possono essere ingeriti per misurare l'acidità del contenuto dello stomaco (l'elettrodo di calomelano viene tenuto in bocca). Recentemente è apparso sul mercato un nuovo tipo di elettrodo per p. H a stato solido. I vantaggi di questo tipo di elettrodo rispetto all'elettrodo a vetro sono la piccola dimensione, la robustezza, la rapidità di risposta ed una bassa impedenza di uscita. 38

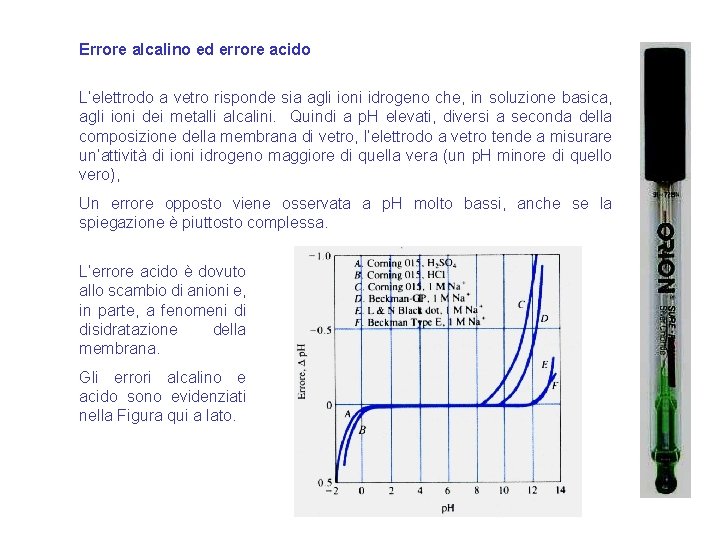
Errore alcalino ed errore acido L’elettrodo a vetro risponde sia agli ioni idrogeno che, in soluzione basica, agli ioni dei metalli alcalini. Quindi a p. H elevati, diversi a seconda della composizione della membrana di vetro, l’elettrodo a vetro tende a misurare un’attività di ioni idrogeno maggiore di quella vera (un p. H minore di quello vero), Un errore opposto viene osservata a p. H molto bassi, anche se la spiegazione è piuttosto complessa. L’errore acido è dovuto allo scambio di anioni e, in parte, a fenomeni di disidratazione della membrana. Gli errori alcalino e acido sono evidenziati nella Figura qui a lato. 39

Nonostante la misurazione del p. H sia forse la più comune in campo chimico, essa è soggetta a numerosi tipi di errore. L'errore alcalino. L'elettrodo a vetro ordinario diventa sensibile agli ioni di metalli alcalini e dà letture basse a valori di p. H maggiori di 9. L'errore acido. I valori registrati dall'elettrodo a vetro tendono ad essere un po' alti quando il p. H è inferiore a circa 0. 5. Disidratazione. La disidratazione. Una membrana disidratata può provocare una irregolare prestazione dell'elettrodo. La forza ionica insufficiente. Si è trovato che errori significativi (di 1 o 2 unità di p. H) possono verificarsi quando il p. H di campioni a bassa forza ionica, come l'acqua di lago o di torrente, viene misurato con un sistema di elettrodi vetro/calomelano. È stato dimostrato che la fonte primaria di tali errori è l’irriproducibilità dei potenziali di giunzione. Il potenziale di giunzione. Una importante fonte di incertezza che non si può correggere è la variazione nel potenziale di giunzione risultante da differenze di composizione tra lo standard e la soluzione incognita. Il p. H dei tamponi standard. Qualsiasi imprecisione nella preparazione del tampone usato per la calibrazione o qualsiasi cambiamento nella sua composizione durante la conservazione provoca un errore nelle successive misure del p. H. L'azione dei batteri sui componenti di un tampone organico costituisce una comune causa di deterioramento. 40

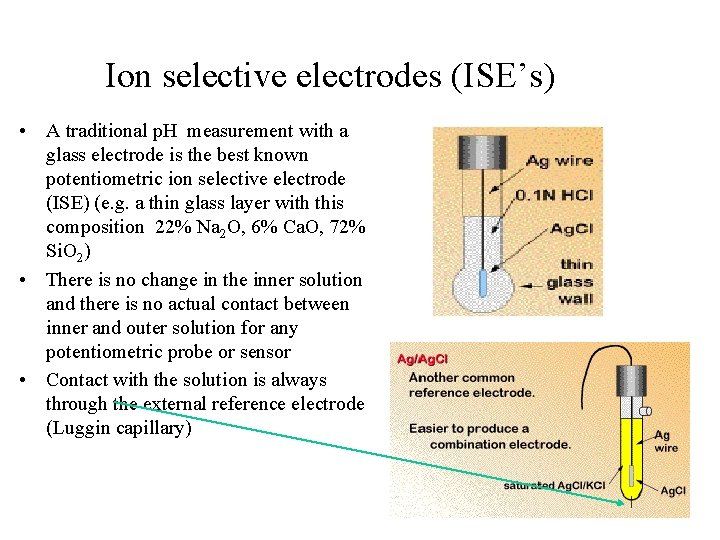
Ion selective electrodes (ISE’s) • A traditional p. H measurement with a glass electrode is the best known potentiometric ion selective electrode (ISE) (e. g. a thin glass layer with this composition 22% Na 2 O, 6% Ca. O, 72% Si. O 2) • There is no change in the inner solution and there is no actual contact between inner and outer solution for any potentiometric probe or sensor • Contact with the solution is always through the external reference electrode (Luggin capillary)

Variando opportunamente la composizione del vetro è possibile rendere la membrana sensibile alla variazione di altri ioni (Na+, K+, ecc. ). Esistono inoltre elettrodi a membrana: a stato solido, nei quali la membrana è uno strato uniforme di un'opportuna sostanza solida omogenea (per esempio gli elettrodi a cloruro, bromuro, ioduro e fluoruro); a membrana plastica (per esempio gli elettrodi sensibili allo ione calcio, al nitrato ecc. ); a membrana per gas, nei quali il gas dissolto in soluzione (NH 3, CO 2) diffonde, attraverso una membrana opportuna, in un piccolo volume di soluzione tampone specifica: la reazione del gas con il tampone provoca la variazione di p. H rilevata dall'elettrodo a vetro per p. H contenuto all'interno dell'elettrodo a gas; In definitiva, gli elettrodi a membrana, o elettrodi iono-specifici (ISE: ion specific electrodes) disponibili sul mercato permettono la determinazione di cationi (Cd 2+, Ca 2+, Cu 2+, Pb 2+, Ag+, ecc. ), anioni (alogenuri, CN-, NO 3 -, NO 2 -, Cl. O 4 -, S 2 -, ecc. ) e specie gassose (NH 3, CO 2, Cl 2, O 2, ecc. ). Dato che gli elettrodi a vetro e molti elettrodi a membrana presentano una resistenza elettrica molto elevata (nella maggior parte dei casi compresa tra 10 e 100 M ), le misure di p. H richiedono l'uso di voltmetri elettronici aventi una resistenza interna particolarmente elevata. 42
 Quali sono i limiti del modello atomico di rutherford
Quali sono i limiti del modello atomico di rutherford Linea gerarchica sicurezza
Linea gerarchica sicurezza Quali sono le fasi del salto in lungo
Quali sono le fasi del salto in lungo Ogni lim ha il suo software autore
Ogni lim ha il suo software autore Le fasi del ciclo cliente
Le fasi del ciclo cliente Quali sono le avanguardie artistiche del 900
Quali sono le avanguardie artistiche del 900 Verifica parti invariabili del discorso
Verifica parti invariabili del discorso Il portamento rilassato
Il portamento rilassato Fiumi che nascono dagli appennini
Fiumi che nascono dagli appennini Definizione di barriere e facilitatori
Definizione di barriere e facilitatori Tic cos'è
Tic cos'è Animali pluricellulari
Animali pluricellulari Quali sono le norme giuridiche
Quali sono le norme giuridiche Che cos'è una preposizione
Che cos'è una preposizione Crediti inesigibili scritture contabili
Crediti inesigibili scritture contabili Macchine semplici mappa concettuale
Macchine semplici mappa concettuale Lipidi semplici e complessi
Lipidi semplici e complessi Quali sono i valori cortesi
Quali sono i valori cortesi Scheletro vertebrati
Scheletro vertebrati Cosa sono le proiezioni in geometria
Cosa sono le proiezioni in geometria Pirito santo
Pirito santo Quali sono gli stili di insegnamento?
Quali sono gli stili di insegnamento? Organi di garanzia costituzionale
Organi di garanzia costituzionale Cosa sono le fonti cristiane
Cosa sono le fonti cristiane Competenze sociali quali sono
Competenze sociali quali sono Definizione di sostanza pura
Definizione di sostanza pura Slidetodoc
Slidetodoc Esperimento miscugli e soluzioni
Esperimento miscugli e soluzioni Quali sono gli elementi fondamentali dello stato
Quali sono gli elementi fondamentali dello stato Che cosa sono le forze endogene
Che cosa sono le forze endogene Principi gestaltici
Principi gestaltici Pronomi misti tabella
Pronomi misti tabella Poligoni regolari e irregolari
Poligoni regolari e irregolari Tipi di giurisdizione
Tipi di giurisdizione Aggettivi esclamativo
Aggettivi esclamativo Aerofoni quali sono
Aerofoni quali sono Forma interrogativa in francese esercizi
Forma interrogativa in francese esercizi Le forze endogene ed esogene
Le forze endogene ed esogene Islanda energia rinnovabile
Islanda energia rinnovabile Gli strumenti dello storico
Gli strumenti dello storico Quali sono le sostanze pure
Quali sono le sostanze pure Frazioni equivalenti a 5/21
Frazioni equivalenti a 5/21 Quali sono i paradigmi della comunicazione
Quali sono i paradigmi della comunicazione