Dalle sostanze pure ai miscugli ITIS Othoca Oristano

















































- Slides: 57

Dalle sostanze pure ai miscugli ITIS Othoca – Oristano Corso di Chimica del biennio Industriale Docente: Luciano Canu

La materia ►La chimica studia la materia e il suo comportamento ►La materia è formata: ¿ Da individui chimici denominati sostanze (tutte le sostanze sono chimiche) ¿ Queste possono essere classificate in ÙSostanze naturali, reperibili in natura e che non abbiano subito trattamenti chimici ÙSintetiche (o artificiali), prodotte dall’uomo in laboratorio o in impianti industriali Attività: cerca su un motore di ricerca il termine «sostanza chimica» e nota in quale contesto è usato questo termine. Cerca anche i termini «sostanza naturale» e «sostanza artificiale» o «di sintesi» e annotale sul quaderno

Le sostanze (pure) ►È una porzione di materia con una composizione chimica costante ►È considerato un individuo chimico ¿ Perché le sue caratteristiche fisiche e chimiche sono uniche e caratterizzanti ►Una definizione operativa afferma che ¿ È pura una sostanza che, nonostante i ripetuti sistemi di purificazione, si mantiene inalterata ►È pura una sostanza formata da particelle tutte uguali

Le proprietà delle sostanze ►Una sostanza pura presenta le stesse proprietà fisiche e chimiche ¿ In ogni sua parte ¿ In ogni suo campione ►Per esempio ¿ ¿ Densità Punto di fusione o di ebollizione Conducibilità termica o elettrica Capacità di reagire con l’ossigeno (chimica) ►Sono proprietà (grandezze) intensive

Tipi si sostanze ►Le sostanze pure si dividono in: ¿ Sostanze elementari, Ùsostanze che non si possono suddividere in sostanze più semplici (con metodi fisici o chimici) ¿ Sostanze composte (o composti) Ùsostanze che si possono suddividere in sostanze più semplici (solo con metodi chimici)

Sostanze elementari ►Sostanze formate da un solo tipo di atomo ►N 2 azoto ►H 2 idrogeno ►Cl 2 cloro ►O 2 ossigeno e O 3 ozono sono allotropi dell’ossigeno ►S 8 zolfo plastico ►P 4 fosforo rosso ►C diamante e grafite: allotropi ►Cu rame ►Ag argento ►Sn stagno ►Fe ferro ►He elio (gas monoatomico) ►Ne neon (gas monoatomico)

Composti ►Sostanze formate da almeno due elementi diversi ¿ ¿ ¿ H 2 O acqua C 6 H 12 O 6 glucosio CO 2 anidride carbonica NH 3 ammoniaca HCl acido cloridrico Na. OH idrossido di sodio Ca(OH)2 idrossido di calcio Al 2(SO 4)3 solfato di alluminio NO 2 biossido di azoto H 3 PO 4 acido fosforico Na. HCO 3 bicarbonato di sodio Attività: scrivi, per gli ultimi 5 composti, l’elenco degli elementi che lo formano indicando anche quanti atomi di ciascuno

Le sostanze pure esistono? ►Non esistono in realtà ►In una sostanza che consideriamo pura sono sempre presenti ¿ Tracce di altre sostanze ►Nessun metodo di separazione o di purificazione è efficiente al 100% ►Il concetto di purezza è teorico, irraggiungibile

Le formule chimiche ► Sono sistemi di simboli e indici numerici che permettono di rappresentare in forma sintetica e veloce le particelle che formano una sostanza (molecole) ► Forniscono 2 tipi di informazioni Quindi l’acido solforico è formato da: 2 atomi di idrogeno 1 di zolfo 4 di ossigeno Qualitativa (simboli): quali elementi formano la sostanza Quantitativa (indici): quanti atomi di ciascun elemento

Dalle sostanze ai miscugli ►Tutte le sostanze quindi in natura ¿ Si presentano insieme con altre sostanze ►Se una sostanza è presente in quantità preponderanti e le altre sono presenti in tracce abbiamo ¿ Sostanza impura ►Se le percentuali delle sostanze sono paragonabili abbiamo ¿ Miscuglio o miscela

Dalle sostanze ai miscugli 2 ►Nel mondo che ci circonda le sostanze pure non esistono ¿ Aria pura perché non sono presenti inquinanti (sostanze tossiche, polveri, microrganismi, ecc. ) ¿ Acqua pura perché non sono presenti inquinanti (sostanze tossiche, microrganismi, ecc. ) ma contiene sali minerali, microrganismi, ossigeno, CO 2. ►In realtà tutto ciò che ci circonda, con rarissime eccezioni, è costituito da insiemi di più sostanze ►Tali insiemi sono denominati miscugli

Miscugli (o miscele) ►Sono porzioni di materia (porzioni di universo – sistemi) formate da almeno due sostanze (componenti) Attività: osserva la figura a destra e stabilisci se quello vedi è un miscuglio spiegando il perché della tua decisione Sale (Na. Cl) Ferro (Fe)

Sistemi e miscugli ► Sistema ¿ Porzione di materia messa sotto osservazione confini ben delimitati ¿ Può essere formato anche da un solo componente come da milioni ¿ Un sistema può essere una sostanza in 2 fasi diverse Ù Acqua+ghiaccio (1 solo componente ma 2 fasi) Ù Sistema eterogeneo ma non è un miscuglio ► Miscuglio ¿ Porzione di materia messa sotto osservazione confini ben delimitati ¿ Deve essere composto da almeno 2 componenti ¿ Un miscuglio non può essere formato da una sola sostanza in 2 fasi diverse Ù Acqua + sale è un miscuglio (2 componenti ma 1 sola fase) Ù Miscuglio omogeneo e anche sistema omogeneo

Classificazione dei miscugli ►Possono essere suddivisi in 2 tipologie ¿ Miscugli eterogenei (etero=diverso) ¿ Miscugli omogenei (omo=lo stesso)

Miscugli omogenei ►hanno una composizione costante da punto ¿ presentano proprietà tipiche del miscuglio e non quelle dei componenti ¿ queste proprietà dipendono dalla composizione del miscuglio

Le soluzioni ►I miscugli omogenei possono essere anche chiamati soluzioni ►Nelle soluzioni si individuano 2 tipi di sostanze ¿ Il solvente, è presente in maggiore quantità ed è solitamente liquido ¿ I soluti, che possono essere solidi, liquidi o aeriformi ►Per queste indicazioni possono esserci delle eccezioni

Classificare le soluzioni ►Possono essere classificate in base allo stato fisico della soluzione ¿ solide ¿ liquide ¿ aeriformi ►In genere lo stato della soluzione dipende dallo stato fisico del solvente

Le soluzioni liquide ►Il miscuglio si presenta con un aspetto liquido ►I soluti che possono esservi disciolti possono essere ¿ ¿ Aeriformi Liquidi Solidi Una combinazione di questi Attività: proponi esempi di soluzioni di questo tipo che conosci

Soluzioni con soluto solido ►Gli sciroppi per preparare le granite sono soluzioni acquose in cui il soluto principale, lo zucchero, è un solido

Soluzioni con soluto liquido ►Un esempio è costituito dal carburante dei ciclomotori: il soluto è l’olio lubrificante che è sciolto nella benzina, il solvente ►Anche la benzina è una miscela di liquidi chiamati idrocarburi ►Tutte le bevande alcoliche sono soluzioni di liquido in liquido

Soluzioni con soluto aeriforme ►I pesci sopravvivono in acqua perché vi è disciolto l’ossigeno ►Ammoniaca e acido cloridrico sono dei gas disciolti in acqua ►Tutte le bevande gasate, in cui è disciolta CO 2 in acqua

Soluzioni aeriformi ►L’aria per tanti secoli è stata considerata un elemento costitutivo dell’universo ►In realtà l’aria è un esempio tipico di soluzione aeriforme cioè formato da diversi gas (azoto e ossigeno ed altro) ►Una soluzione di aeriformi è sempre aeriforme ►I miscugli di aeriformi sono sempre omogenei

Soluzioni solide ►Gli unici esempi di soluzioni solide sono le leghe metalliche ►Le leghe possono ottenersi solo passando attraverso lo stato fuso dei metalli

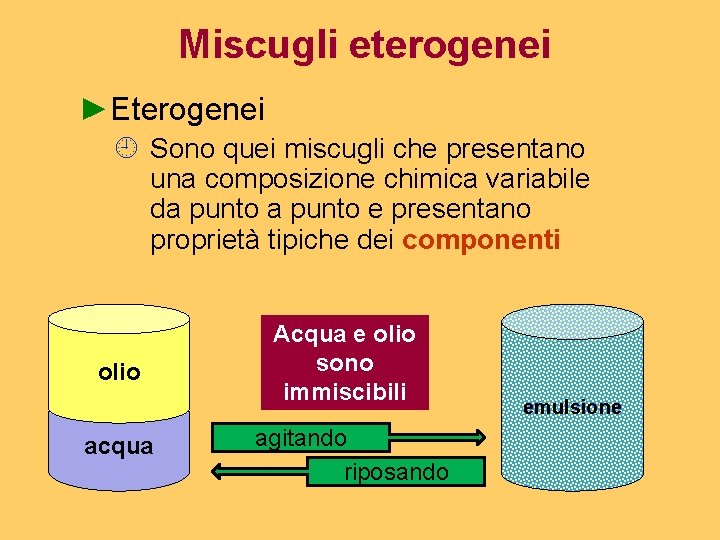
Miscugli eterogenei ►Eterogenei ¿ Sono quei miscugli che presentano una composizione chimica variabile da punto e presentano proprietà tipiche dei componenti olio acqua Acqua e olio sono immiscibili agitando riposando emulsione

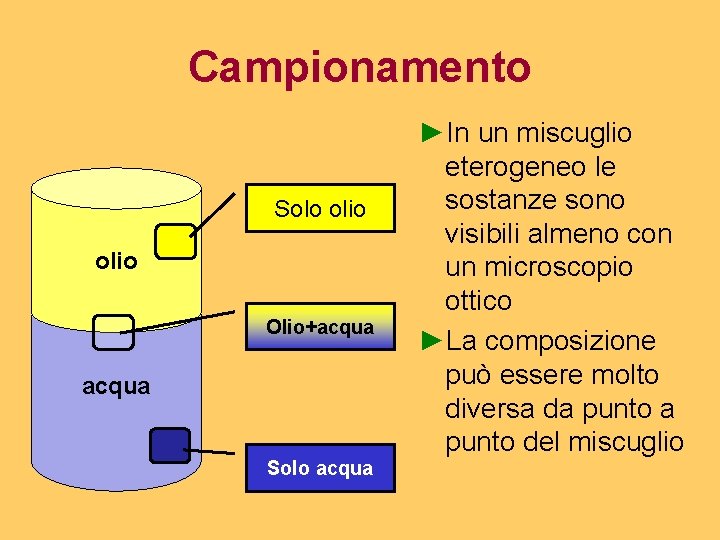
Campionamento Solo olio Olio+acqua Solo acqua ►In un miscuglio eterogeneo le sostanze sono visibili almeno con un microscopio ottico ►La composizione può essere molto diversa da punto del miscuglio

Le dispersioni ►I miscugli eterogenei possono essere anche chiamati Dispersioni ►In una dispersione si individuano ¿ Sostanza o fase disperdente ¿ Sostanze o fasi disperse

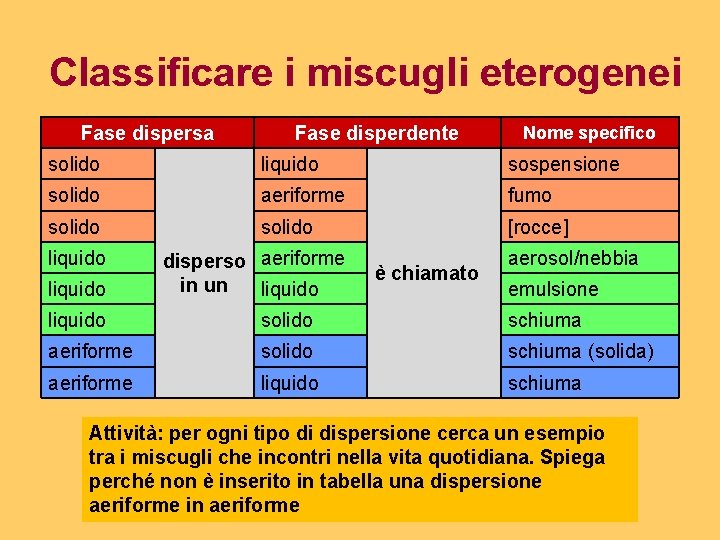
Classificare i miscugli eterogenei Fase dispersa Fase disperdente Nome specifico solido liquido sospensione solido aeriforme fumo solido [rocce] liquido disperso aeriforme in un liquido è chiamato aerosol/nebbia emulsione liquido solido schiuma aeriforme solido schiuma (solida) aeriforme liquido schiuma Attività: per ogni tipo di dispersione cerca un esempio tra i miscugli che incontri nella vita quotidiana. Spiega perché non è inserito in tabella una dispersione aeriforme in aeriforme

Miscugli eterogenei (latte) ► Ad esempio il latte sembra un miscuglio omogeneo ¿ l’aggettivo “omogeneizzato” che compare talvolta sulle confezioni contribuisce a dare l’impressione che sia così. ¿ In realtà se osservato al microscopio, mostra distintamente i globuli di grasso e di proteine immersi nel liquido (siero).

Miscugli eterogenei (acqua/olio) ► Il sistema acqua + olio rappresenta un miscuglio eterogeneo a due fasi ¿ L’olio è idrofobo e non si mescola con l’acqua. I due liquidi sono immiscibili ¿ Il sistema ha diverse proprietà ► Le sostanze si distribuiscono in modo grossolano ¿ è possibile a occhio nudo o al massimo tramite l'utilizzo di un microscopio ottico riconoscerle

Miscugli eterogenei (sospensione) ¢ Un altro miscuglio eterogeneo si forma tra acqua e sabbia ¢ Se proviamo infatti a mescolare acqua e sabbia possiamo distinguere una fase acquosa e una fase solida che col tempo si deposita sul fondo del recipiente ¢ Nella fase liquida e nella fase solida il sistema non ha le stesse proprietà ¢ Il processo di separazione spontaneo di una fase solida dispersa in un liquido si chiama SEDIMENTAZIONE

Miscugli eterogenei (granito) ¿ Anche il granito (roccia) è un esempio di miscuglio eterogeneo di solidi dispersi in solidi ¿ In un solido (feldspato) si trovano dispersi almeno altri due solidi ¿ Quarzo (cristalli traslucidi) ¿ Mica (particelle nere) ¿ La proprietà più evidente per riconoscerli (a occhio nudo) è il colore

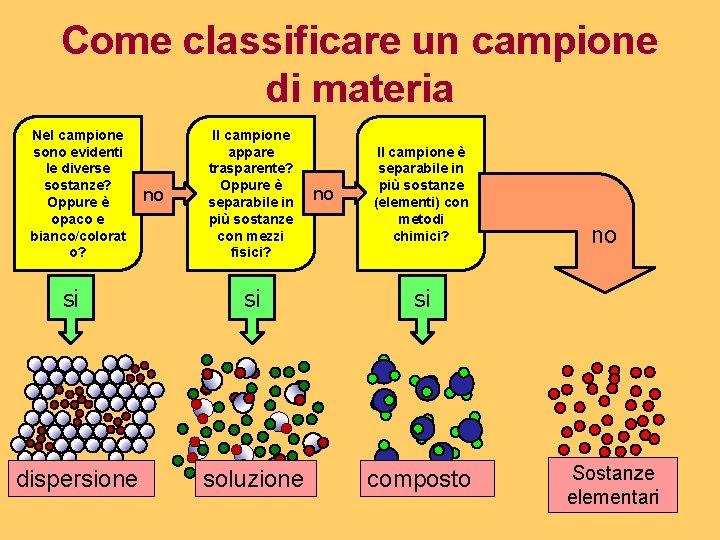
Come classificare un campione di materia Nel campione sono evidenti le diverse sostanze? Oppure è opaco e bianco/colorat o? no Il campione appare trasparente? Oppure è separabile in più sostanze con mezzi fisici? no Il campione è separabile in più sostanze (elementi) con metodi chimici? si si si dispersione soluzione composto no Sostanze elementari

Preparare le soluzioni ►Per una soluzione si devono conoscere ¿ soluto e solvente ¿ concentrazione ►La concentrazione esprime la composizione quantitativa del miscuglio omogeneo ¿ la pericolosità di una soluzione acida dipende dalla sua concentrazione

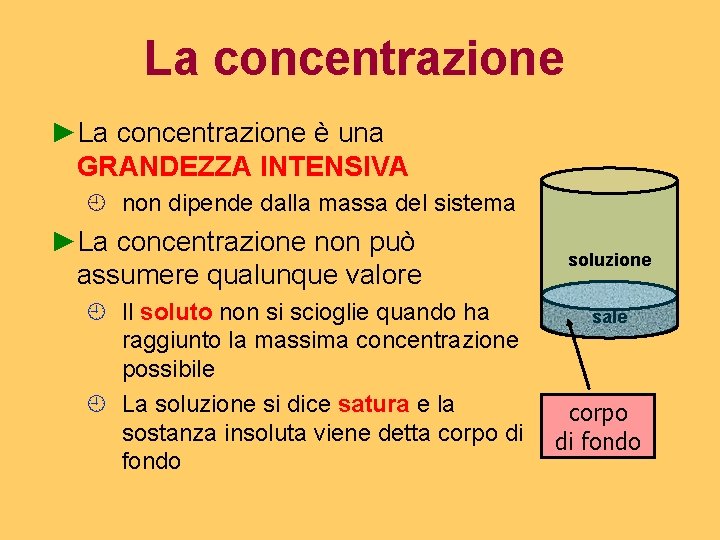
La concentrazione ►La concentrazione è una GRANDEZZA INTENSIVA ¿ non dipende dalla massa del sistema ►La concentrazione non può assumere qualunque valore ¿ Il soluto non si scioglie quando ha raggiunto la massima concentrazione possibile ¿ La soluzione si dice satura e la sostanza insoluta viene detta corpo di fondo soluzione sale corpo di fondo

Concentrazioni % (m/m) ►Concentrazione % (msoluto/msoluzione) ¿ g di soluto/100 g di soluzione ¿ (g di soluto/ g di soluzione)*100 ►Non dipende dalla temperatura ►Con soluti solidi

Esercizio ►Calcolare la C% (m/m) di: ¿ Una soluzione formata sciogliendo 5 g di Na. Cl in 450 m. L d’acqua ►Soluzione:

Concentrazione % (V/V) ►Concentrazione % (Vsoluto/Vsoluzione) ¿ m. L di soluto/100 m. L di soluzione ¿ (m. L di soluto/ m. L di soluzione)*100 ►Dipende dalla temperatura ►Con soluti liquidi ►Grado alcolico [1 ° = 1% (V/V)]

Esercizio ►Un vino presenta una gradazione alcolica di 14 ¿ Calcolare quanto alcol etilico contengono 120 m. L di tale vino ►Soluzione

Concentrazione (m/V) ►Concentrazione (msoluto/Vsoluzione) ¿ msoluto/ Vsoluzione ►Dipende dalla temperatura ►È di facile interpretazione ¿ Si trova sulle etichette degli alimenti

Tecniche di separazione ►I miscugli devono essere separati per ottenere le sostanze che li compongoni ►Un miscuglio, omogeneo o eterogeneo, può essere separato con ¿ metodi fisici ¿ metodi meccanici ►Tali metodi non alterano la natura delle sostanze costituenti

Classificare i metodi ► Meccanici ¿ Separano miscugli eterogenei in base al diverso stato di aggregazione ¿ Non richiedono impiego di energia ¿ Non cambia la natura della sostanza ► Fisici ¿ Separano miscugli eterogenei e omogenei in base alle diverse caratteristiche fisiche ¿ Richiedono impiego di energia ¿ Non cambia la natura della sostanza ► Chimici ¿ Separano i componenti di un composto non di un miscuglio (sostanza pura complessa) ¿ Cambiano la natura delle sostanze ¿ Richiedono energia

Metodi basati sulle caratteristiche fisiche 1 ►FERROMAGNETISMO ¿ Un miscuglio limatura di ferro + zolfo si può suddividere sfruttando la proprietà magnetiche del ferro ►SOLUBILITÀ ¿ Un miscuglio zolfo + sale può essere separato sfruttando la solubilità in acqua del sale (effettuando poi una filtrazione e una evaporazione) Miscugli eterogenei solidi

Metodi basati sulle caratteristiche fisiche 2 Miscugli eterogenei ►DIMENSIONI ¿ Alcuni miscugli possono essere separati sfruttando le diverse dimensioni delle particelle dei componenti ÙCon setacci per miscugli solido-solido ÙCon filtri per miscugli liquido-solido ►COLORE (aspetto) ¿ Un miscuglio di sale + pepe può essere risolto con una lente di ingrandimento e una pinzetta…ma che pazienza!!!

Metodi basati sulle caratteristiche fisiche 3 ►Una EMULSIONE (dispersione di liquido in liquido) può essere separata purché i liquidi abbiano densità diversa ¿ Per agitazione meccanica l’olio si disperde nell’acqua sotto forma di minuscole goccioline rendendo opaco il miscuglio ¿ Il miscuglio tenderà a separarsi se lasciato in quiete Miscugli eterogenei liquidi 1. acqua 2. olio

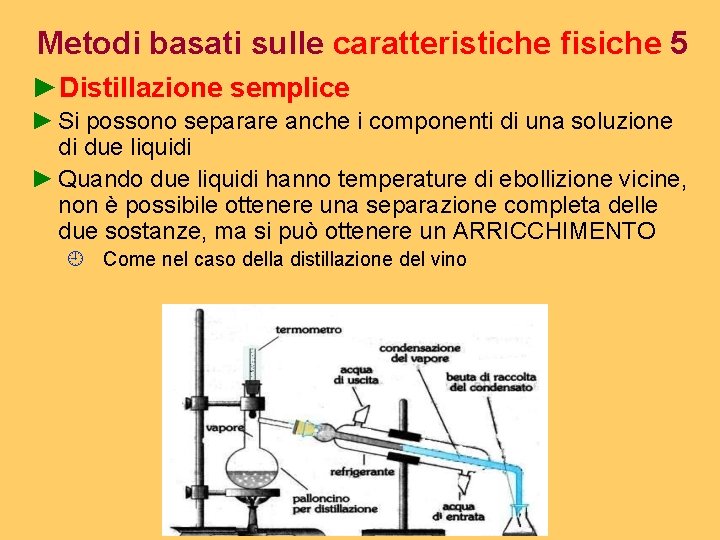
Metodi basati sulle caratteristiche fisiche 4 ►Distillazione semplice ¿ È una tecnica utilizzata per separare i componenti di una soluzione, per esempio acqua e sale (solido in liquido) ÙLa tecnica si basa sulle marcate differenze tra le temperature di ebollizione delle sostanze ¿ Distillando è possibile separare e condensare i vapori di solvente che si liberano durante il riscaldamento ¿ Si ottiene il distillato puro costituito dal solo solvente ¿ Con la semplice evaporazione si ottiene solo il soluto e si perde il solvente Miscugli omogenei liquidi

Metodi basati sulle caratteristiche fisiche 5 ►Distillazione semplice ► Si possono separare anche i componenti di una soluzione di due liquidi ► Quando due liquidi hanno temperature di ebollizione vicine, non è possibile ottenere una separazione completa delle due sostanze, ma si può ottenere un ARRICCHIMENTO ¿ Come nel caso della distillazione del vino

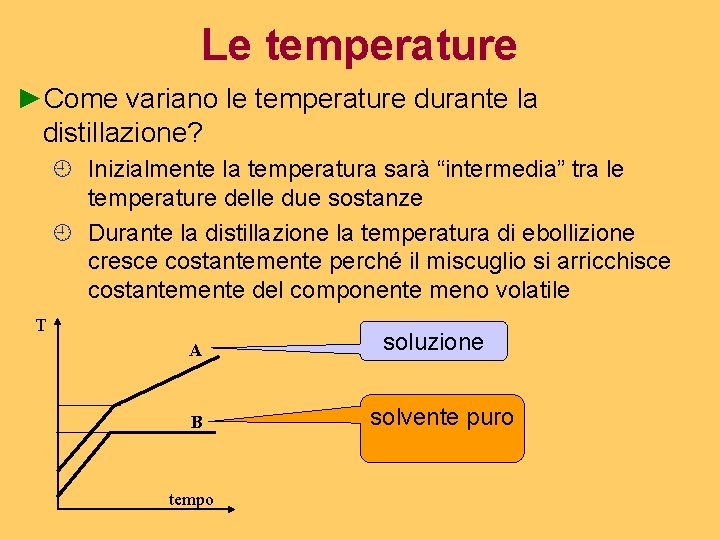
Le temperature ►Come variano le temperature durante la distillazione? ¿ Inizialmente la temperatura sarà “intermedia” tra le temperature delle due sostanze ¿ Durante la distillazione la temperatura di ebollizione cresce costantemente perché il miscuglio si arricchisce costantemente del componente meno volatile T A B tempo soluzione solvente puro

Come descrivere la distillazione ► Si riscalda fino all’ebollizione il miscuglio ► Si formano dei vapori con una percentuale del componente più volatile maggiore rispetto alla percentuale iniziale ► I vapori vengono condensati in un refrigerante (ad acqua) e raccolti alla fine del tubo ► I componenti sono separati in base alla loro temperatura di ebollizione

Metodi basati sulle caratteristiche fisiche 6 ► La cromatografia è un metodo usato per separare i diversi soluti presenti in un miscuglio omogeneo ► La soluzione viene depositata su un supporto poroso (Fase Stazionaria) ► La parte terminale di questa viene messa a contatto con il liquido solvente (Fase Mobile) contenuto nella vaschetta ► Il solvente risale sulla FM e trascina i componenti della miscela con velocità diverse separandoli ► I componenti del miscuglio omogeneo vengono separati in base alle loro differenti interazioni (fisiche) con la fase mobile e con la fase stazionaria Fase Stazionaria Fase Mobile Componente più veloce: maggiori interazioni con la FM Componente più lento: maggiori interazioni con la FS Miscuglio

Metodi basati sullo stato di aggregazione 1 ► Questi metodi vengono impiegati per separare le SOSPENSIONI di solidi nei liquidi ► DECANTAZIONE ► Si lascia che agisca la gravità sulle particelle del solido: la tecnica si basa sulla diversa densità dei componenti ► La parte solida si deposita sul fondo del recipiente, mentre quella liquida rimane al di sopra Miscugli eterogenei

Metodi basati sullo stato di aggregazione 2 Miscugli ►Centrifugazione ►Se il solido mescolato al liquido presenta particelle piccolissime o con una densità poco diversa da quello del liquido stesso, si utilizzano particolari apparecchiature, dette centrifughe ►Con la centrifugazione si ottiene lo stesso risultato della decantazione, ma in un tempo più breve eterogenei

Metodi basati sullo stato di aggregazione 3 ►Filtrazione ►Consiste nella separazione del solido dal liquido con una carta da filtro, che lascia passare il liquido, ma trattiene le parti solide ►Si sfrutta la porosità della carta, grazie alla quale le particelle liquide possono passare, mentre quelle del solido vengono trattenute Miscugli eterogenei

Metodi basati sullo stato di aggregazione 4 ►Cristallizzazione ►Consente di separare sotto forma cristallina un solido (soluto) da una sua soluzione resa satura per evaporazione del solvente ►In natura questo fenomeno avviene nelle saline Miscugli omogenei

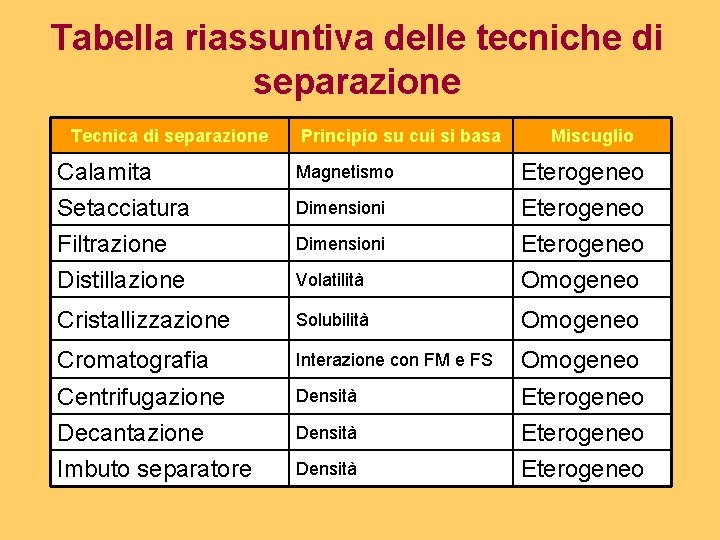
Tabella riassuntiva delle tecniche di separazione Tecnica di separazione Principio su cui si basa Miscuglio Calamita Setacciatura Filtrazione Distillazione Magnetismo Volatilità Eterogeneo Omogeneo Cristallizzazione Solubilità Omogeneo Cromatografia Interazione con FM e FS Omogeneo Centrifugazione Densità Eterogeneo Decantazione Densità Eterogeneo Imbuto separatore Densità Eterogeneo Dimensioni

Domande tipo ►Cos’è un sistema? ¿ È una porzione di universo, con limiti ben definiti messa sotto osservazione/studio ►Scrivi la definizione (basata sulle caratteristiche chimiche e fisiche) di miscuglio eterogeneo ¿ è una porzione di materia formata da almeno due componenti che presenta caratteristiche chimiche e fisiche diverse in ogni suo punto (tipiche dei componenti)

Domande tipo 2 ►Scrivi la definizione (basata sul concetto di fase) di sistema omogeneo ¿ È una porzione di materia, formata da uno o più componenti, che si presenta in una sola fase ►Spiega il concetto di fase ¿ è una porzione di materia formata da uno o più componenti che presenta caratteristiche chimiche e fisiche identiche in ogni suo punto

Domande tipo 3 ►Cosa sono i metodi di separazione meccanici? ¿ Sono metodi di separazione di miscugli eterogenei che non modificano lo stato fisico dei componenti e non richiedono l’impiego di energia ►Cosa sono i metodi fisici di separazione? ¿ Metodi di separazione di miscugli omogenei che sfruttano i passaggi di stato dei componenti