Kiseonik Marija Stanojevi II 8 Kiseonik Najrasprostranjeniji element























- Slides: 26

Kiseonik Marija Stanojević II 8

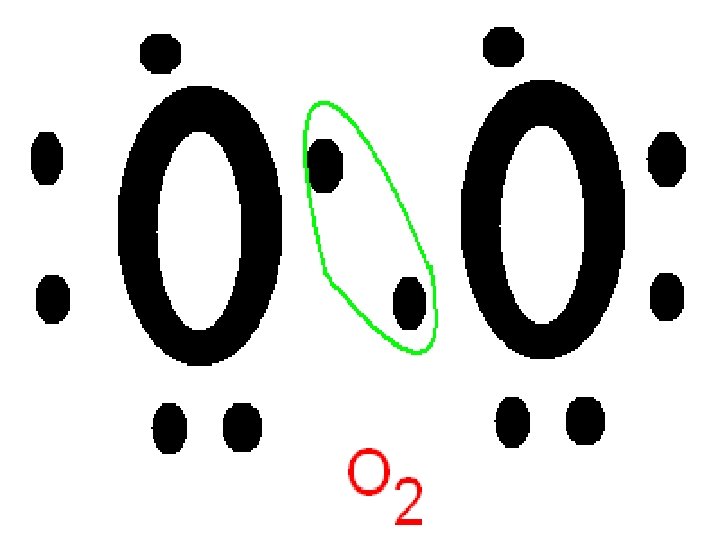
Kiseonik ØNajrasprostranjeniji element u prirodi ØSlobodan se javlja u obliku: Ø O 2 (donji slojevi atmosfere) Ø O 2 (gornji slojevi atmosfere) ØJedini se sa svim elementima u prirodi, direktno se ne jedini samo sa plemenitim metalima i halogonim elementima – oksidi (proces oksidacije je egzoterman proces)

Dobijanje kiseonika ØU laboratoriji: ØZagrevanjem oksidacionog sredstva, npr. KMn. O 4, KCl. O 3, Hg. O. . . Ø 2 KMn. O 4 + H 2 SO 4 + 5 H 2 O 2 → 2 Mn. SO 4 + K 2 SO 4 + 8 H 2 O +5 O 2 Ø KCl. O 3 → 2 KCL + 3 O 2 ØU industriji: Øfraksciona destilacija tečnog vazduha Øelektroliza vode


Primene kiseonika ØSav živi svet koristi kiseonik za disanje - bez njega ne bismo mogli da živimo ØKiseonik se pomaže sagorevanju laktoze u našim mišićima i omogućava nam pomeranje udova, trčanje i bavljenje sportom ØUdisanje kiseonika iz boce sa kiseonikom jako povoljno utiče na srce svih ljudi koji imaju bilo kakvih zdravstvenih tegoba i problema sa srcem ØKiseonik iz boce je takođe veonma koristan i za ljude koji boluju od raka pluća

Primene kiseonika ØKiseonik se koristi u prehrambenoj industriji ØU metalnoj industriji kiseonik se koristi za intezifikaciju procesa sagorevanja u industrijskim pećima za proizvodnju metala i nemetala ØU metalurgiji obojenih metala (bakar, aluminijum i olovo) tehnički gasovi se primenjuju u mnogim procesima proizvodnje i prerade ovih metala, a kiseonik ima najveću primenu u procesu sagorevanja

Oksidi - najvažnija jedinjenja kiseonika ØOksidi su jedinjenja kiseonika sa drugim elementima ØU zavisnosti od oksidacionog broja kiseonika imamo tri vrste oksida: Øobični oksidi – oksidaciono stanje -2 Øperoksidi – oksidaciono stanje -1 Øsuperoksidi – oksidaciono stanje -1/2 ØOksidi mogu biti: Øbazni Økiseli Øamfoterni

Dobijanje oksida Ø Ø Ø Sagorevanje elemenata na vazduhu: 2 Mg + O 2 → 2 Mg. O Sagorevanje elemenata u struji vodene pare: Mg + H 2 O → Mg. O + H 2 Razlaganje hidroksida dejstvom toplote: 2 Al (OH)3 → Al 2 O 3 + H 2 O Žarenje karbonata: Ca. CO 3 → Ca + CO 2 Razlaganje nitrata dejstvom toplote: Cu (NO 3) → Cu. O + 2 NO 2 + ½ O 2 Oksiodacija metala sa HNO 3 Ø Ø Ø dejstvom koncentrovane HNO 3 na Cu: Cu + 4 HNO 3 → Cu(NO 3) + 2 2 NO 2 + 2 H 2 O dejstvom razblažene HNO 3 na Cu: 3 Cu + 8 HNO 3 → 3 Cu(NO 3) + 2 NO 2 + 4 H 2 O Ø Redukcija oksida u kome je elemenat u višem oksidacionom stanju: Ø Ø CO 2 + C→ 2 CO Ø Razlaganje mešovitih oksida: 2 Pb 3 O 4 → 6 Pb. O + O 2

Bazni oksidi – anhidridi baza ØOksidi metala: Li 2 O, K 2 O, Mg. O, Ca. O, Ni. O, Fe. O. . . ØMetali I grupe sa kiseonikom grade: Øokside (Li 2 O, Na 2 O, K 2 O) Ø 4 Li (s) + O 2 (g) → 2 Li 2 O (s) Øperokside (Na 2 O 2, K 2 O 2) Ø 2 Na (s) + O 2 (g) → Na 2 O 2 (s) Øsuperokside (KO 2) ØK (s) + O 2 (g) → KO 2 (s) ØMetali II grupe sa kiseonikom grade: Øokside (Mg. O, Ca. O, Sr. O, Ba. O) Ø 2 Ca (s) + O 2 (g) → 2 Ca. O (s) Øperokside (Ba. O 2) ØBa (s) + O 2 (g) → Ba. O 2 (s)

Bazni oksidi – anhidridi baza ØMetali III grupe sa kiseonikom grade Øokside (In 2 O 3, Tl 2 O 3) ØIn (s) + O 2 (g) → In 2 O 3 (s) ØMetal bizmut iz pete grupe jedini gradi bazni oksid sa kiseonikom ØBi (s) + O 2 (g) → Bi 2 O 3 (s) ØReakcije sa vodom i kiselinama: ØNa 2 O (s) + H 2 O (l) → 2 Na. OH (aq) ØCa. O (s) + H 2 O (l) → Ca (OH)2 (aq) ØCa. O (s) + 2 HCl(aq) → Ca. Cl 2 (aq) + H 2 O (l)

Bazni oksidi – anhidridi baza ØDobijanje baznih oksida: Ø 2 Mg (s) + O 2 (g) → 2 Mg. O (s) ØMg (OH)2 (s) → Mg. O (s) + H 2 O (g) ØMg. CO 3 (s) → Mg. O (s) + CO 2 (g) (zagrevanjem) Ø 2 Pb (NO 3)2 (s) → 2 Pb. O (s) + 4 NO 2 (g) + O 2 (g) (zagrevanjem) ØHg. Cl 2 (aq) + 2 Na. OH (aq) → Hg. O (s) + H 2 O (l) + 2 Na. Cl (aq)

Kiseli oksidi - anhidridi kiselina ØOksidi nemetala : N 2 O 5, CO 2, SO 3, SO 2, P 2 O 5, Cl 2 O 7. . . ØOksidi metala: Cr. O 3, Mn 2 O 7. . . (visok oksidacioni broj metala) ØOksidi metaloida: B 2 O 3, Si. O 2, Ge. O 2. . . ØJedinjenja kovalentnog karaktera Ø Jedinjenja kiseonika i elemenata IV, V, VI i VII grupe Ø Većina ih je u gasovitom agregatnom stanju

Kiseli oksidi - anhidridi kiselina ØDobijanje: Ø 2 C(s) + O 2(g) → 2 CO(g) ØP 4(s) + 3 O 2(g) → P 4 O 6(s) ØS 8(s) + 8 O 2(g) → 8 SO 2(g)

Kiseli oksidi - anhidridi kiselina ØReakcije sa vodom i bazama: ØCO 2(g) + H 2 O(l) → H 2 CO 3(aq) ØSO 2(g) + H 2 O(l) → H 2 SO 3(aq) ØN 2 O 5(g) + H 2 O(l) → 2 HNO 3(aq) ØCO 2(g) + 2 Na. OH(aq) → Na 2 CO 3(aq) + H 2 O(l) ØReakcije oksida metala i oksida nemetala: ØCa. O(s) + SO 3(l) → Ca. SO 4(s) Ø 6 Na 2 O(s) + P 4 O 10(s) → 4 Na 3 PO 4(s)

Amfoterni oksidi ØAl 2 O 3, Zn. O, Be. O, Pb. O, As 2 O 3, Sn. O, Cr 2 O 3. . . ØImaju istovremeno osobine i baznih i kiselih oksida. ØReakcije sa kiselinama i bazama: ØAl 2 O 3 (s) + 6 HCl (aq) → 2 Al. Cl 3 (aq) + 3 H 2 O (l) ØAl 2 O 3 (s) + 2 Na. OH (aq) + 3 H 2 O → 2 Na Al(OH)4 (aq)

Amfoterni oksidi ØPeriodni sistem: Ø u periodi kiselost oksida raste, a baznost opada: ØPrimer: IV perioda ØK 2 O Ca. O Ga 2 O 3 Ge. O 2 As 2 O 5 Se. O 3 Br 2 O 7 baz. > baz. amfot. kis. < kis. Ø u grupi bazni karakter oksida raste, a kiseli opada: ØPrimer: V grupa ØN 2 O 3 P 2 O 3 As 2 O 3 Sb 2 O 3 Bi 2 O 3 kis. > kis. amfot. baz.

Amfoterni oksidi ØAko element gradi više oksida: Økiseli karakter je najjače izražen kod oksida u kome je element u najvišem oksidacionom stanju ØPrimer Ø As 2 O 3 – amfoteran i As 2 O 5 – kiseo Ø Ako metal gradi više oksida: ØCr. O – bazni, Cr 2 O 3 – amfoteran, Cr. O 3 - kiseo

Neutralni oksidi ØOksidi nemetala: N 2 O, NO, CO ØGasoviti oksidi ØNe reaguju sa vodom, ni sa kiselinama, ni sa bazama ØNe grade baze, ni kiseline

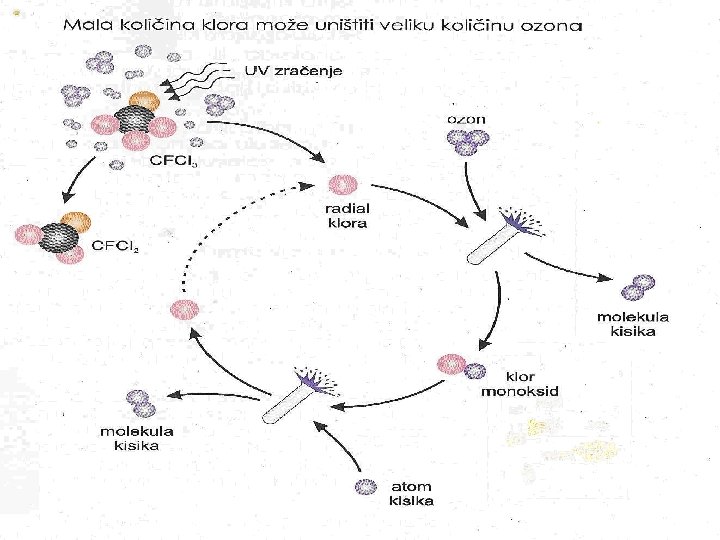
Ozon ØJedinjenje kiseonika sa formulom O 3 ØDobijanje: 3 O 2 → 2 O 3 bolje se rastvara u vodi od O 2 ØNastaje spajanjem tri atoma kiseonika i ima formulu O 3 ØNalazi se u gornjim slojevima atmosfere ØRazgradnjom freona oslobađaju se joni hlora i broma koji se vežu s atomom kiseonika iz molekula ozona

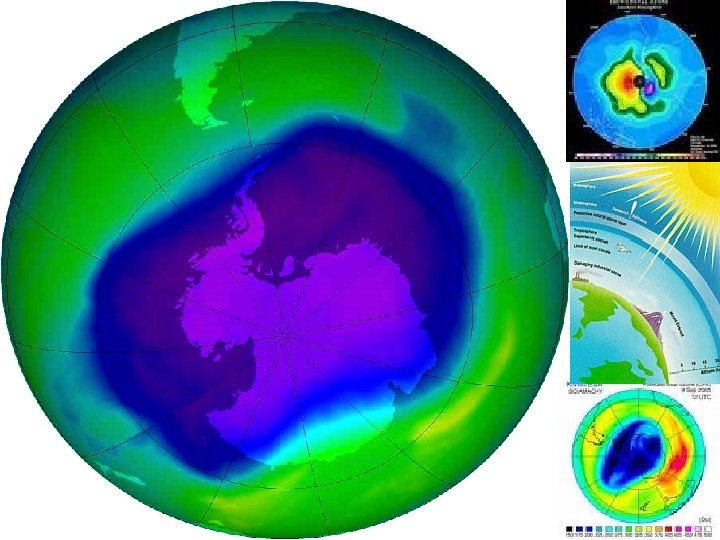
Ozonski omotač ØDaje plavetnilo nebu ØOzonski sloj je deo stratosfere na visini od 12 – 50 km ØPlaneta nazvana HD 209458 b - "OZIRIS“, koja se ne nalazi u Sunčevom sistemu takođe ima atmosferu u kojoj se nalazi kiseonik ØSmatra se da ima još takvih planeta van Sunčevog sistema


Ozonske rupe ØPrve pretpostavke o tome što sve ljudska delatnost može naneti ozonskom omotaču objavljene su početkom 1970 -ih godina ØPrva ozonska rupa nađena je na južnoj hemisferi ØOzon se oštećuje u proseku 4 -5% za deset godina ØRanih osamdesetih dokazano je oštećenje ozonskog omotača nad Antarktikom pomoću NASA-inog satelita ØGodine 1999. godine izmerena je najveća "rupa", veličine 27 miliona kvadratnih kilometara. Ali 2000. godine ona se još povećala na 30 miliona.

Ozonske rupe ØUsled prevelike i nekontrolisane upotrebe: Øfreona (hemikalija koja se koristi u dezodoransima i lakovima za kosu, ili kao rashladni mediji u hladnjacima, ledenicama, klima-uređajima) Øhalona (upotrebljava se kao sredstvo za gašenje požara u protupožarnim uređajima) danas dolazi do oštećivanja ozonskog sloja. Ø Oštećeni ozonski štit propušta do tla više ultraljubičastog zračenja koje uzrokuje učestalost očnih bolesti i raka kože kod ljudi, a može oštetiti i belančevine i DNK kod ljudi, biljaka i životinja.

Primena ozona ØOzon izaziva vedro raspoloženje, bolji imunitet i lep ten ØPojačava imuni sistem i energetski potencijal organizma ØPrirodan je antibiotik i za kratko vreme uništava viruse, bakterije i gljivice ØPodiže nivo intelektualnih sposobnosti, pojačava pažnju i ubrzava razmišljanje. ØKoristi se za dezinfekciju rana. ØU kozmetici se upotrebljava za pravljenje krema za podmlađivanje

Primena ozona ØLeči apscese, rane, osteomijelitis, zaustavlja cirozu jetre i propadanje očnog živca. ØOzon se ubrizgava u mišić kroz krv, radi veće izdržljivosti ØZa lečenje se koristi i ozonirana voda, koja se dobija propuštanjem ozona kroz vodu. ØLeči zglobove, smanjuje otok i poboljšava cirkulaciju ØKoristi se za dezinfekciju ØDobar je za osvežavanje i podmlađivanje kože

Hvala na pažnji!!!
 Kiseonik element
Kiseonik element Kiseonik nalazenje u prirodi
Kiseonik nalazenje u prirodi 16. grupa pse
16. grupa pse Distinguish between a signal element and a data element.
Distinguish between a signal element and a data element. Signal element vs data element
Signal element vs data element Marija draskic pravni
Marija draskic pravni Marija krmek
Marija krmek Marija vulovic
Marija vulovic Marija dubicka
Marija dubicka Marija purgar
Marija purgar Marija pantelić
Marija pantelić Fenomen schreibweise
Fenomen schreibweise Tefko
Tefko Marija batinić sermek
Marija batinić sermek Marija kranjcevic
Marija kranjcevic Marija vrdoljak
Marija vrdoljak Bled health centre
Bled health centre Marija roth psiholog
Marija roth psiholog Marija petek
Marija petek Marija montesori
Marija montesori Monoteistine
Monoteistine Marija anicic zgonjanin
Marija anicic zgonjanin Marija djokovic md
Marija djokovic md Primi ove darove naš oče tekst
Primi ove darove naš oče tekst Marija jurčević efzg
Marija jurčević efzg Sveta marija
Sveta marija Darko jeremic
Darko jeremic