IV 1 Hemiski znaci i formuli Al Na























- Slides: 28

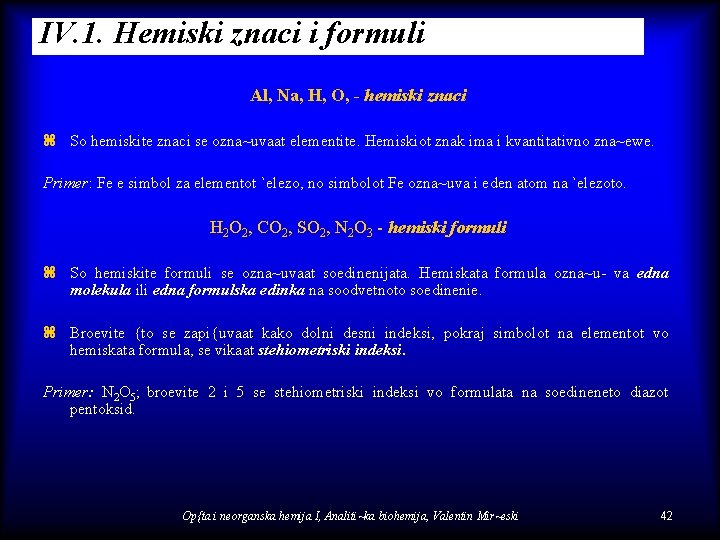
IV. 1. Hemiski znaci i formuli Al, Na, H, O, - hemiski znaci z So hemiskite znaci se ozna~uvaat elementite. Hemiskiot znak ima i kvantitativno zna~ewe. Primer: Fe e simbol za elementot `elezo, no simbolot Fe ozna~uva i eden atom na `elezoto. H 2 O 2, CO 2, SO 2, N 2 O 3 - hemiski formuli z So hemiskite formuli se ozna~uvaat soedinenijata. Hemiskata formula ozna~u- va edna molekula ili edna formulska edinka na soodvetnoto soedinenie. z Broevite {to se zapi{uvaat kako dolni desni indeksi, pokraj simbolot na elementot vo hemiskata formula, se vikaat stehiometriski indeksi. Primer: N 2 O 5; broevite 2 i 5 se stehiometriski indeksi vo formulata na soedineneto diazot pentoksid. Op{ta i neorganska hemija I, Analiti~ka biohemija, Valentin Mir~eski 42

Hemiskata formula nudi: y kvalitativni i y kvantitativni informacii za hemiskoto soedinenie. Primer: H 2 O 2; y Kvalitativni informacii: Soedinenieto vodorod peroksid e izgradeno od vodorod i kislorod. y Kvantitativni informacii: Edna molekula vodorod peroksid sodr`i dva atomi vodorod i dva atomi kislorod. Odnosot na koli~estvata na vodorodot i kislorodot e opredelen od odnosot na stehimetriskite indeksi i iznesuva 2 : 2. Ovie kvantitativni informacii mo`at da se prika`at i vo oblik na matemati~ki formuli. Edna molekula vodorod peroksid sodr`i dva atomi vodorod. Edna molekula vodorod peroksid sodr`i dva atomi kislorod. Odnosot na koli~estvata na vodorodot i kislorodot e opredelen od odnosot na stehimetriskite indeksi i iznesuva 2 : 2. Op{ta i neorganska hemija I, Analiti~ka biohemija, Valentin Mir~eski 43

IV. 2. Vistinska (molekulska) i najprosta (empiriska) formula Primer: H 2 O 2 e vistinska (molekulska) formula, a HO e najprosta (empiriska) formula na soedinenieto vodorod peroksid. Sekoja hemiskata formula mora da go poka`uva to~niot kvalitativen sostav na soedinenieto. z Dokolku hemiskata formula, preku stehiometriskite indeksi go poka`uva vistinskiot kvantitativen sostav na soedinenieto, toga{ formulata se narekuva VISTINSKA ili MOLEKULSKA FORMULA. z Dokolku vistinskite stehiometriski indeksi se podeleni so nivniot najgolem zaedni~ki delitel, toga{ novata formula se narekuva NAJPROSTA ili EMPIRISKA formula. Va`no!! Empiriskata formula go poka`uva to~niot kvalitativen sostav na soedinenieto, kako i to~niot odnos na koli~estvata na elementite od koi e izgradeno soedinenieto, no taa ne go poka`uva vistinskiot kvantitativen sostav na soedinenieto. Op{ta i neorganska hemija I, Analiti~ka biohemija, Valentin Mir~eski 44

IV. 3. Oksidaciski broj i valentnost Valentnosta na nekoj atom e opredelena od brojot na elektroni {to atomot gi anga`ira za obrazuvawe na hemiski vrski. Vodorodot e sekoga{ ednovalenten bidej}i ima samo eden elektron so kogo mo`e da gradi hemiski vrski. Kislorodot e vo site soedinenija dvovalenten, bidej}i sekoga{ koristi dva elektroni za obrazuvawe na hemiski vrski. Vo soedinenieto HCl i vodorodot i hlorot se ednovalentni, a vo soedinenieto Cl. O 2, Cl e ~etirivalenten, zo{to korisi ~etiri elekroni za obrazuvawe na hemiski vrski, a kislorodot e dvovalenten. Za obrazuvawe na hemiskite vrski naj~esto e neophodno atomot da oddade (spodeli) delumno ili celosno eden ili pove}e od svite elektroni (Zabele{ka! Prethodnoto tvrdewe ne e celosno to~no. Na primer, pri obrazuvawe na ~isto jonski soedinenija, anjonot ne anga`ira nitu eden od svoite elektroni, tuku samo prima eden ili pove}e elektroni vo svoite orbitali). Procesot na oddavawe na elektroni se narekuva so op{t naziv “oksidacija”. Zatoa, namesto nazivot valentnost, {to e vo vrska so brojot na anga`irani elektroni za obrazuvawe na hemiski vrski, se koristi nazivot “oksidaciski broj” {to ja ozna~ua “oksidaciskata sostojba” na atomot. Op{ta i neorganska hemija I, Analiti~ka biohemija, Valentin Mir~eski 45

Pravila za oksidaciskite broevi: 1. Oksidaciskiot broj na atomite vo elementarna sostojba e nula. Primer: Zabele{ka: Oksidaciskiot broj se pi{uva nad simbolot na elementot. 2. Oksidaciskiot broj na elementite vo jonskite sodinenija e ednakov na polne`ot na jonite. Primer: Oksidaciskiot broj ima i svoj znak, koj{to se pi{uva pred oksidaciskiot broj. Op{ta i neorganska hemija I, Analiti~ka biohemija, Valentin Mir~eski 46

3. Zbirot na proizvodite od oksidaciskite broevi i stehimetriskite indeksi na elementite vo edno soedinenie e ednakov na nula. Primer: +3 + 3(-1) = +3 - 3 = 0 4. Oksidaciskiot broj na nekoj sloboden jon e ednakov so polne`ot na jonot. Primer: Zable{ka: Treba da se obrne vnimnie na razlikata vo pi{uvaweto na oksidaciskiot broj i polne`ot na jonot! Vo kovalentnite soedinenija znakot na oksidaciskiot broj zavisi od elektronegativnosta na elementot. Elementite so pogolema elektronegativnost dobivaat negativni, a onie so pomala pozitivni oksidaciski broevi. Od tie pri~ini fluorot ima sekoga{ oksidaciski bro -1, a kislorodot naj~esto -2 (samo vo peroksidite i superoksidite kislorodot ima oksidaciski broj -1 i -1/2, soodvetno. Vidi strana 52 ). Op{ta i neorganska hemija I, Analiti~ka biohemija, Valentin Mir~eski 47

Od ovie pri~ini metalite, kako elektropozitivni elementi, imaat pozitiven oksidaciski broj vo nivnite soedinenija. Isklu~ok se intermetalnite soedinenija, kade poelektronegativniot metal dobiva negativen a drugiot pozitiven oksidaciski broj. Sli~no i vodorodot ima oksidaciski broj +1 vo site soedinenija so nemetalite. Isklu~ok se soedinenijata nare~eni metalni hidridi, kade vodorodot ima oksidaciski broj -1, za{to e povrzan so elementi (metali) {to imaat pomala elektronegativnost. Primeri: 5. Oksidaciskiot broj mo`e da se opredeli i na atomska grupa vo ramkite na edno soedinenie. Primer: Oksidaciskiot broj na sulfatnata grupa vo sulfurnata kiselina e -2. Op{ta i neorganska hemija I, Analiti~ka biohemija, Valentin Mir~eski 48

6. Koga stanuva zbor za molekuli izgradeni od dva isti atomi (molekuli na elementarnite supstanci) toga{ oksidaciskiot broj na atomite e nula. Primer: Prose~en oksidaciski broj: Primer: Grupata (O 2) vo vodorod peroksidot i vo negovite soli -2 +1 H -1 O +1 -1 O H nare~eni peroksidi ima vkupen oksidaciski broj -2, {to zna~i prose~niot oksidaciski broj na sekoj atom od kislorod e -1. Sekako deka sekoj atom na kislorod i vo ova soedinenie e dvovalenten, zo{to sekoj atom kislorod anga`ira po dva elektroni za gradewe na hemiskite vrski vo soedinenieto. Spored ova, oksidaciskiot broj i valentnosta na atomite vo odredeno soedinenie ne se sekoga{ identi~ni. Op{ta i neorganska hemija I, Analiti~ka biohemija, Valentin Mir~eski 49

V. Glavni grupi neorganski soedinenija i nivna nomenklatura V. 1. Oksidite se binarni soedinenija na kislorodot so drugite elementi. (Poimot “binarni” uka`uva deka oksidite se izgradeni od dva vida elementi od koi edniot e kislorod) Metodi za dobivawe: 1. Direktna sinteza: C + O 2 = CO 2 2. Termi~ko razlo`uvawe na soli ili peroksidi: Ca. CO 3 = Ca. O + CO 2 Vidovi oksidi (podelba spored hemiskite svojstva) 1. Oksidite koi pri reakcija so vodata obrazuvaat kiselini se narekuvaat kiselinski oksidi ili anhidridi na kiselinite. Primer: SO 2 + H 2 O = H 2 SO 3 (sulfur dioksid) (sulfuresta kiselina) Op{ta i neorganska hemija I, Analiti~ka biohemija, Valentin Mir~eski 50

2. Oksidite koi pri reakcija so vodata gradat bazi se vikaat bazni oksidi. Primer: Ca. O + H 2 O (kalcium oksid) = Ca(OH)2 (kalcium hidroksid) 3. Oksidite {to mo`e da reagiraat so kiselini i so bazi, pri {to vo dvata slu~ai gradat soli se narekuvaat amfoterni oksidi. Primeri: Zn. O cink oksid, Al 2 O 3 aluminium oksid, Sn. O kalaj(II) oksid, Pb. O olovo(II) oksid. Zn. O + 2 HCl = Zn. Cl 2 + H 2 O Zn. O + 2 Na. OH+ H 2 O = Na 2[Zn(OH)4] (natrium tetrahidroksocinkat) 4. Oksidite {to ne reagiaat nitu so kiselini nitu so bazi, nitu pak pri reakcija so vodata gradat kiselini ili bazi, se narekuvaat indiferentni oksidi. Primeri: CO jaglerod monoksid, NO azot monoksid Op{ta i neorganska hemija I, Analiti~ka biohemija, Valentin Mir~eski 51

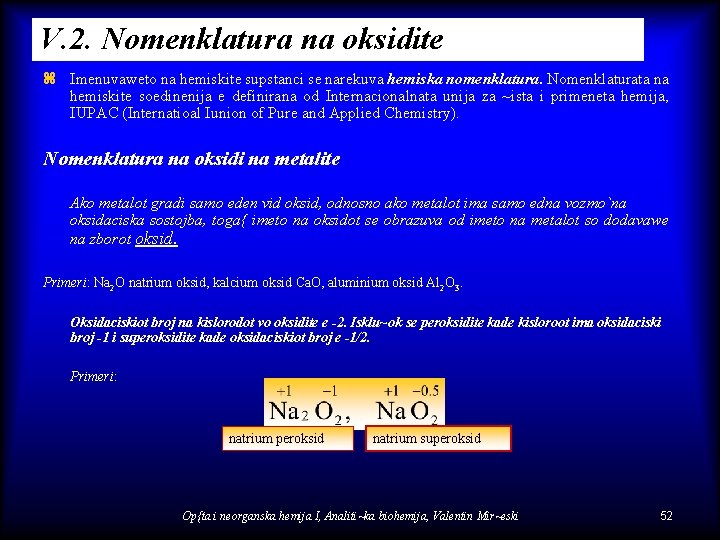
V. 2. Nomenklatura na oksidite z Imenuvaweto na hemiskite supstanci se narekuva hemiska nomenklatura. Nomenklaturata na hemiskite soedinenija e definirana od Internacionalnata unija za ~ista i primeneta hemija, IUPAC (Internatioal Iunion of Pure and Applied Chemistry). Nomenklatura na oksidi na metalite Ako metalot gradi samo eden vid oksid, odnosno ako metalot ima samo edna vozmo`na oksidaciska sostojba, toga{ imeto na oksidot se obrazuva od imeto na metalot so dodavawe na zborot oksid. Primeri: Na 2 O natrium oksid, kalcium oksid Ca. O, aluminium oksid Al 2 O 3. Oksidaciskiot broj na kislorodot vo oksidite e -2. Isklu~ok se peroksidite kade kisloroot ima oksidaciski broj -1 i superoksidite kade oksidaciskiot broj e -1/2. Primeri: natrium peroksid natrium superoksid Op{ta i neorganska hemija I, Analiti~ka biohemija, Valentin Mir~eski 52

Dokolku metalot ima pove}e vozmo`ni oksidaciski sostojbi, odnosno mo`e da gradi pove}e vidovi oksidi, toga{ pome|u imeto na metalot i zborot oksid se pi{uva oksidaciskata sostojba na elementot so rimski broj staven vo mala zagrada, vedna{ zad imeto na metalot. Primeri: o o Cu 2 O bakar(I) oksid, Cu. O bakar(II) oksid, Fe. O `elezo(II) oksid, Fe 2 O 3 `elezo(III) oksid. Vnimanie! Imeto na metalot i rimskiot broj se pi{uvaat sleano, dodeka imeto na metalot (so ili bez rimski broj) i zborot “oksid” se pi{uvaat razdvoeno. Op{ta i neorganska hemija I, Analiti~ka biohemija, Valentin Mir~eski 53

Nomenklatura na oksidi na nemetalite Imeto na oksidot se obrazuva od imeto na nematalot i zborot oksid. Pred imeto na nemetalot i pred zborot oksid se dodavaat prefiksi koi go ozna~uvaat soodvetniot stehiometriski indeks imenuvan na gr~ki. Primer: N 2 O 5 diazot pentoksid, N 2 O diazot monoksid (ili diazot oksid). Nazivi na broevite na gr~ki jazik: 1 -mono, 2 -di, 3 -tri, 4 -tetra 5 -penta, 6 -heksa, 7 -hepta, 8 -okta, 9 -nona, 10 -deka, 11 -undeka, 12 -dodeka Op{ta i neorganska hemija I, Analiti~ka biohemija, Valentin Mir~eski 54

V. 3. Kiselini z Kiselinite se soedinenija na vodorodot so nekoj nemetal ili atomska grupa nare~na radikal. Atomskata grupa naj~esto vklu~uva nekoj nemetal i kislorod, no postojat i zna~itelen broj radikali izgradeni od nekoj metal i kislorod. Primeri: HCl hlorovodorodna kiselina, H 2 S sulfurvodorodna kiselina, HCl. O 4 perhlorna kiselina, H 2 Cr. O 4 hromna kiselina. Kiselinite vo voden rastvor disociraat i pri toa generiraat vodorodni katjoni, odnosno protoni. Protonite vo vodniot rastvor ne se slobodni, tuku se svrzuvaat so edna molekula voda gradej}i H 3 O+ hidroniev jon koj preku vodorodni vrski naj~esto se povrzuva so tri moleuki voda gradej}i H 3 O+ (H 2 O)3 ili H 9 O 4+. Osnovni svojstva na kiselinite: Kiselinite imaat kisel vkus, nivnite vodni rastvori sproveduvaat elektri~na struja i siniot lakmus go bojat so crvena boja. Op{ta i neorganska hemija I, Analiti~ka biohemija, Valentin Mir~eski 55

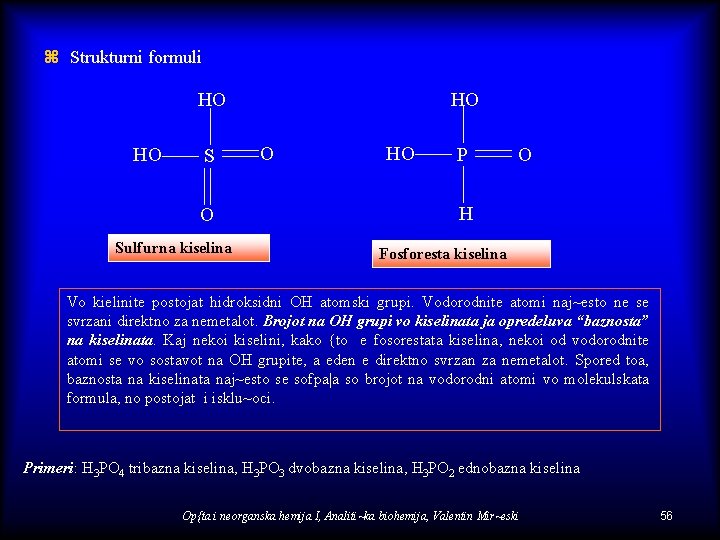
z Strukturni formuli HO HO S O Sulfurna kiselina HO O HO P O H Fosforesta kiselina Vo kielinite postojat hidroksidni OH atomski grupi. Vodorodnite atomi naj~esto ne se svrzani direktno za nemetalot. Brojot na OH grupi vo kiselinata ja opredeluva “baznosta” na kiselinata. Kaj nekoi kiselini, kako {to e fosorestata kiselina, nekoi od vodorodnite atomi se vo sostavot na OH grupite, a eden e direktno svrzan za nemetalot. Spored toa, baznosta na kiselinata naj~esto se sofpa|a so brojot na vodorodni atomi vo molekulskata formula, no postojat i isklu~oci. Primeri: H 3 PO 4 tribazna kiselina, H 3 PO 3 dvobazna kiselina, H 3 PO 2 ednobazna kiselina Op{ta i neorganska hemija I, Analiti~ka biohemija, Valentin Mir~eski 56

Osnovni na~ini za dobivawe na kiselinite: 1. Rastvoruvawe na kiseliski oksid vo voda: SO 2 + H 2 O = H 2 SO 3 2. Reakcija na kiselina so nekoja sol: 2 Na. Cl + H 2 SO 4 = 2 HCl + Na 2 SO 4 Nomenklatura na kiselinite Imeto na kiselinata se formira spored imeto na elementot {to ja obrazuva kiselinata. Pri toa ne mo`e da se definiraat strogi pravila pri formiraweto na nazivite. Primeri za beskislorodni kiselini se: HCl hlorovodorodna kiselina HBr bromovodorodna kiselina H 2 S sulfurvodorodna kiselina HI jodovodorodna kiselina HF fluorovodorodna kiselina HCN cijanovodorodna kiselina Op{ta i neorganska hemija I, Analiti~ka biohemija, Valentin Mir~eski 57

Osnovnite kislorodni kiselini: • • • • HCl. O 3 hlorna kiselina HIO 3 jodna kiselina HBr. O 3 bromna kiselina, H 2 SO 4 sulfurna kiselina H 2 Se. O 4 selenova kiselina, H 6 Te. O 6 telurna kiselina HNO 3 azotna kiselina, H 3 PO 4 fosforna kiselina H 3 As. O 4 arsenova kiselina, H 3 Sb. O 4 antimonova kiselina H 2 CO 3 jaglerodna kiselina, H 4 Si. O 4 siliciumova kiselina H 2 Sn. O 3 kalajna kiselina, H 3 BO 3 borna kiselina H 2 Cr. O 4 hromna kiselina, H 2 Mn. O 4 manganova kiselina Nazivite na osnovnite kislorodni kiselni se formiraat od imeto na elementot {to ja gradi kiselinata, pri {to se dodava nastavka na ili ova. Vnimanie! Imeto na kiselinata i zborot “kiselina” se pi{uvaat razdvoeno. Op{ta i neorganska hemija I, Analiti~ka biohemija, Valentin Mir~eski 58

Kislorodni kiselini izvedeni od osnovnata kiselina: Kiselina koja{to ima eden kisloroden atom pove}e od osnovnata kiselina, dobiva naziv formiran od osnovnata kiselina so prefiks per. Primer: HCl. O 4 perhlorna kiselina, HIO 4 perjodna kiselina. Vnimanie! Kiselinata HMn. O 4 se vika permanganova kiselina iako ima ist broj na kislorodni atomi kako osnovnata kiselina (H 2 Mn. O 4) no ima eden atom vodorod pomalku od nea. Zaedni~ko za site primeri e {to vo “per” kiselinite elementot {to ja gradi kiselinata ima povisok oksidaciski broj od onoj {to go ima vo osnovnata kiselina. Kiselina koja{to ima eden kisloroden atom pomalku od osnovnata kiselina, dobiva naziv formiran od osnovnata kiselina pri {to nastavkata na, ili ova se zamenuva so esta. Primer: HCl. O 2 hloresta kiselina, H 2 SO 3 sulfuresta kiselina, HNO 2 azotesta kiselina. Op{ta i neorganska hemija I, Analiti~ka biohemija, Valentin Mir~eski 59

Kiselina koja{to ima eden kisloroden atom pomalku od “esta” kiselinata, dobiva naziv formiran od “esta” kiselinata so prefiks hipo. Primer: HCl. O hipohloresta kiselina (HCl. O 2 hloresta kiselina), HIO hipojodesta kiselina (HIO 2 jodesta kiselina) HCl. O 3 hlorna kiselina HCl. O 4 perhlorna kiselina HCl. O 2 hloresta kiselia HCl. O hipohloresta kiselina Kiselina ~ija{to formula se izveduva so formalno odzemawe na edna molekula voda od osnovnata kiselina dobiva naziv formiran od osnovnata kiselina so prefiks meta. Primer: HPO 3 metafosforna kiselina (H 3 PO 4 - H 2 O = HPO 3, H 3 PO 4 fosforna kiselina). Kiselina ~ija{to formula se izveduva so formalno odzemawe na edna molekula voda od dve mlekuli na osnovnata kiselina dobiva naziv formiran od osnovnata kiselina so prefiks “piro”. Primer: H 4 P 2 O 7 pirofosforna kiselina (2 H 3 PO 4 - H 2 O = H 4 P 2 O 7). Op{ta i neorganska hemija I, Analiti~ka biohemija, Valentin Mir~eski 60

So zamena na eden ili pove}e kislorodni atomi vo kiselinata so atomi na sulfur, se dobivaat t. n. “tio-kiselini”. Nazivot na tio-kiselinata se dobiva od osnovnata kiselina so dodavawe na prefiksot “tio”. Dokolku vo kiselinata pove}e od eden kisloroden atom se zameneti so atomi na sulfur, pred sufiksot “tio” se imenuva i stehimetriskiot indeks na atomot na sulfur iska`an na gr~ki. Primeri: H 3 As. O 3 S tioarsenova kiselina (H 3 As. O 4 arsenova kiselina), H 3 As. O 2 S 2 ditioarsenova kiselina, H 3 As. OS 3 tritioarsenova kiselina. Kiselini {to vo kiselinskiot radikal ne sodr`at nitu kislorod nitu sulfur. Primeri: HAu. Cl 4 tetrahloroauratna(III) kiselina, H 2 Pt. Cl 4 tetrahloroplatinatna(II) kiselina, HPF 6 heksafluorofosfatna(V) kiselina, H 2 Sn. Cl 6 heksahlorostanatna(IV) kiselina, HBF 4 tetrafluoroboratna kiselina Op{ta i neorganska hemija I, Analiti~ka biohemija, Valentin Mir~eski 61

V. 4. Hidroksidi, bazi Hidroksidite se soedinenija koi se obrazuvaat me|u metalite i hidroksidnata (OH) grupa. Hidroksidite {to se rastvorlivi vo voda i pri toa disociraat na metalni katjoni i hidroksidni anjoni se narekuvaat bazi. Metodi za dobivawe na hidroksidite: 1. Rastoruvawe na metalen oksid vo voda. Na 2 O + H 2 O = 2 Na. OH 2. Reakcija na nekoi soli i bazi. Fe. Cl 3 + 3 Na. OH = Fe(OH)3 + 3 Na. Cl 3. So vzaemodejstvo na alkalen metal i voda. 2 Li + 2 H 2 O = 2 Li. OH + H 2 4. Pri reakcija na peroksid so voda 2 Na 2 O 2 + 2 H 2 O = 4 Na. OH + O 2 Op{ta i neorganska hemija I, Analiti~ka biohemija, Valentin Mir~eski 62

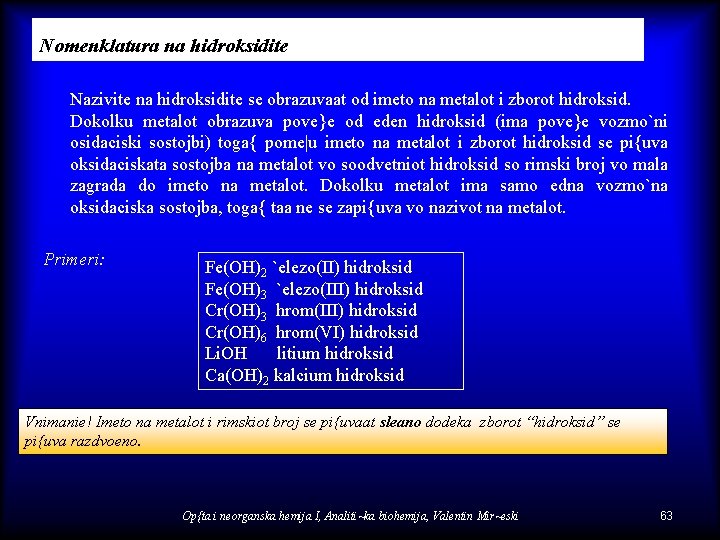
Nomenklatura na hidroksidite Nazivite na hidroksidite se obrazuvaat od imeto na metalot i zborot hidroksid. Dokolku metalot obrazuva pove}e od eden hidroksid (ima pove}e vozmo`ni osidaciski sostojbi) toga{ pome|u imeto na metalot i zborot hidroksid se pi{uva oksidaciskata sostojba na metalot vo soodvetniot hidroksid so rimski broj vo mala zagrada do imeto na metalot. Dokolku metalot ima samo edna vozmo`na oksidaciska sostojba, toga{ taa ne se zapi{uva vo nazivot na metalot. Primeri: Fe(OH)2 `elezo(II) hidroksid Fe(OH)3 `elezo(III) hidroksid Cr(OH)3 hrom(III) hidroksid Cr(OH)6 hrom(VI) hidroksid Li. OH litium hidroksid Ca(OH)2 kalcium hidroksid Vnimanie! Imeto na metalot i rimskiot broj se pi{uvaat sleano dodeka zborot “hidroksid” se pi{uva razdvoeno. Op{ta i neorganska hemija I, Analiti~ka biohemija, Valentin Mir~eski 63

IV. 5. Solite formalno se dobivaat so zamena na vodorodnite atomi, {to se vo sosatavot na hidrosidnite grupi na kiselinata so nekoj metal, ili pak so zamena na OH grupata kaj hidroksidite so nekoj nemetal odnosno kiselinski radikal. Metodi za dobivawe na solite: 1. Reakcija na neutralizacija Na. OH + HCl = Na. Cl + H 2 O 2. Reakcija pome|u metal i kiselina Fe + 2 HCl = Fe. Cl 2 + H 2 3. Reakcija pome|u sol i baza Cu. SO 4 + 2 Na. OH = Na 2 SO 4 + Cu(OH)2 4. Direktna sinteza pome|u metal i nemetal Fe + S = Fe. S 5. Reakcija pome|u metalen oksid i kiselina Pb. O + 2 HCl = Pb. Cl 2 + H 2 O 6. Reakcija pome|u sol i kiselina Ag. NO 3 + HCl = Ag. Cl + HNO 3 7. Reakcija pome|u dve soli Ca. Cl 2 + Mg. SO 4 = Ca. SO 4 + Mg. Cl 2 8. Reakcija pome|u bazen i kiselinski oksid Mg. O + SO 2 = Mg. SO 3 9. Reakcija pome|u kiselinski oksid i baza CO 2 + Ca(OH)2 = Ca. CO 3 + H 2 O Op{ta i neorganska hemija I, Analiti~ka biohemija, Valentin Mir~eski 64

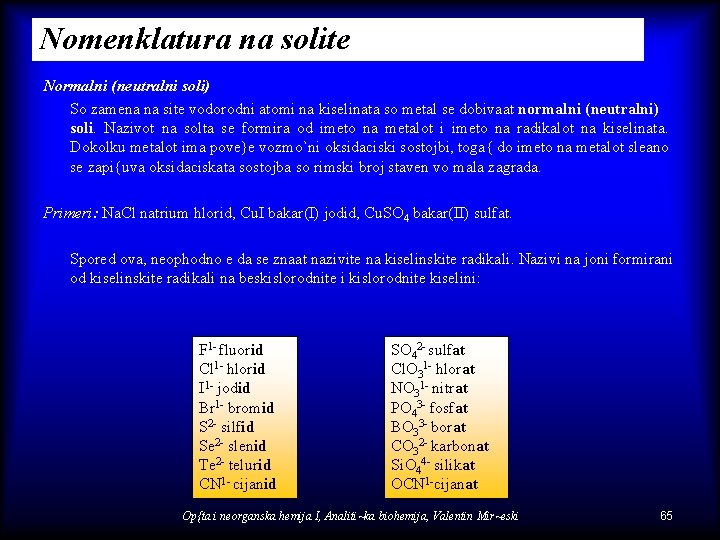
Nomenklatura na solite Normalni (neutralni soli) So zamena na site vodorodni atomi na kiselinata so metal se dobivaat normalni (neutralni) soli. Nazivot na solta se formira od imeto na metalot i imeto na radikalot na kiselinata. Dokolku metalot ima pove}e vozmo`ni oksidaciski sostojbi, toga{ do imeto na metalot sleano se zapi{uva oksidaciskata sostojba so rimski broj staven vo mala zagrada. Primeri: Na. Cl natrium hlorid, Cu. I bakar(I) jodid, Cu. SO 4 bakar(II) sulfat. Spored ova, neophodno e da se znaat nazivite na kiselinskite radikali. Nazivi na joni formirani od kiselinskite radikali na beskislorodnite i kislorodnite kiselini: F 1 - fluorid Cl 1 - hlorid I 1 - jodid Br 1 - bromid S 2 - silfid Se 2 - slenid Te 2 - telurid CN 1 - cijanid SO 42 - sulfat Cl. O 31 - hlorat NO 31 - nitrat PO 43 - fosfat BO 33 - borat CO 32 - karbonat Si. O 44 - silikat OCN 1 -cijanat Op{ta i neorganska hemija I, Analiti~ka biohemija, Valentin Mir~eski 65

Kiselinskite radikali na beskislorodnite kiselini, odnosno jonite formirani od ovie radikali, dobivaat nazivi spored nemetalot i nastavkata ID. Kiselinskite radikali na osnovnite kislorodni kiselini, odnosno jonite formirani od ovie radikali, gi formiraat nazivite vrz osnova na nazivot na nemetalot i nastavkata AT. Nazivi na jonite formirani od radikalite na kiselinite {to se izvedeni od osnovnite kiselini: Cl. O 21 Cl. O 41 PO 31 P 2 O 44 As. SO 33 - hlorit (Cl. O 31 - hlorat) hipohlorit perhlorat metafosfat pirofosfat tioarsenat Op{ta i neorganska hemija I, Analiti~ka biohemija, Valentin Mir~eski 66

z Nazivite na radikalite i jonite na “per” kiselinite vo nazivot dobivaat prefiks PER i nastavka AT. z Nazivite na radikalite i jonite na “esta” kiselinite vo nazivot dobivaat nastava IT. z Nazivite na radikalite i jonite na “hipo-esta” kiselinite vo nazivot dobivaat prefiks HIPO i nastavka IT. Primeri: Na. Cl. O 2 natrium hlorit (Na. Cl. O 3 narim hlorat) Ca(Cl. O)2 kalcium hipohlorit KCl. O 4 kalium perhlorat Cu(PO 3)2 bakar(II) metafosfat Fe 2 P 2 O 4 `elezo(II) pirofosfat Ni (As. SO )2 nikel(II) tioarsenat Hirogen soli se 3 oni soli 3 kaj koi eden ili pove}e vodorodni atomi na kiselinata ne se supstituirani so metal. Primeri: Na. HSO 4 natrium hidrogensulfat, KH 2 PO 4 kalium dihidrogenfosfat. Hidrogen solite dobivaat naziv so dodavawe na prefiksot “HIDROGEN” pred imeto na kiselinskiot radikal. Dokolku vo kiselinskiot radikal postojat pove}e od eden vodoroden atom, pred prefiksot “HIDROGEN” se imenuva i stehiometriskiot indeks na vodorodniot atom iska`an na gr~ki. Op{ta i neorganska hemija I, Analiti~ka biohemija, Valentin Mir~eski 67

z Hidroksid soli se oni soli koi{o vo svojat sostav sodr`at i hidroksidna grupa pokraj metalot i kiselinskiot radikal. Primeri: Bi. OHSO 4 bizmt(III) hidroksid sulfat, Bi(OH)2 Cl bizmut(III) dihidroksid hlorid. z Nazivite na hidroksid solite se obrazuvaat analogno na hidrogen solite, so taa razlika {to prefiksot “HIDROGEN” e zamenet so terminot “HIDROKSID”. Zabele{ka! Terminot HIDROKSID se pi{uva odvoeno od imeto na metalot i kiselinskiot radikal, dodeka prefiksot HIDROGEN se pi{uva sleano so imeto na radikalot! z Oksid soli se oni soli koi{to vo svojat sostav sodr`at kisloroden atom (oksiden jon O 2 -) pokraj metalot i kiselinskiot radikl. Primeri: Bi. OCl bizmt(III) oksid hlorid, UO 2 SO 4 uran(VI) dioksid sulfat. z Nazivite na oksid solite se obrazuvaat analogno na hidroksid solite, so taa razlika {to terminot “HIDROKSID” e zamenet so terminot “OKSID”. Op{ta i neorganska hemija I, Analiti~ka biohemija, Valentin Mir~eski 68

z Dvojni (me{ani) soli se onie soli koi{to vo svojat sostav sodr`at dva ili pove}e razli~ni metali ili kiselinski radikali. Primeri: Na. KSO 4 natrium kalium sulfat, Ca. Cl(Cl. O) kalcium hlorid hipohlorit. z Nazivite na dvojnite soli se formiraat spored pravilata za obi~nite soli samo {to se imenuvaat poodelno dvata metala ili dvata kiselinski radikali. z Kristalohidrati se onie soli koi{to vo svojot sostav sodr`at edna ili pove}e molekuli voda. Primer: Na 2 CO 3. 10 H 2 O natrium karbonat dekahidrat Ni. Cl 2. 6 H 2 O nikel(II) hlorid heksahidrat z Nazivite na kristalohidratite se formiraat spored pravilata za obi~nite soli samo {to posle imeto na solta odvoeno se dodava zborot HIDRAT na koj{to mu se dodava prefiks koj go ozna~uva stehiometriskiot koeficient {to se odnesuva na brojot molekuli voda, iska`an na gr~ki. Op{ta i neorganska hemija I, Analiti~ka biohemija, Valentin Mir~eski 69
 Jaglerodna kiselina formula
Jaglerodna kiselina formula Jonski soedinenija
Jonski soedinenija Hemiska ravenka
Hemiska ravenka Hemiski reakcii
Hemiski reakcii Metalna vrska
Metalna vrska Suplementan
Suplementan Kartografski znaci
Kartografski znaci Objektivno i subjektivno
Objektivno i subjektivno Sta znaci nnn
Sta znaci nnn Sigurni znakovi smrti
Sigurni znakovi smrti Sta znaci bonton
Sta znaci bonton Verbalna i neverbalna komunikacija ppt
Verbalna i neverbalna komunikacija ppt Vrste paralelograma
Vrste paralelograma Tehpro d.o.o.
Tehpro d.o.o. Kako se zbrajaju razlomci
Kako se zbrajaju razlomci Sta znaci sss
Sta znaci sss Vrste zapaljenja
Vrste zapaljenja Saobraćajni znakovi obavještenja
Saobraćajni znakovi obavještenja Svjetla za maglu koliko metara
Svjetla za maglu koliko metara Znak pesacki prelaz
Znak pesacki prelaz Sto znaci mjeriti duljinu
Sto znaci mjeriti duljinu Dvokratnik broja 9
Dvokratnik broja 9 što znači hemolitičan uzorak
što znači hemolitičan uzorak Topografski znakovi
Topografski znakovi Slidetodoc.com
Slidetodoc.com