Hemiski Vrski Jonska Kovalentna i Vodorodna Vrska Znai



















- Slides: 32

Hemiski Vrski Jonska, Kovalentna i Vodorodna Vrska

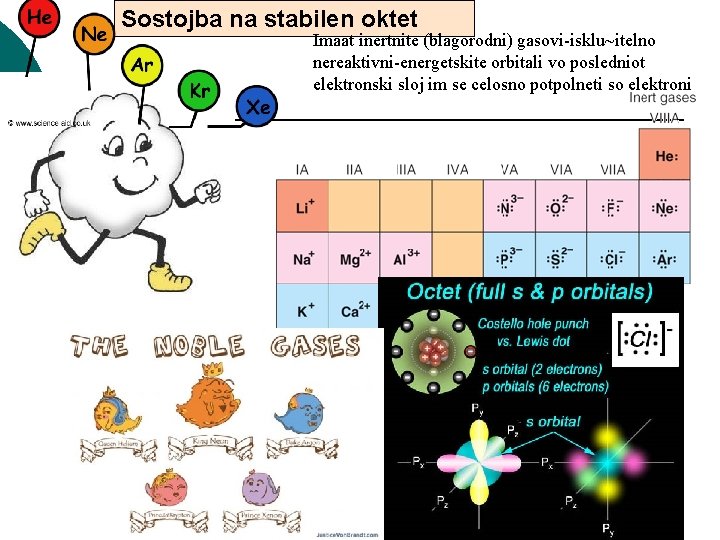
Zna~i, vo ovaa lekcija treba da nau~ime -Zo{to atomite na razli~nite hemiski elementite reagiraat i kako doa|a do nivno svrzuvawe: -Koi se silite {to atomite gi dr`at zaedno vo soedinenijata? Elektronite na golem broj od elementite, koga se vo osnovna sostojba, poseduvaat golema potencijalna energija za da vlezat vo hemiska reakcija. Kako i sekoj eden objekt vo prirodata, taka i hemiskite elementi se stremat da ja namalat svojata potencijalna energija i da dojdat vo edna stabilna energetska sostojba. A stabilna sostojba kaj hemiskite elementi , e, vo su{tina, stabilna elektronska konfiguracija {to ja imaat Blagorodnite gasovi. Toa zna~i, sekoj element se svrzuva vo soedinenija so cel da dojde vo sostojba vo koja bi imal Najniska mo`na energija. Pod Stabilna elektronska sostojba vo hemijata se podrazbira sostojba na stabilen OKTET, odnosno sostojba na celosno popolneti elektronski orbitali vo posledniot elektronski sloj. Toa e elektronskata konfiguracija {to vsu{nost ja imaat Blagorodnite gasovi He, Ne, Ar, Kr, Xe, Rn Primeri za golema potencijalna energija

Sostojba na stabilen oktet Imaat inertnite (blagorodni) gasovi-isklu~itelno nereaktivni-energetskite orbitali vo posledniot elektronski sloj im se celosno potpolneti so elektroni

1. Jonska Vrska ¡ ¡ e rezultat na elektrostatsko “+ -” privlekuvawe na joni koi imaat sprotiven polne`. Primer-sozdavawe na Na. Cl od elementarni Na i Cl Vo posledniot elektronski sloj, atomot na Na ima eden elektron, a atomot na Cl ima 7 elektroni. Za da dojde Na vo stabilna sostojba na inerten gas, potrebno e da go oddade elektronot od svojot posleden elektronski sloj, dodeka pak na Cl mu treba da prime eden elektron za da dobie stabilna 8 -elektronska konfiguracija na inerten gas. So ispu{tawe na Eden elektron, atomot na Na preminuva vo pozitiven Na+ katjon, dodeka pak So primawe na eden elektron, Cl preminuva vo Cl- awon. Pritoa, doa|a do silno elektrostatsko privlekuvawe Pome|u Na+ i Cl- jonite. Vakvata vrska se vika jonska vrska-mnogu silna

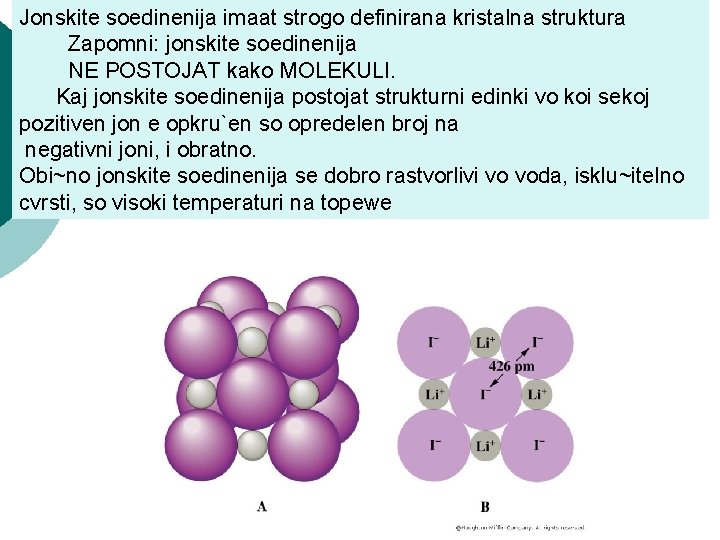
Jonskite soedinenija imaat strogo definirana kristalna struktura Zapomni: jonskite soedinenija NE POSTOJAT kako MOLEKULI. Kaj jonskite soedinenija postojat strukturni edinki vo koi sekoj pozitiven jon e opkru`en so opredelen broj na negativni joni, i obratno. Obi~no jonskite soedinenija se dobro rastvorlivi vo voda, isklu~itelno cvrsti, so visoki temperaturi na topewe

Joni na preodnite metali-vo najgolem del se oboeni Cr+3 Fe+2 Mn+2 Co+2 Fe+3 Ni+2 Cu+2 Zn+2

Ne site soedinenija vo prirodata se Jonski. Zatoa, potrebno bilo razrabotka na druga teorija da se objasnat vrskite kaj nejonskite soedinenija -Sloev Model na Atomot-e prv ~ekor kon objasnuvaweto na kovalentnata vrska kaj soedinenijata G. N. Lewis 1875 -1946 Lewis-ovi Simboli-elementite se prika`uvaat zaedno so svoite valetni elektroni = Grupa A # Atomite, spored Lewis, se prika`uvaat so nivnite hemiski simboli i so to~ki okolu simbolot, koi se vsu{nost VALENTNITE ELEKTRONI od posledniot elektronski sloj na toj atom. Valentni elektroni, rekovme, se onie elektroni {to u~estvuvaat vo gradeweto na hemiskite vrski, i tie se elektronite od posledniot elektronski sloj.

Lewis-ov Simbol za sulfur Primer: Sulfur => S Smesten e vo Grupata VIA zna~i ima 6 valentni elektroni. : S : .

Lewis-ovi Elektronski simboli za nekoi hemiski elementi -zapamti-brojot na valentnite elektroni se sovpa|a so brojot na grupata vo koja elementot e smesten vo periodniot sistem

2. Kovalentna Vrska -e rezultat na delba na elektroni pome|u istorodni ili razli~ni atomi, so cel da se dobie stabilna 8 elektronska konfiguracija vo posledniot elektronski sloj. -Sekoj atom u~estvuva so po eden (ili pove}e) elektron(i) vo kreiraweto na vrskata. Elektronite {to se delat pripa|aat istovremeno i na dvata atomi {to u~estvuvaat vo formiraweto na taa kovalentna vrska. Primer, formirawe na Molekula na Cl 2 od dva atomi na Cl. (Sekoj atom na Cl ima 7 valentni elektroni). . . : Cl. +. Cl: . . . . : Cl: ili nakratko, Cl-Cl, kade “: ” = “-” . .

Praviloto na STABILEN OKTET postoi i kaj kovalentnata vrska H: 1 s 1 Definicija: Pri formiraweto na kovalentnite soedinenija atomite {to ja gradat vrskata O: 1 s 22 p 4 spodeluvaat parovi od elektroni, Da go razgledame formiraweto na soedinenieto voda od elementarni atomi na taka {to nivnite vodorod i kislorod. Sekoj atom na vodorod ima elektronska konfiguracija 1 s 1 (vodorodot ima samo eden elektron). Za da dobie elektronska konfiguracija na valentni inerten gas najblizok do nego, a toa e He (He ima elektronska konfiguracija 1 s 2), vodorodot treba da ima u{te eden elektron vo svojot sostav. Kislorodot pak, ima elektronski konfiguracija 1 s 2 2 p 4. Zna~i, toj vo posledniot elektronski sloj ima 6 valentni sloevi postignat elektroni. Za da dojde do sostojba na stabilen oktet, mu nedostasuvaat u{te 2 elektroni. Taka, dva atomi na vodorod i eden atom na kislorod vleguvaat vo stabilna reakcija, pri {to doa|a do spodeluvawe na po eden par elektroni (po eden elektron od sekoj atom na vodorod i dva elektroni od atomot na kislorod), i konfiguracija pritoa se formiraat dve kovalentni vrski. Zaedni~kite elektronski parovi pripa|aat podednakvo i na atomite na vodorod i na kislorodot. Na toj na~in, sekoj atom na od osum elektroni. vodorod }e ima po dva elektroni (taka }e dobie stabilna konfiguracija na intertniot gas He), a kislorodot }e ima 8 elektroni vo posledniot elektronski sloj (ili elektronska konfiguracija na blagoroden gas N e). Na takov na~in se objasnuva postoeweto na kovalentite vrski.

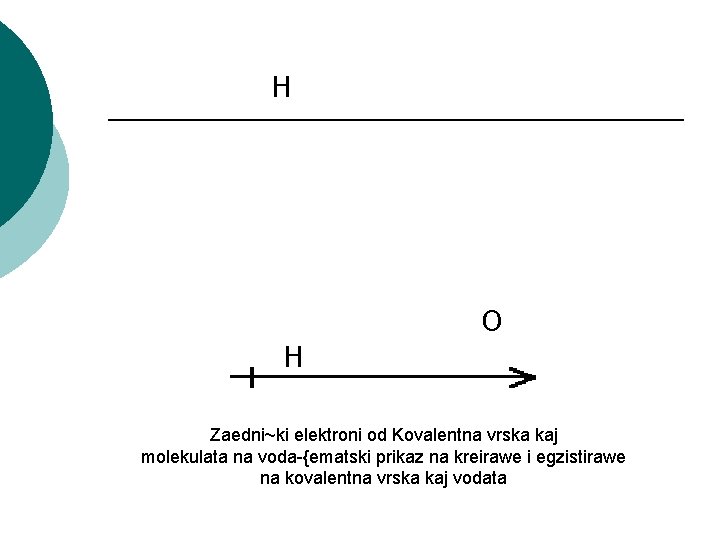
H O H Zaedni~ki elektroni od Kovalentna vrska kaj molekulata na voda-{ematski prikaz na kreirawe i egzistirawe na kovalentna vrska kaj vodata

Zapomni: Kovalentnata -e rezultat na delba na elektroni pome|u istorodni Vrskaili razli~ni atomi, so cel da se dobie stabilna 8 elektronska konfiguracija vo posledniot elektronski sloj. . . : Cl. . . . Cl: . .

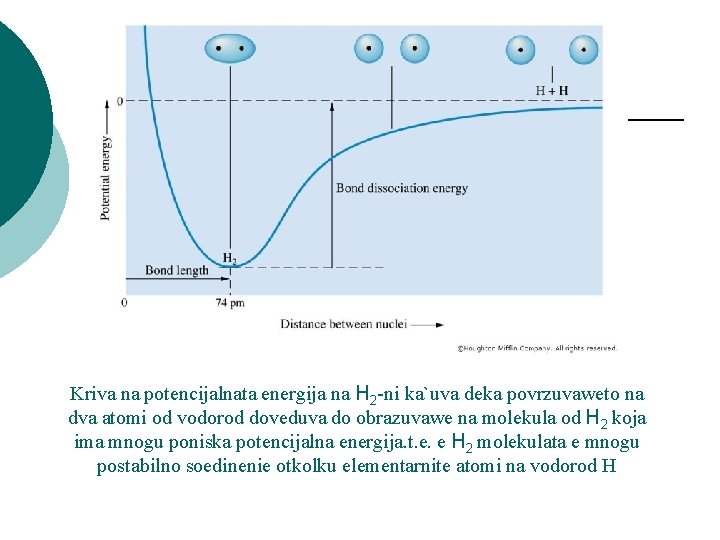
Kriva na potencijalnata energija na H 2 -ni ka`uva deka povrzuvaweto na dva atomi od vodorod doveduva do obrazuvawe na molekula od H 2 koja ima mnogu poniska potencijalna energija. t. e. e H 2 molekulata e mnogu postabilno soedinenie otkolku elementarnite atomi na vodorod H

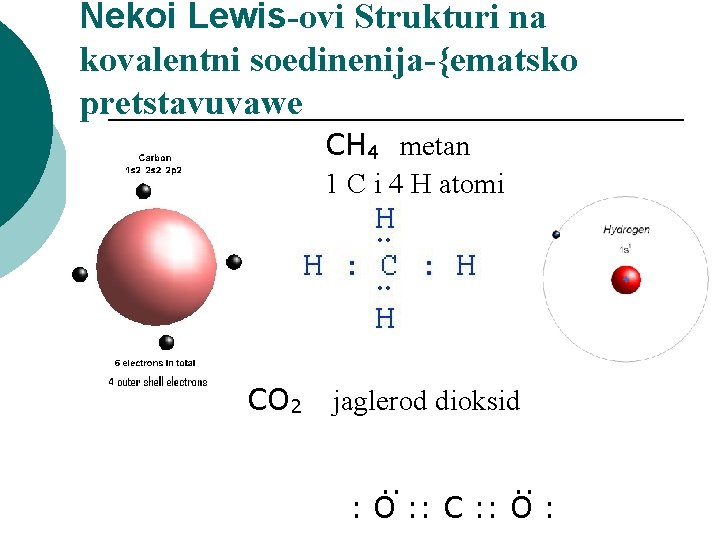
Nekoi Lewis-ovi Strukturi na kovalentni soedinenija-{ematsko pretstavuvawe CH 4 metan 1 C i 4 H atomi CO 2 jaglerod dioksid . . : O : : C : : O :

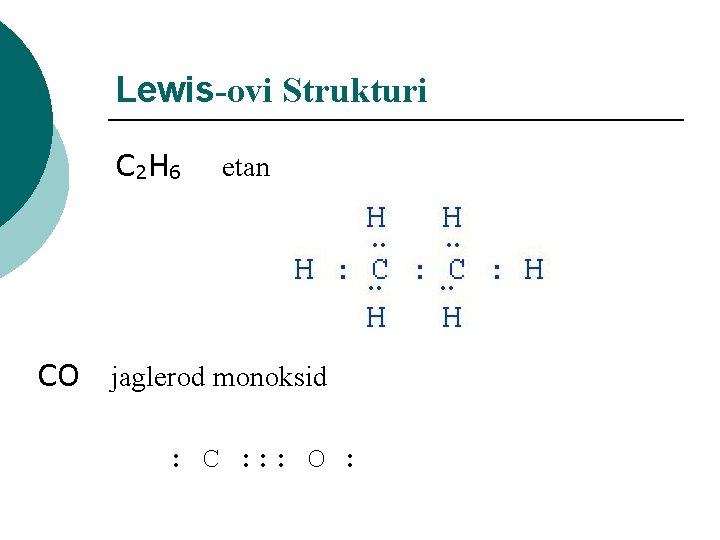
Lewis-ovi Strukturi C 2 H 6 etan CO jaglerod monoksid : C : : : O :

Isklu~oci od praviloto za oktet NO azot monoksid . . N : : O:

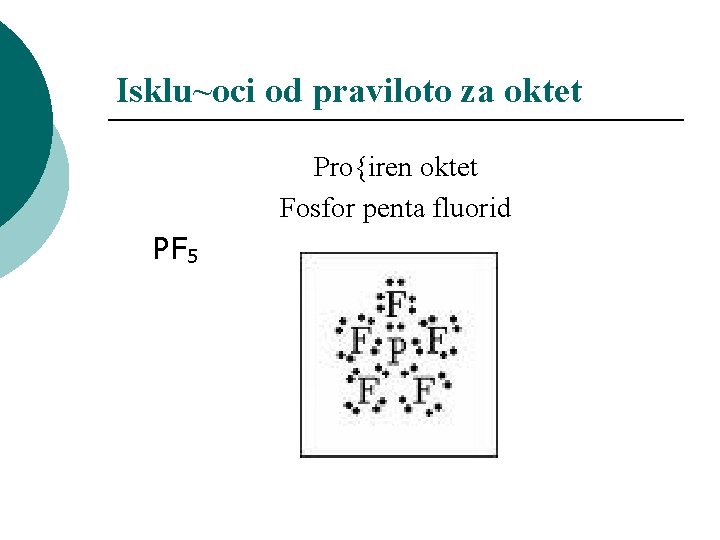
Isklu~oci od praviloto za oktet Pro{iren oktet Fosfor penta fluorid PF 5

Pove}ekratni kovalentni vrski Dvojna vrska => 2 para na spodeleni elektroni Trojna vrska => 3 para na spodeleni elektroni Obi~no se sre}ava kaj: C atomite; N atomite; O atomite; C atomite i N, O ili S atomite N atomite i O ili S atomite i O atomite

Pove}ekratni kovalentni vrski

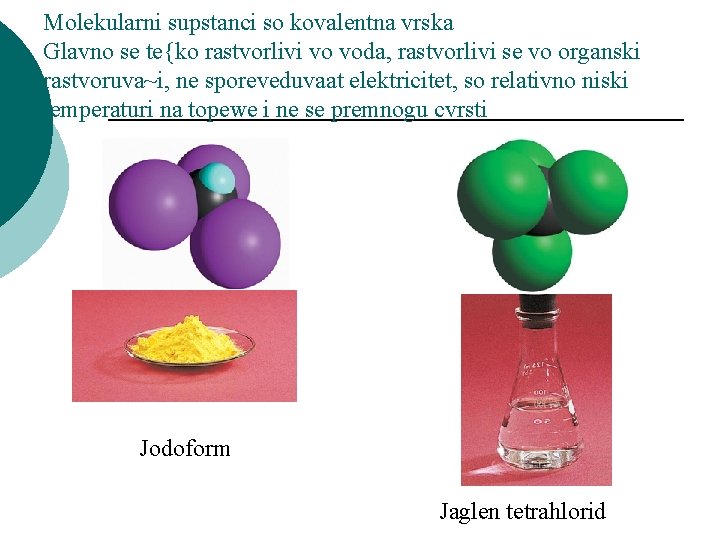
Molekularni supstanci so kovalentna vrska Glavno se te{ko rastvorlivi vo voda, rastvorlivi se vo organski rastvoruva~i, ne sporeveduvaat elektricitet, so relativno niski temperaturi na topewe i ne se premnogu cvrsti Jodoform Jaglen tetrahlorid

Komparacija na svojstvata me|u jonskite i kovalentnite soedinenija Gotvarska sol Jonski soedinenija Cvrsti na sobna temperatura Mnogu visoki temperaturi natopewe Kovaletni soedinenija ne se cvrsti kako jonskite soedinenija generalno, imaat poniski temperaturi na topewe Sproveduvaat elektricitet koga se rastvoreni vo voda pomalku se rastvorlivi vo voda otkolku jonskite soedinenija, nivnite rastvori ne sproveduvaat elektricitet Jaki elektroliti Nikakvi ili mnogu slabi elektroliti Strukturata e izgradena od joni so sprotiven polne` Tie se molekularni soedinenija izgradeni od molekuli [e}er

Mnogu e bitno da znaeme kako }e raspoznaeme kakov e tipot na vrskata vo edno dadeno soedinenie? Linus Pauling 1901– 94 Amerikanski hemi~ar eden od retkite dobitnici na 2 Nobelovi nagradi vo 1954 i 1962. Pridonel kon raspoznavaweto na tipot na vrskite vo soedinenijata

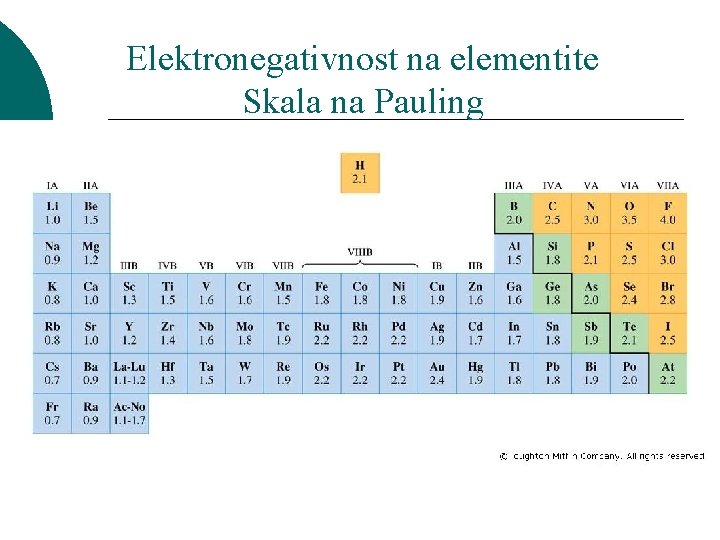
Elektronegativnost ¡ ¡ ¡ Elektronegativnost e Relativna sposobnost na atomite da privlekuvaat elektroni, kako sopstveni, taka i od drugi atomi Elektronegativnosta se zgolemuva odej}i od dolniot lev agol sprema gorniot desen agol na periodniot sistem Fluor: najgolema elektronegativnost = 4. 0

Elektronegativnost na elementite Skala na Pauling

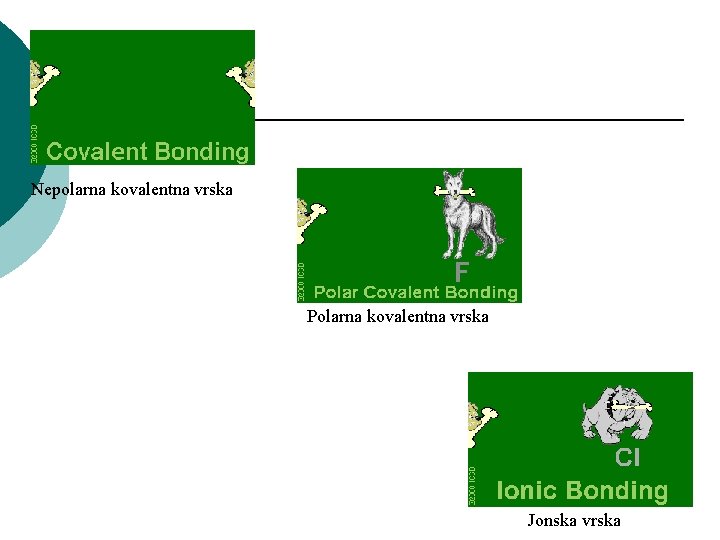
Svojstva na vrskite Elektronegativnost-EN NEpolarni kovalentni vrski => razl. vo EN = 0 Polarni kovalentni vrski Jonski vrski => razl. vo EN 0 < EN < 1. 5 => razl. vo EN > 1. 5 Od kakov tip se vrskite vo soedinenijata O=O; H 2 O; Na. F? Nepolarna kovalentna O=O; Polarna kovalentna vrska: H 2 O Jonska vrska: Na. F Kako znaeme? Gi gledame brojnite vrednosti za elektronegativnost na atomite{to u~estvuvaat vo gradbata na edna vrska (od prethodnata tabela) i pravime ednostavno razlika pome|u tie elektronegativnosti, i od razlikata vo elektronegativnostite zaklu~uvame za kakva vrska se raboti.

Nepolarna kovalentna vrska Polarna kovalentna vrska Jonska vrska

VODORODNA VRSKA-EDNA OD NAJBITNITE VRSKI vo UNIVERZUMOT, BEZ NEA NITU `ivot na Zemjata, nitu NIE BI SME POSTOELE!!! Eve zo{to: Molekulata na voda ima mala molekulska masa od samo 18 (ili molarna masa od 18 g/mol). Prose~nata molekulska masa na vozduhot e 27. E sega, bidej}i molekulata na vodata ima mala masa, pomala od prose~nata molekulska masa na vozduhot, vodata bi bila mnoooogu slabo privle~ena od zemjinata gravitacija i taa ne bi se nao|ala vo dolnitesloevi na atmosferata, tuku bi izbegala vo gornite sloevi, a tamunie ne bi mo`ele da ja koristime. E toa ne e taka, zatoa {to kaj vodata postojat t. n. vodorodni vrski pome|u razli~nite molekuli na voda. Imeno, vrskata vo molekulata na voda e silno polarna, bidej}i Kislorodot ima pogolem afinitet kon elektronite od kovalentnata vrska so vodorodot (O ima pogolema elektronegativnost od H), i vo molekulata na voda delot kade {to e O ima parcijalen negativen polne`, dodeka delot kade {to se H-atomite ima pozitiven polne`. Taka, ako imame pove}e molekuli na voda, doa|a do privlekuvawe na pozitivnite delovi (H-atomite) od edna molekula na voda, so delovite so negativen polne`(O-atomite) od druga sosedna molekula voda, pri {to se sozdava cvrsta vodorodna vrska koja gi dr`i molekulite na voda silno povrzani vo edna kompaktna struktura i zatoa vodata e te~na. Vo sportivno, ako nema vakva vodorodna vrska, vodata bi bila vo gasna sostojba, i kako {to rekovme, taa ne bi postoela Vo atmosferata, tuku }e otidela nagore kon stratosferata. A bez voda=nema `ivot!

Vodorodnata vrska e edna od najzna~ajnite vrski prisutni Vo molekulite na DNA

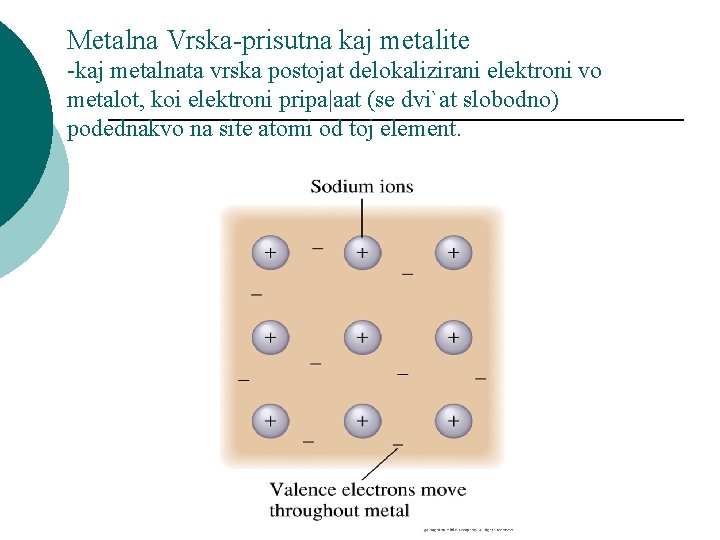
Metalna Vrska-prisutna kaj metalite -kaj metalnata vrska postojat delokalizirani elektroni vo metalot, koi elektroni pripa|aat (se dvi`at slobodno) podednakvo na site atomi od toj element.

Pra{awe Sporedi gi O-O i O=O. Dali se o~ekuva O=O vrskata da bide Pojaka, poslaba, ili identi~no silna kako i O-O vrskata?

Pra{awe Dali o~ekuva{ O=O vrskata da bide Podolga, pokratka, ili ednakvo dolga kako i O-O vrskata?