I MODELLI ATOMICI LA STRUTTURA DELLATOMO GLI ISOTOPI




















- Slides: 27

ØI MODELLI ATOMICI ØLA STRUTTURA DELL’ATOMO Ø GLI ISOTOPI ØLA TAVOLA PERIODICA DEGLI ELEMENTI Ø LE MOLECOLE ØGLOSSARIO


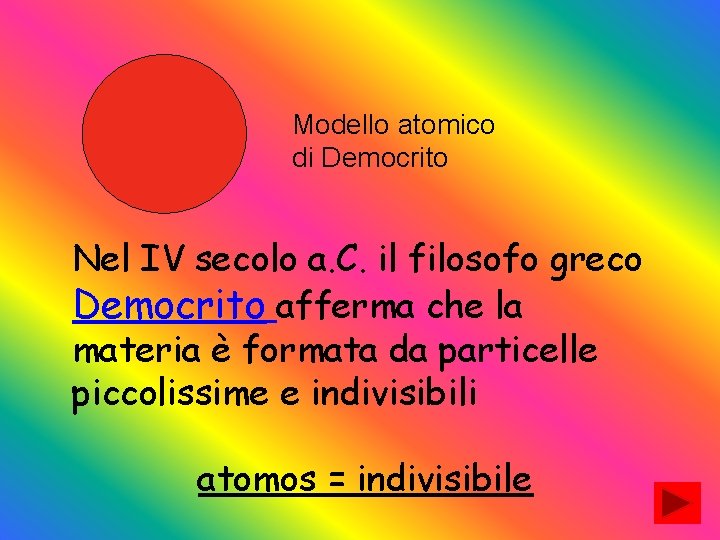
Modello atomico di Democrito Nel IV secolo a. C. il filosofo greco Democrito afferma che la materia è formata da particelle piccolissime e indivisibili atomos = indivisibile

Nel 1808 lo scienziato Dalton riprende questa ipotesi e rappresenta l’atomo come una sfera piena.

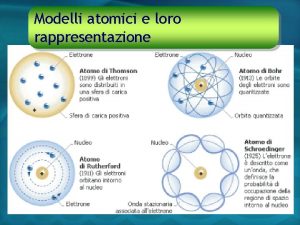
Nel 1897 Thomson , fisico inglese, studiando il passaggio della corrente elettrica nei gas ipotizzò un atomo formato da particelle con carica elettrica Positiva (e+) Negativa (e-) protoni elettroni


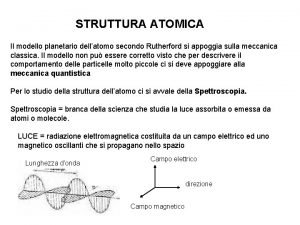
Nel 1911 gli scienziati Rutherford e Bohr ipotizzano un atomo simile al sistema solare: un nucleo denso di carica positiva nel quale è concentrata quasi tutta la massa dell’atomo e elettroni di carica negativa che gli ruotano attorno a notevole distanza.

Nel 1926 si diffonde la teoria quantistica: gli elettroni seguono orbite precise e formano una nuvola di carica negativa intorno al nucleo che è costituito da protoni e neutroni.

I fisici oggi hanno individuato particelle subatomiche ancora più piccole che formano i protoni e i neutroni: i quark


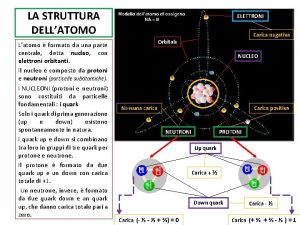
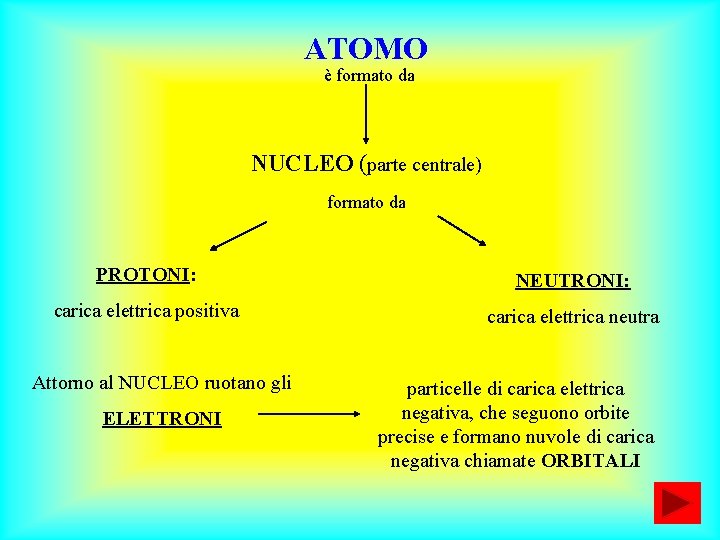
ATOMO è formato da NUCLEO (parte centrale) formato da PROTONI: NEUTRONI: carica elettrica positiva carica elettrica neutra Attorno al NUCLEO ruotano gli ELETTRONI particelle di carica elettrica negativa, che seguono orbite precise e formano nuvole di carica negativa chiamate ORBITALI

Le tre cariche (neutra dei neutroni, positiva dei protoni, negativa degli elettroni) si annullano a vicenda L’ATOMO, QUINDI, È NEUTRO


PER COMINCIARE. . .

E’ il numero di elettroni Negli atomi di un elemento non può mai cambiare

E’ la somma dei neutroni e dei protoni In alcuni atomi il numero dei neutroni può cambiare Il numero di massa può variare


Gli atomi di un elemento con numero diverso di neutroni si chiamano: ISOTOPI Tutti gli isotopi di un elemento hanno le stesse proprietà chimiche.

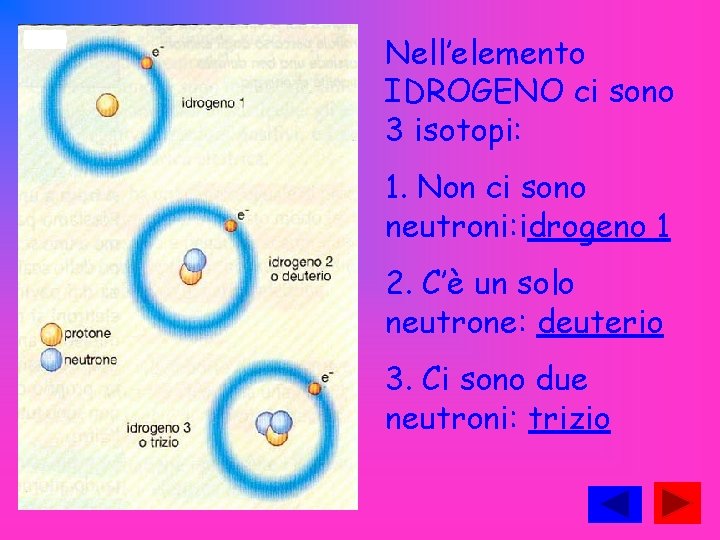
Nell’elemento IDROGENO ci sono 3 isotopi: 1. Non ci sono neutroni: idrogeno 1 2. C’è un solo neutrone: deuterio 3. Ci sono due neutroni: trizio


Dimitrij Ivanovic Mendeelev e Lothar Meyer LA TAVOLA PERIODICA DEGLI ELEMENTI Nelle caselle di questa tavola sono riportati il nome, il numero atomico e il peso atomico di ogni elemento

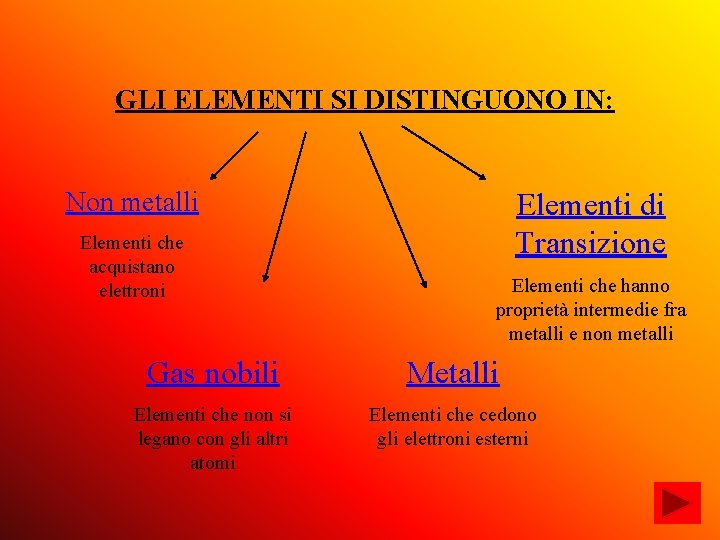
GLI ELEMENTI SI DISTINGUONO IN: Non metalli Elementi che acquistano elettroni Elementi di Transizione Elementi che hanno proprietà intermedie fra metalli e non metalli Gas nobili Metalli Elementi che non si legano con gli altri atomi Elementi che cedono gli elettroni esterni

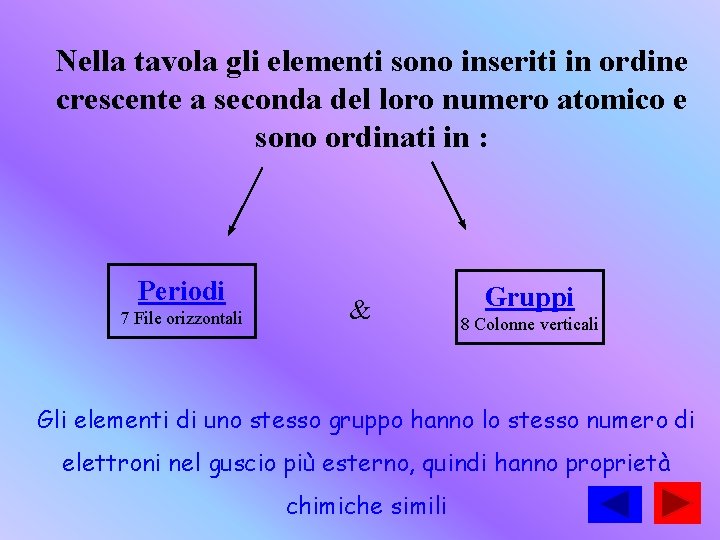
Nella tavola gli elementi sono inseriti in ordine crescente a seconda del loro numero atomico e sono ordinati in : Periodi 7 File orizzontali & Gruppi 8 Colonne verticali Gli elementi di uno stesso gruppo hanno lo stesso numero di elettroni nel guscio più esterno, quindi hanno proprietà chimiche simili

LE MOLECOLE: ELEMENTI E COMPOSTI ØIn natura vi sono 92 elementi chimici e perciò vi sono 92 tipi di atomi, uno per ogni elemento. ØAd ogni elemento corrisponde un nome e un simbolo formato da una o due lettere.

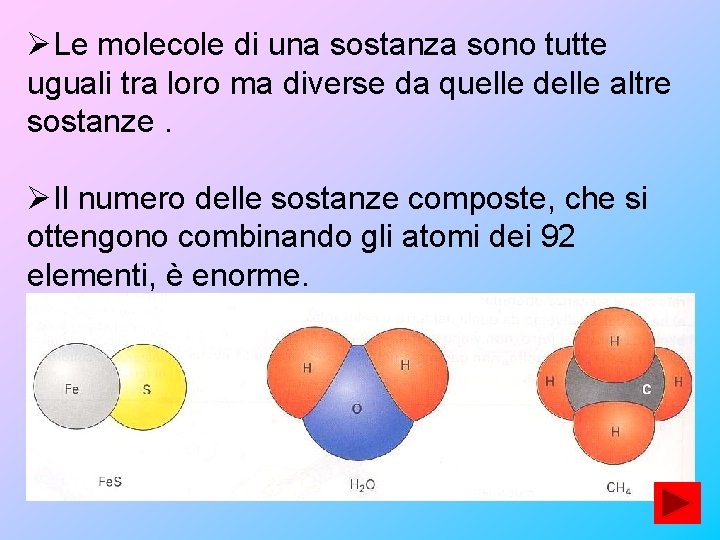
ØLe molecole di una sostanza sono tutte uguali tra loro ma diverse da quelle delle altre sostanze. ØIl numero delle sostanze composte, che si ottengono combinando gli atomi dei 92 elementi, è enorme.

QUASI TUTTE LE SOSTANZE CON CUI ABBIAMO A CHE FARE NORMALMENTE, DALLO ZUCCHERO ALLE MATERIE PLASTICHE, DAI MEDICINALI AI COMBUSTIBILI, SONO SOSTANZE COMPOSTE.

GLOSSARIO Elettroni: particelle con carica negativa che ruotano attorno al nucleo Protoni: particelle con carica positiva che si trovano all’interno del nucleo Neutroni: particelle di carica neutra che si trovano all’interno del nucleo Numero atomico: numero degli elettroni ( e quindi dei protoni) presenti in un atomo. Peso atomico: peso di tutte le particelle (protoni, neutroni ed elettroni) presenti nell’atomo. Non metalli: elementi che tendono ad acquistare elettroni. Metalli: elementi che tendono a cedere gli elettroni esterni. Gas nobili: elementi che non tendono né ad acquistare né a cedere elettroni, e quindi non si legano con altri atomi. Elementi di transizione: elementi che hanno proprietà intermedie tra metalli e non metalli. Gruppi: colonne verticali della tavola periodica. Periodi: file orizzontali della tavola periodica.
 Evoluzione modelli atomici
Evoluzione modelli atomici Joseph john dalton
Joseph john dalton Isotopi
Isotopi Normalità chimica
Normalità chimica Modelo atomici
Modelo atomici Da mendel ai modelli di ereditarietà
Da mendel ai modelli di ereditarietà Kounin glasser jones
Kounin glasser jones Razionalità sinottica
Razionalità sinottica Modelli deterministici psicologia
Modelli deterministici psicologia Modelli di apprendimento
Modelli di apprendimento Modelli di erogazione dell'assistenza infermieristica
Modelli di erogazione dell'assistenza infermieristica Modelli base lapbook punti cardinali
Modelli base lapbook punti cardinali Modelli di gestione delle risorse umane
Modelli di gestione delle risorse umane Modelli di programmazione lineare
Modelli di programmazione lineare Classificazione modelli didattici
Classificazione modelli didattici Organigramma radiale
Organigramma radiale Gli ostacoli della vita
Gli ostacoli della vita Beatissimum
Beatissimum Gli articoli scuola primaria classe terza
Gli articoli scuola primaria classe terza Che cosa sono i numeri interi
Che cosa sono i numeri interi Studiamo gli ebrei perché
Studiamo gli ebrei perché Esempi di animali cordati
Esempi di animali cordati Chi erano gli aedi
Chi erano gli aedi Il primo canto della divina commedia
Il primo canto della divina commedia Nome dei poligoni
Nome dei poligoni Gli stati di aggregazione della materia
Gli stati di aggregazione della materia Popolari e ottimati
Popolari e ottimati Habitat e nicchia ecologica scuola primaria
Habitat e nicchia ecologica scuola primaria