I Modelli Atomici Il modello di J Dalton
















- Slides: 17

I Modelli Atomici Il modello di J. Dalton (1803) – Leggi ponderali della chimica – Formulazione della teoria atomica – Modello “a palla da biliardo”: biliardo l’atomo è una sfera compatta indivisibile 1 ottobre 2003 Elena Truffo 1

I Modelli Atomici Il modello di J. J. Thomson (1904) – Scopre che i raggi catodici sono costituiti da elettroni – La materia ordinaria è neutra – Modello “a panettone”: l’atomo è costituito da una carica positiva uniformemente distribuita in una sfera all’interno della quale sono immersi gli elettroni 1 ottobre 2003 Elena Truffo 2

Gli elettroni La scoperta degli elettroni (1897) Nel 1879 Crookes scopre che ponendo, in un tubo a vuoto, 2 elettrodi tra i quali si stabilisce un forte differenza di potenziale, si osserva una fluorescenza sul vetro di fronte al catodo, dovuta a radiazioni emesse dal catodo raggi catodici. Nel 1897 Thomson conclude che i raggi catodici sono formati da particelle con carica elettrica negativa (elettroni) 1 ottobre 2003 Elena Truffo 3

I Modelli Atomici Il modello di Rutherford (1911) Deflessione di particelle a da parte di una sottile lamina metallica – La carica positiva di un atomo è localizzata in un nucleo molto più piccolo delle dimensioni atomiche – Modello planetario: planetario nucleo carico positivamente attorno al quale ruotano gli elettroni su orbite circolari e concentriche – … problemi di instabilità: per leggi dell’elettrodinamica una carica elettrica accelerata irradia energia – dovrebbe diminuire il raggio dell’orbita e gli elettroni dovrebbero cadere sul nucleo! 1 ottobre 2003 Elena Truffo 4

Le particelle Esperienza di Rutherford (1909) Due allievi di Rutherford bombardarono una lamina sottilissima di oro con particelle (nuclei di He); uno schermo rivelatore indicava i punti di arrivo della particelle, permettendo quindi di stabilirne la traiettoria dopo il passaggio attraverso la lamina. Le particelle per la maggior parte passavano senza subire nessuna deviazione, ma alcune venivano deviate secondo vari angoli e alcune addirittura respinte. 1 ottobre 2003 Elena Truffo 5

La Teoria dei quanti I quanti di luce - Planck (1901) – Ogni volta che avviene, da parte della materia, emissione o assorbimento della radiazione elettromagnetica la quantità di energia scambiata è legata alla frequenza della radiazione dalla relazione E=h – h=6. 626 10 -34 Js costante di Planck – L’energia della radiazione e. m. non è distribuita continuità nello spazio, bensì è raccolta in quanti detti fotoni 1 ottobre 2003 Elena Truffo 6

Gli spettri di emissione Niels Bohr Le regolarissime righe emesse dall’idrogeno eccitato suggeriscono la possibilità di usare la teoria di Planck per interpretare, allo stesso tempo, le modalità di produzione delle righe spettrali e la struttura dell’atomo di idrogeno. Egli considerò le righe degli spettri di emissione dei diversi gas come segnali del contenuto energetico degli elettroni presenti. La costanza delle righe e la loro elevata specificità dovevano essere legate alla struttura degli atomi stessi 1 ottobre 2003 Elena Truffo 7

Spettro di emissione Idrogeno 1 ottobre 2003 Elena Truffo 8

I Modelli Atomici Il modello di Bohr (1913) (modello quantistico) - Introduce 2 postulati che non hanno riscontro in meccanica classica - Gli elettroni ruotano su orbite circolari attorno al nucleo. Solo le orbite per cui il momento angolare L=mv. R=nh/2 sono permesse. Fino a che l’elettrone rimane su un’orbita permessa l’atomo non irraggia onde elettromagnetiche (stato stazionario) - Energia, sotto forma di radiazione e. m. , è emessa o assorbita solo per transizioni da uno stato stazionario ad un altro. La frequenza della radiazione soddisfa alla relazione h =|Ei-Ef| 1 ottobre 2003 Elena Truffo 9

Verso la moderna teoria Da Bohr alla teoria moderna Alcuni anni dopo che Bohr aveva proposto il suo modello i fisici fanno due importanti scoperte - Il principio di indeterminazione di Heisenberg (1927): esistono coppie di grandezze che non possono venire misurate contemporaneamente con la necessaria precisione L'incertezza nel determinare la posizione x di una particella e l'incertezza nel determinare la quantità di moto (mv) non sono grandezze indipendenti, ma risultano correlate alla costante di Plank h dalla seguente espressione: ovvero: - La doppia natura dell'elettrone da parte di de Broglie (1924): ad ogni particella in movimento è associata un’onda detta di fase la cui λ=h/mv Non era piú possibile trattare l'elettrone come una particella classica. 1 ottobre 2003 Elena Truffo 10

Equazione di Schrodinger (1927) Schrodinger Descrive il comportamento di un elettrone con l’equazione d’onda (equazione differenziale di 2° ordine) La funzione d’onda ψ può essere considerata come l’ampiezza dell’onda e il suo quadrato misura la probabilità di trovare l’elettrone in un determinato punto dello spazio. L’equazione ammette soluzioni accettabili solo se E assume valori ben definiti. 1 ottobre 2003 Elena Truffo 11

I Numeri Quantici Le funzioni d’onda che rappresentano soluzioni fisicamente accettabili vengono definite autofunzioni dell’equazione stessa. Nella loro espressione matematica compaiono tre coefficienti numerici i cui valori sono sufficienti a definire la funzione: i numeri quantici (n, m e l) 1 ottobre 2003 Elena Truffo 12

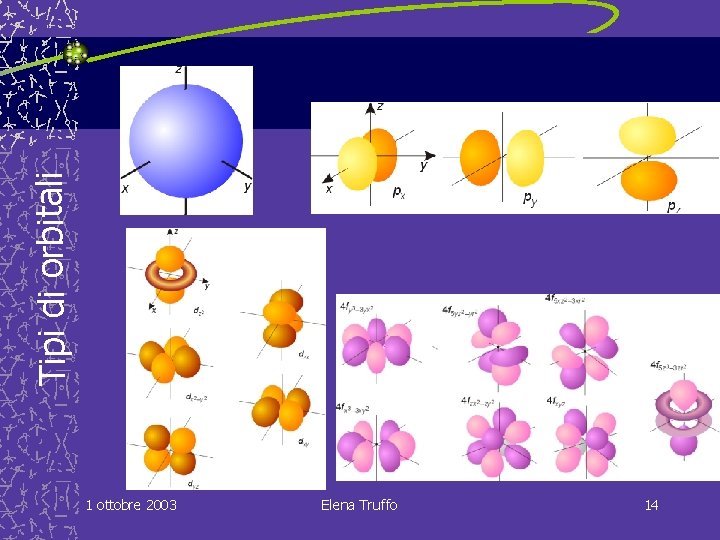
L’atomo probabilistico Gli orbitali atomici Sono le funzioni che si ottengono come soluzione dell'equazione di Schrodinger e sono visualizzabili come regioni dello spazio intorno al nucleo, nelle quali é possibile trovare l'elettrone. Hanno varie forme e si protendono lontano dal nucleo in modo diverso, in relazione ai numeri quantici che ne caratterizzano la funzione d'onda. Ogni funzione d'onda, o orbitale, descrive uno stato dell'atomo. Le diverse funzioni d'onda di un atomo si denotano indicando i valori dei tre numeri quantici: n, l, m; a ogni terzetto di numeri quantici corrisponde un orbitale ben preciso 1 ottobre 2003 Elena Truffo 13

Tipi di orbitali 1 ottobre 2003 Elena Truffo 14

I numeri n, m e l I numeri quantici IL NUMERO QUANTICO PRINCIPALE n puó assumere valori maggiori o uguali a 1. Ha il ruolo piú importante nel determinare l'energia dell’orbitale. IL NUMERO QUANTICO ANGOLARE l è legato al valore del momento angolare che l'elettrone ha nel suo moto intorno al nucleo; può assumere come valori i numeri interi da 0 a n-1 e determina la forma degli orbitali. IL NUMERO QUANTICO MAGNETICO m determina l'inclinazione del vettore momento angolare dell'elettrone; può assumere come valori i numeri interi tra -l e +l e determina l'orientamento degli orbitali nello spazio. Elena Truffo 1 ottobre 2003 15

Le particelle elementari I Quarks Chadwick scopre i neutroni (1932) Protoni, neutroni ed elettroni sono stati a lungo considerati particelle elementari, cioè particelle indivisibili e semplici. Kendall Friedman e Taylor sparano elettroni contro i protoni contenuti nel nucleo di H neutroni e protoni sono a loro volta costituiti da quarks, quarks particelle elementari che non possono essere isolate singolarmente. 1 ottobre 2003 Elena Truffo 16

I Modelli atomici Il modello standard Secondo il più recente modello di atomo ci sono dodici particelle fondamentali di materia: 6 quarks e 6 particelle chiamate leptoni, leptoni una categoria che include gli elettroni Quarks e leptoni saranno formati da particelle ancora più piccole? 1 ottobre 2003 Elena Truffo 17