HEMATOLOGIE ANMIE II HEMOCHROMATZA STAV PATOLOGICK FYZIOLOGIE 1
































































- Slides: 81

HEMATOLOGIE ANÉMIE II. , HEMOCHROMATÓZA ÚSTAV PATOLOGICKÉ FYZIOLOGIE 1. LF UK V PRAZE http: //patf. lf 1. cuni. cz OTÁZKY A PŘIPOMÍNKY K VÝUCE HEMATOLOGIE: MUDr. PAVEL KLENER, Ph. D. , pavel. klener@lf 1. cuni. cz

ANÉMIE II. - PREZENTACE V BODECH 1. Mikrocytární anémie A. Metabolismus železa B. Přetížení železem: hereditární hemochromatóza a sekundární hemosideróza C. Sideropenická anémie a chronická ztráta krve D. Anémie chronických onemocnění E. Další mikrocytární anémie 2. Megaloblastové a další makrocytární anémie A. Megaloblastové anémie B. Další makrocytární anémie 3. Autoimmunní hemolytické anémie (AIHA): získané, Coombs-pozitivní 4. Mikroangiopatické hemolytické anémie (MAHA): získané, Coombs-negativní

1. MIKROCYTÁRNÍ ANÉMIE

1. A. METABOLISMUS ŽELEZA

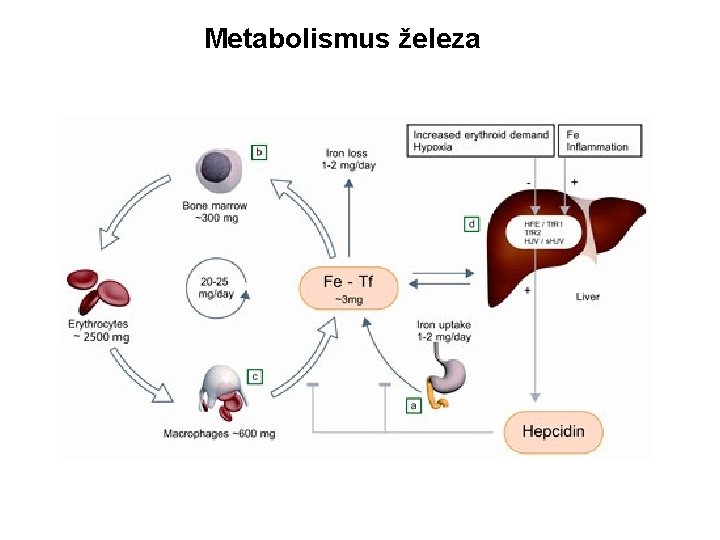
Metabolismus železa Denní spotřeba železa při krvetvorbě = cca 25 mg Fe. Opakování z minulé přednášky: Vypočítaný celkový objem krve u dospělého člověka (80 kg)= 70 x 80= cca 5. 600 m. L. Životnost erytrocytu = cca 120 dní, tj. 1/120 celkového objemu krve se musí denně vytvořit. 5. 600/120= 46, 6= cca 50 m. L / 1 den. Obsah železa v 50 m. L plné krve= ½, tj. 25 mg. Denní spotřeba je však z větší míry pokryta recyklací železa. Přestárlé erytrocyty jsou vychytávány ve slezině, játrech, event. makrofázích a hemové železo je znovu použito při produkci nových erytrocytů. Díky tomu je nutné vstřebat každý den pouze cca 1 -2 mg železa / 1 den. Železo se vstřebává v duodenu.

Metabolismus železa

Metabolismus železa Účinnost vstřebávání železa z potravy=cca 10% podaného železa (při sideropenii stoupá účinnost ke 20%). Některé látky vstřebávání železa usnadňují (kyselina ascorbová, kyselina citronová, aminokyseliny), jiné blokují (fytáty, taniny, antacida). Některé prvky soutěží s železem o stejné transportní proteiny (zinek, magnézium, olovo, kobalt aj. )

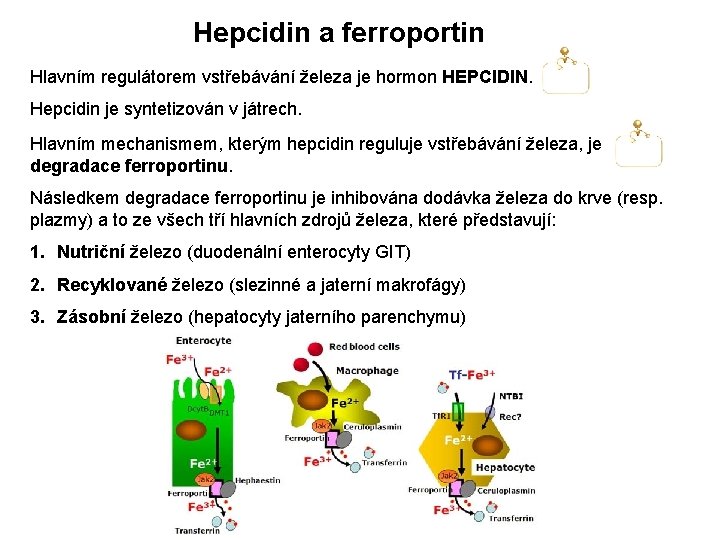
Metabolismus železa Železo musí být nejprve redukováno (Fe 3+ Fe 2+), poté je aktivně transportováno do enterocytu duodenální sliznice přes transportní systém DMT 1 (divalent metal transporter 1). Z enterocytu je následně Fe 2+ transportováno do krevního oběhu pomocí transportéru zvaného ferroportin. Na krevní straně je železo opět oxidováno (Fe 3+ Fe 2+) a váže se na transferin (TF).

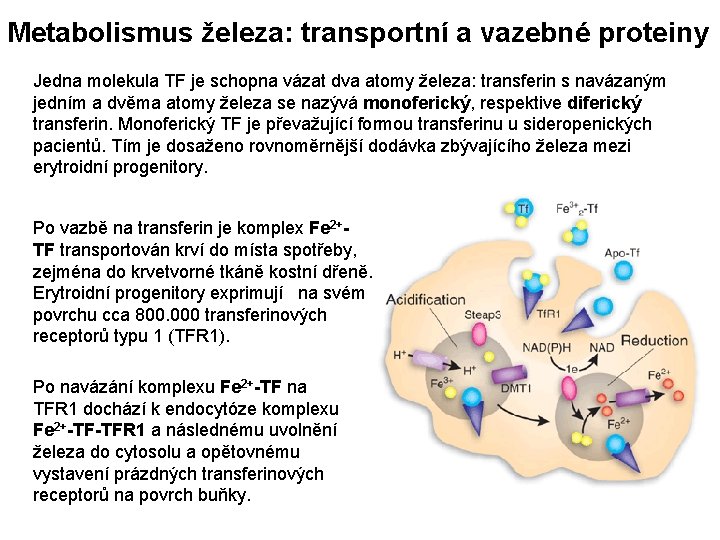
Metabolismus železa: transportní a vazebné proteiny Jedna molekula TF je schopna vázat dva atomy železa: transferin s navázaným jedním a dvěma atomy železa se nazývá monoferický, respektive diferický transferin. Monoferický TF je převažující formou transferinu u sideropenických pacientů. Tím je dosaženo rovnoměrnější dodávka zbývajícího železa mezi erytroidní progenitory. Po vazbě na transferin je komplex Fe 2+TF transportován krví do místa spotřeby, zejména do krvetvorné tkáně kostní dřeně. Erytroidní progenitory exprimují na svém povrchu cca 800. 000 transferinových receptorů typu 1 (TFR 1). Po navázání komplexu Fe 2+-TF na TFR 1 dochází k endocytóze komplexu Fe 2+-TF-TFR 1 a následnému uvolnění železa do cytosolu a opětovnému vystavení prázdných transferinových receptorů na povrch buňky.

Metabolismus železa: transportní a vazebné proteiny V cytosolu dochází k vazbě železa na feritin, který je schopen reverzibilně vázat cca 4. 500 atomů železa. Feritin přímo odráží stav zásob železa v organismu. NEEXISTUJE nespecifické snížení hladiny ferritinu. Proto vždy platí, že nízký feritin= sideropenie.

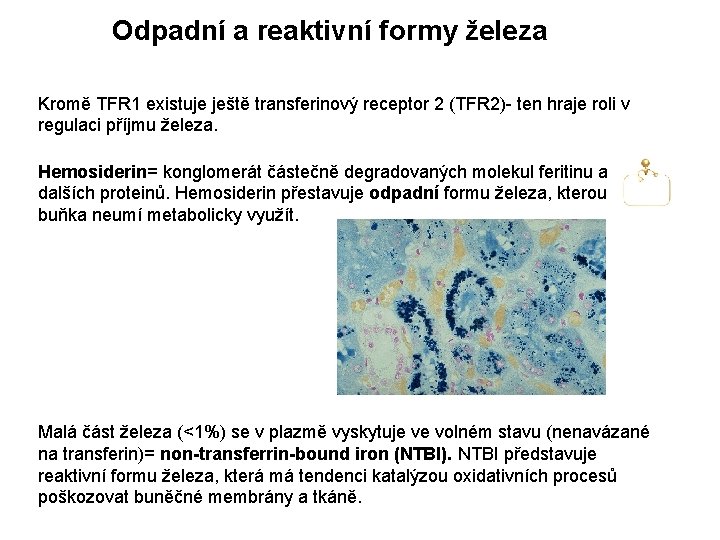
Odpadní a reaktivní formy železa Kromě TFR 1 existuje ještě transferinový receptor 2 (TFR 2)- ten hraje roli v regulaci příjmu železa. Hemosiderin= konglomerát částečně degradovaných molekul feritinu a dalších proteinů. Hemosiderin přestavuje odpadní formu železa, kterou buňka neumí metabolicky využít. Malá část železa (<1%) se v plazmě vyskytuje ve volném stavu (nenavázané na transferin)= non-transferrin-bound iron (NTBI). NTBI představuje reaktivní formu železa, která má tendenci katalýzou oxidativních procesů poškozovat buněčné membrány a tkáně.

Základní laboratorní hodnoty metabolismu železa Plazmatické železo= 6 -28 mmol/L Feritin= 10 -290 mg/L Hladina feritinu 50 -150 mg/L (ve zdravé populaci) odpovídá cca 400 -1200 mg zásobního Fe (1 mg/L ferritinu = cca 8 mg zásobního Fe). Transferin (TF)= 2 -3, 6 g/L

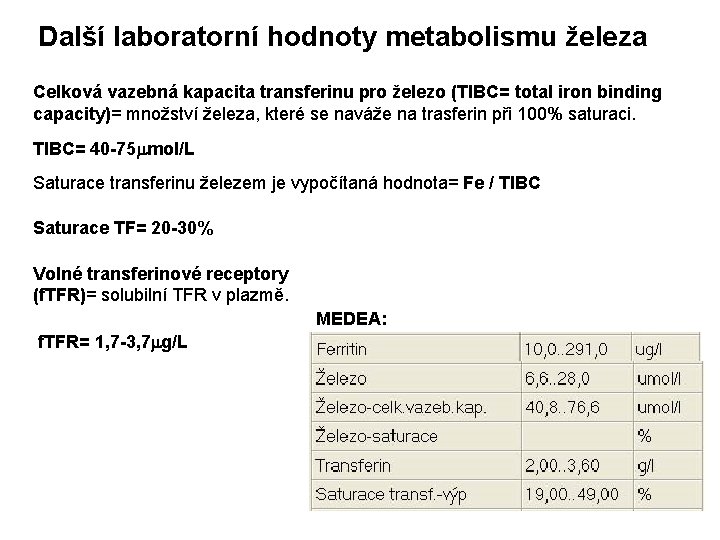
Další laboratorní hodnoty metabolismu železa Celková vazebná kapacita transferinu pro železo (TIBC= total iron binding capacity)= množství železa, které se naváže na trasferin při 100% saturaci. TIBC= 40 -75 mmol/L Saturace transferinu železem je vypočítaná hodnota= Fe / TIBC Saturace TF= 20 -30% Volné transferinové receptory (f. TFR)= solubilní TFR v plazmě. MEDEA: f. TFR= 1, 7 -3, 7 mg/L

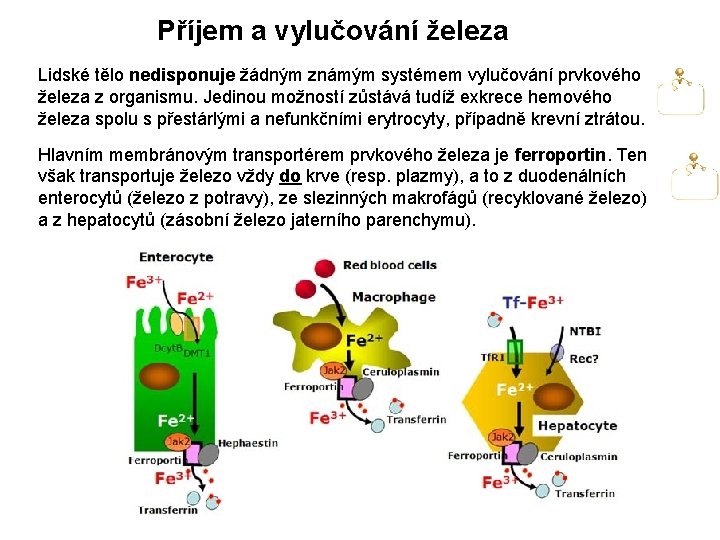
Příjem a vylučování železa Lidské tělo nedisponuje žádným známým systémem vylučování prvkového železa z organismu. Jedinou možností zůstává tudíž exkrece hemového železa spolu s přestárlými a nefunkčními erytrocyty, případně krevní ztrátou. Hlavním membránovým transportérem prvkového železa je ferroportin. Ten však transportuje železo vždy do krve (resp. plazmy), a to z duodenálních enterocytů (železo z potravy), ze slezinných makrofágů (recyklované železo) a z hepatocytů (zásobní železo jaterního parenchymu).

Hepcidin a ferroportin Hlavním regulátorem vstřebávání železa je hormon HEPCIDIN. Hepcidin je syntetizován v játrech. Hlavním mechanismem, kterým hepcidin reguluje vstřebávání železa, je degradace ferroportinu. Následkem degradace ferroportinu je inhibována dodávka železa do krve (resp. plazmy) a to ze všech tří hlavních zdrojů železa, které představují: 1. Nutriční železo (duodenální enterocyty GIT) 2. Recyklované železo (slezinné a jaterní makrofágy) 3. Zásobní železo (hepatocyty jaterního parenchymu)

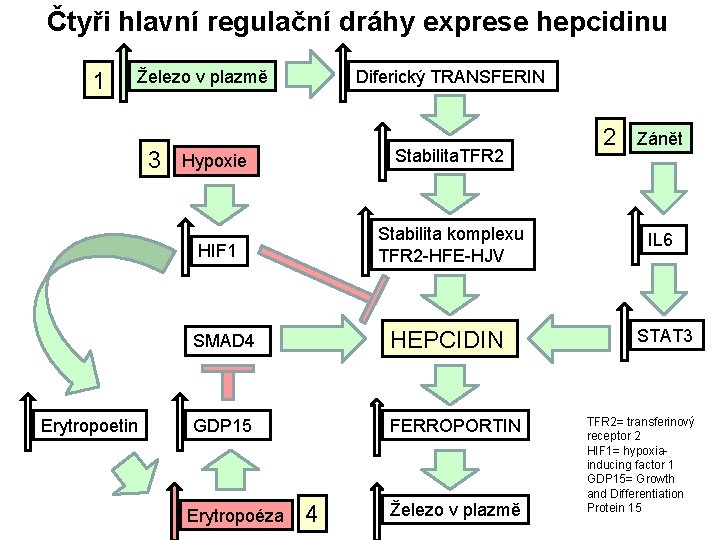
Čtyři hlavní regulační dráhy exprese hepcidinu 1 Železo v plazmě 3 Erytropoetin Diferický TRANSFERIN Hypoxie Stabilita. TFR 2 HIF 1 Stabilita komplexu TFR 2 -HFE-HJV SMAD 4 HEPCIDIN GDP 15 FERROPORTIN Erytropoéza 4 Železo v plazmě 2 Zánět IL 6 STAT 3 TFR 2= transferinový receptor 2 HIF 1= hypoxiainducing factor 1 GDP 15= Growth and Differentiation Protein 15

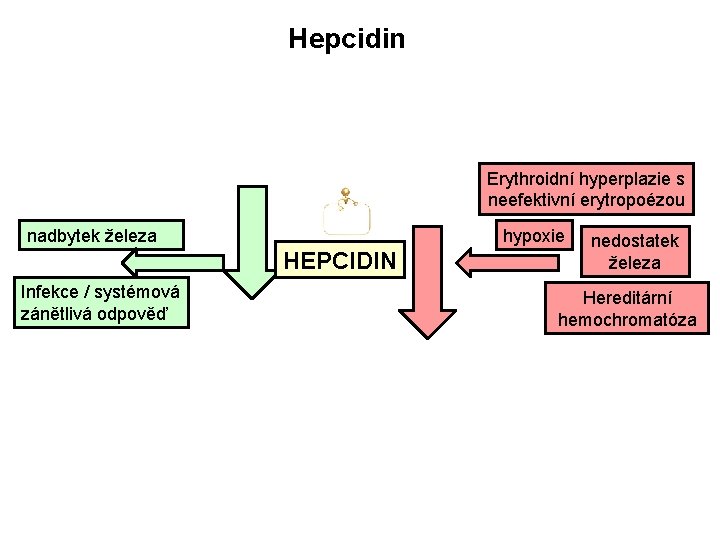
Hepcidin Erythroidní hyperplazie s neefektivní erytropoézou nadbytek železa hypoxie HEPCIDIN Infekce / systémová zánětlivá odpověď nedostatek železa Hereditární hemochromatóza

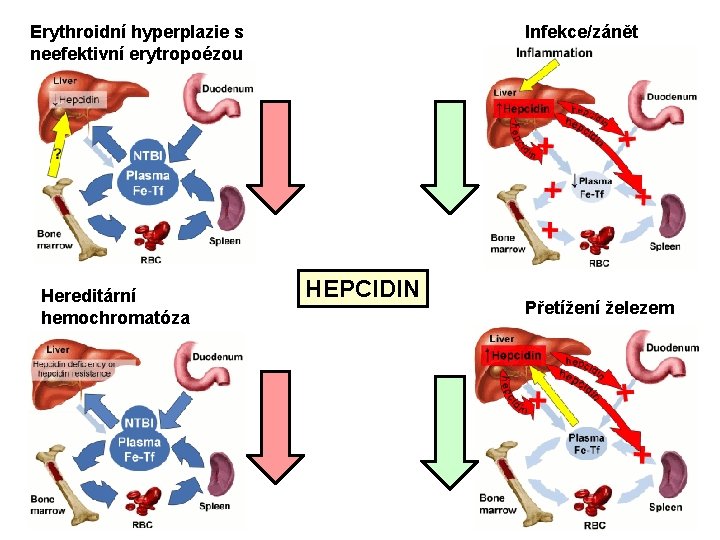
Erythroidní hyperplazie s neefektivní erytropoézou Hereditární hemochromatóza Infekce/zánět HEPCIDIN Přetížení železem

1. B. PŘETÍŽENÍ ŽELEZEM: HEREDITÁRNÍ HEMOCHROMATÓZA A SEKUNDÁRNÍ HEMOSIDERÓZA

Přetížení železem Patologickou akumulaci železa v organizmu mohou způsobit dvě hlavní skupiny onemocnění: 1. Hereditární hemochromatóza (HH)- skupina onemocnění charakterizovaná vrozenou mutací genů, které regulují příjem železa (např. HFE, hemojuvelin, hepcidin, ferroportin)= 2. (Sekundární) hemosideróza= zvýšený příjem a akumulace železa v organismu, přičemž geny regulující příjem železa nejsou primárně postiženy.

Hereditární hemochromatóza (HH) Patofyziologie: HH je skupina vrozených chorob, charakterizovaná patologicky zvýšeným příjmem železa a jeho akumulací v organismu. Všechny známé formy HH jsou způsobeny vrozenou mutací genů vyvolávajících poruchu interakce mezi hepcidinem a ferroportinem. Nemocní s HH nejsou schopni zvýšit expresi hepcidinu v odpověď na přetížení železem, nejsou tudíž schopni degradovat ferroportin a zastavit další přísun železa z potravy do organismu. Absence adekvátní syntézy hepcidinu vede proto již v mladém věku (ve 3. -4. dekádě, u juvenilních forem i dříve) k chorobnému vstřebávání železa z potravy a jeho akumulaci v parenchymatózních orgánech (játra, srdce, pankreas) a dalších tkáních (gonády, kůže, klouby).

Hereditární hemochromatóza (HH) Hemochromatóza typ 1= mutace genu HFE= nejčastější forma HH (www. ncbi. nlm. nih. gov/omim/235200) Hemochromatóza typ 2 A= mutace genu HJV (hemojuvelin) Hemochromatóza typ 2 B= mutace genu HAMP (hepcidin) Hemochromatóza typ 3= mutace genu TFR 2 (transferinový receptor 2) Hemochromatóza typ 4= mutace genu SLC 40 A 1 (ferroportin) Zásoby železa u pacientů s HH ve 3. -4. dekádě dosahují hodnot cca 20 g železa (ve srovnání s cca 1 g na osobu ve zdravé populaci).

Sekundární hemosideróza vzniká následkem zvýšeného příjmu železa, přičemž proteiny regulující expresi hepcidinu nejsou primárně narušeny (např. vrozenou mutací jako u hereditární hemochromatózy). Existují dvě hlavní příčiny rozvoje sekundární hemosiderózy: 1. Zvýšený přívod exogenního železa, téměř výlučně formou substituční terapie (transfuze krve) u nemocných s chronickými anémiemi. 2. Iron-loading anémie (viz. podrobněji další snímek) Krevní transfuze a sekundární hemosideróza: pamatuj, že 1 TU (transfuzní jednotka) krve (přesněji erymasa) je vyrobena z cca 450 m. L plné krve a obsahuje tudíž cca 220 mg prvkového železa. U všech polytransfundovaných pacientů se po podání 10 -20 TU erymas (= cca 2, 5 -5 g železa) vyvinou známky přetížení železem.

Iron-loading anémie Jako tzv. „iron-loading“ anémie se označují anémie spojené s erytroidní hyperplazií a neefektivní erytropoézou. Mezi iron-loading anémie patří např. thalasémie, časné fáze MDS, kongenitální dyserytropoetické anémie (CDA) aj. V patofyziologii iron-loading anémií hraje hlavní roli hepcidin (viz. dříve): následkem erytroidní hyperplazie dochází k inhibici exprese hepcidinu, snížené degradaci ferroportinu a chronicky zvýšenému příjmu železa z GIT. Tyto anémie jsou vždy spojeny s vysokou hladinou plazmatického železa a obvykle s normální nebo zvýšenou hladinou ferritinu. Po zahájení transfuzní terapie dochází pak nevyhnutelně k masivnímu přetížení parenchymatózních orgánů železem.

Symptomy, diagnostika a principy terapie Symptomy: přetížení železem postihuje nejčastěji parenchymatózní orgány: játra, srdce a pankreas, ale i gonády, klouby a kůži: postupně dochází k rozvoji jaterního a srdečního selhávání, bronzového diabetu mellitu, gonadální dysfunkce, pigmentace kůže aj. Vysoká hladina reaktivního železa (NTBI) vede však k většímu či menšímu poškození prakticky všech tkání. Laboratoř: zvýšená hladina plazmatického železa, vysoký ferritin (tisíce mg/L), vysoká saturace transferinu železem (>50%, ale i 100%). Diagnóza: pro definitivní diagnózu je nutné stanovení množství železa ve vzorku jaterního parenchymu získaného biopsií, molekulárně-genetické vyšetření stanoví přesný typ onemocnění.

Principy terapie A. Symptomatická terapie (= odstranění železa): 1. Flebotomie (500 m. L plné krve jednou týdně do poklesu zásob železa) 2. Erytrocytaferéza (oddělení erytrocytů na speciálním přístroji zvaném separátor- šetrnější) 3. Chelátory železa (desferioxamin, deferipron, deferasirox) B. Kauzální terapie= genová terapie (pouze experimentálně)

1. C. SIDEROPENICKÁ ANÉMIE A CHRONICKÁ KREVNÍ ZTRÁTA

Sideropenie Hladina plazmatického železa je snížena u sideropenické anémie, u infekcí včetně systémových zánětlivých odpovědí a u nádorových onemocnění. Hladina plazmatického železa je zvýšena u sideroblastické anémie, aplastické anémie, u iron-loading anémií (MDS, thalassémie aj. ) a u jaterních chorob. Feritin<10 mg/L absence zásobního železa. Sideropenická anémie je nejčastějším typem anémie a jedním z nejčastějších onemocnění na světě vůbec. Z důvodů chronické krevní ztráty (menstruace) a zvýšené spotřeby železa (těhotenství, porod, laktace) postihuje sideropenie častěji ženy než muže.

Příčiny sideropenie a chronická ztráta krve Nejčastější příčinou sideropenie v západních zemích je chronická krevní ztráta. Další možnou příčinu sideropenie představuje snížený příjem železa či malabsorpce (např. u pacientů po resekci duodena, coeliakie aj. ).

Příčiny sideropenie a chronická ztráta krve Conditio sine qua non je vždy komplexně dovyšetřit u pacienta se sideropenickou anémií příčinu sideropenie a z možných příčin vyloučit zejména skryté nádorové onemocnění (především tumory GIT a urogenitálního traktu). Kolorektální karcinom je nejčastější nádorového onemocnění u nás a chronické okultní krvácení do GIT bývá častou příčinou sideropenické anémie, která může být prvním projevem nádorového onemocnění. Odeslat staršího pacienta se sideropenickou anémií na substituci železem do domácího prostředí bez naplánování řádného dovyšetření je zločin a může mít forenzní dopad na lékaře. Naprosté vyšetřovací minimum= stolice na okultní krvácení, vyšetření močového sedimentu, zobrazovací metody (rtg plic + sono břicha)

Stádia sideropenie: 1. Prelatentní= vyčerpání zásob železa 2. Latentní= sideropenická erytropoéza (ještě však nedochází k poklesu hemoglobinu, tj. není anémie) 3. Manifestní= sideropenická anémie= pokles hemoglobinu= mikrocytární hypochromní anémie SIDEROPENIE PRELATENTNÍ MANIFESTNÍ Fe ↔ ↓ (<6) ↓ (4) Ferritin ↓ (<20) ↓ (<10) ↓ (<5) Transferin (TF) ↔ ↑ ↑ Saturace TF ↔ ↓(<20%) ↓ (<10%) f. TFR ↔ ↑ (>5) ↑ (>8) MCV/MCH ↔ ↓ ↓ Hemoglobin ↔ ↔ ↓

Symptomy A. Anemický syndrom (viz. přednáška Anémie I/Porfyrie) B. Specifické symptomy sideropenie (mimo anemický syndrom) -vyplývají z deplece železa, které tvoří součást řady důležitých buněčných enzymů (např. cytochromy). Dochází k poruše proliferace a funkčním defektům. 1. Pagofagie (=pojídání ledu), picca (=pojídání omítky, jílu, papíru aj. ) 2. Modré skléry (ztenčení pojivové tkáně sklér následkem porušené syntézy kolagenu) 3. Atrofická gastritida 4. Dysfagie, postkrikoideální ezofageální membrány a striktury (syndrom Plummer-Vinson / Kelly-Peterson= dysfagie + glossitida + sideropenie) 5. Glossitida, angulární stomatitida 6. Atrofie žaludku 7. Koilonychie= lžičkovité nehty- patognomonické pro sideropenii 8. Syndrom neklidných nohou (Ekbornův syndrom)

Laboratoř Krevní obraz: mikrocytární hypochromní anémie. Tíže sideropenie a délka jejího trvání (tedy podle délky trvání erytropoézy s deficitem železa) odpovídá hloubce mikrocytární hypochromní anémie, která může díky rozvoji kompenzačních mechanismů v některých případech dosáhnout extrémně nízkých hodnot. Laboratoř: ↓železo, ↓ferritin, ↑transferin, ↑volné transferinové receptory, ↓saturace transferinu železem, ↑celková vazebná kapacita transferinu pro železo

Terapie Substituce železem: minimálně 150 -200 mg / den (min. 25 mg železa je nutné pro denní produkci erytrocytů (50 m. L), při maximální frakci perorálně vstřebaného železa 15 -20% musíme tudíž denně per os dodat cca 200 mg prvkového železa). Preventivní podávání: 50 -100 mg / den Hladinu ferritinu kontrolujeme vždy až po normalizaci hladiny hemoglobinu.

1. D. ANÉMIE CHRONICKÝCH ONEMOCNĚNÍ (ACD)

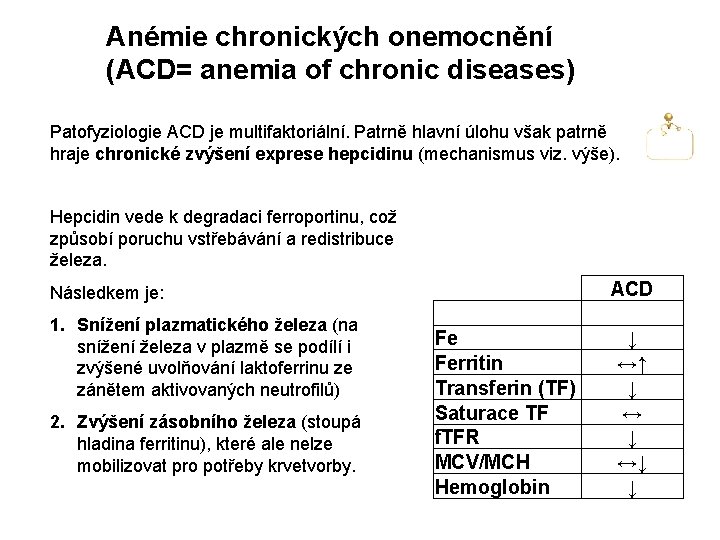
Anémie chronických onemocnění (ACD= anemia of chronic diseases) Patofyziologie ACD je multifaktoriální. Patrně hlavní úlohu však patrně hraje chronické zvýšení exprese hepcidinu (mechanismus viz. výše). Hepcidin vede k degradaci ferroportinu, což způsobí poruchu vstřebávání a redistribuce železa. Následkem je: 1. Snížení plazmatického železa (na snížení železa v plazmě se podílí i zvýšené uvolňování laktoferrinu ze zánětem aktivovaných neutrofilů) 2. Zvýšení zásobního železa (stoupá hladina ferritinu), které ale nelze mobilizovat pro potřeby krvetvorby. Fe Ferritin Transferin (TF) Saturace TF f. TFR MCV/MCH Hemoglobin ACD ↓ ↔↑ ↓ ↔↓ ↓

Patofyziologie ACD je multifaktoriální Na patofyziologii ACD se podílí: 1. Deregulace metabolismu železa způsobená chronickým zvýšením exprese hepcidinu 2. Mírně snížené přežívání erytrocytů 3. Přímá inhibice erytropoézy zánětlivými cytokiny (TNFa, IL 1, IL 6, IFNa) 4. Relativní deficit erytropoetinu ACD je tudíž anémie hypoproliferační. retikulocytopenie snížená hladina transferinových receptorů, a to jak na erytroidních progenitorech kostní dřeně, tak v plazmě (solubilní transferinové receptory (f. TFR)). f. TFR jsou u sideropenické anémie naopak výrazně zvýšené.

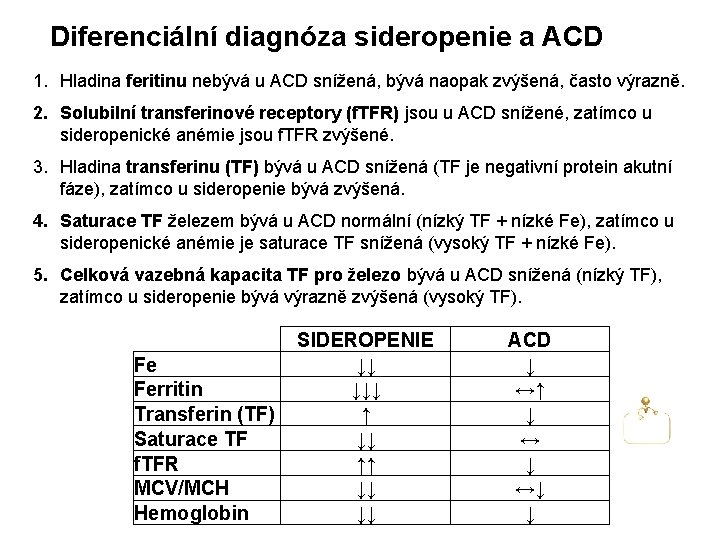
Diferenciální diagnóza sideropenie a ACD 1. Hladina feritinu nebývá u ACD snížená, bývá naopak zvýšená, často výrazně. 2. Solubilní transferinové receptory (f. TFR) jsou u ACD snížené, zatímco u sideropenické anémie jsou f. TFR zvýšené. 3. Hladina transferinu (TF) bývá u ACD snížená (TF je negativní protein akutní fáze), zatímco u sideropenie bývá zvýšená. 4. Saturace TF železem bývá u ACD normální (nízký TF + nízké Fe), zatímco u sideropenické anémie je saturace TF snížená (vysoký TF + nízké Fe). 5. Celková vazebná kapacita TF pro železo bývá u ACD snížená (nízký TF), zatímco u sideropenie bývá výrazně zvýšená (vysoký TF). Fe Ferritin Transferin (TF) Saturace TF f. TFR MCV/MCH Hemoglobin SIDEROPENIE ↓↓ ↓↓↓ ↑↑ ↓↓ ↓↓ ACD ↓ ↔↑ ↓ ↔↓ ↓

Anémie chronických onemocnění (ACD= anemia of chronic diseases) ACD je asociována se systémovými zánětlivými chorobami pojiva, s nádorovými onemocněními a s chronickými infekcemi. Anémie u ACD bývá typicky lehčího stupně (HB >100 g/L), obvykle normocytární- normochromní, nebo pouze mírně mikrocytáníhypochromní (MCV kolem 80, saturace TF>10%) Diagnóza se opírá o typický nález v krevním obraze, laboratoři a klinické symptomy (systémové zánětlivé onemocnění, nádor, autoimunita, chronická infekce aj. ). Terapie spočívá ve zaléčení základního systémového onemocnění.

1. E. DALŠÍ MIKROCYTÁRNÍ ANÉMIE

Další mikrocytární anémie 1. Hereditární sideroblastická anémie (na podkladě mutace ALAS 2) Hereditární sideroblatická anémie je vzácné onemocnění. Patří mezi tzv. iron -loading anémie. Je pro ni charakteristická vysoká hladina železa, ferritinu, časné projevy sekundární hemosiderózy a manifestace v dětském věku. 2. Získané sideroblastické anémie jsou obvykle vyvolány chronickým alkoholismem, otravou olovem, deficitem mědi, nadbytkem zinku či expozici léčivy (izoniazid, chloramfenikol). Nejčastější příčinou získané sideroblastické anémie je chronický alkoholismus. Terapie: Část pacientů s hereditární sideroblastickou anémií odpoví na terapii pyridoxal-fosfátem (vitamin B 6). Pyridoxal je totiž nezbytným kofaktorem ALAS. CAVE: Sideroblastické anémie tvoří také součást myelodysplastických syndromů (např. RARS= refrakterní anémie s prstenčitými sideroblasty). Sideroblastické anémie v rámci MDS jsou však zcela jiného charakteru. Jedná se o získané klonální poruchy krvetvorby (preleukémie) na podkladě mutací hematopoetické kmenové buňky. Anémie u pacientů s MDS je charakteristicky makrocytární.

Další mikrocytární anémie 2. Thalasémie alfa a beta- v naších podmínkách téměř výlučně thalasémie beta minor a thalasémie alfa silent carrier / tray (viz. dále hemoglobinopatie).

ANÉMIE II. - PREZENTACE V BODECH 1. Mikrocytární anémie A. Metabolismus železa B. Přetížení železem: hereditární hemochromatóza a sekundární hemosideróza C. Sideropenická anémie a chronická ztráta krve D. Anémie chronických onemocnění E. Další mikrocytární anémie 2. Megaloblastové a další makrocytární anémie A. Megaloblastové anémie B. Další makrocytární anémie 3. Autoimmunní hemolytické anémie (AIHA): získané, Coombs-pozitivní 4. Mikroangiopatické hemolytické anémie (MAHA): získané, Coombs-negativní

2. MEGALOBLASTOVÉ A DALŠÍ MAKROCYTÁRNÍ ANÉMIE
2. A. MEGALOBLASTOVÉ ANÉMIE

Vstřebávání vit. B 12 (kobalamin)

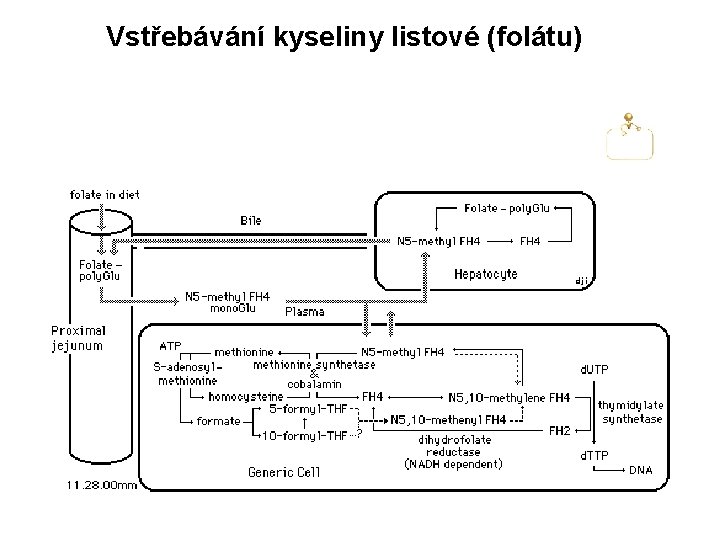
Vstřebávání kyseliny listové (folátu)

Vitamin B 12 a kyselina listová jsou nezbytnými kofaktory při syntéze DNA Vitamin B 12 a kyselina listová (folát) hrají důležitou roli jako kofaktory enzymů při syntéze thymidinu (tj. DNA).

MEGALOBLASTOVÉ ANÉMIE= anémie z nedostatku vitaminu B 12 a folátu Nedostatek vit. B 12 či folátu vede k poruše biosyntézy deoxythymidinu a tím k poruše replikace DNA, nikoli však transkripce (RNA neobsahuje thymin, ale uracyl) postiženy jsou VŠECHNY PROLIFERUJÍCÍ BUŇKY. Nedostatek thymidinu má za následek to, že DNA polymeráza začne zvýšeně chybovat při vřazování bazí DNA během replikace. Následná vystřižení chybně vložených bazí kontrolními opravnými mechanizmy DNA má za následek vznik jednovláknových zlomů DNA, neboť thymidin pro případnou opravu není k dispozici. To vyvolá zpomalení až zástavu replikace, v extrémním případě až programovou buněčnou smrt (apoptózu). Díky tomu dochází k výraznému zpomalení replikace DNA, zatímco transkripce m. RNA a následná translace proteinů není narušena. Díky opožděnému zrání jádra za cytoplazmou v populaci VŠECH hematopoetických progenitorů v kostní dřeni a vzniká typický morfologický obraz- MEGALOBLASTOVÁ PŘESTAVBA KOSTNÍ DŘENĚ.

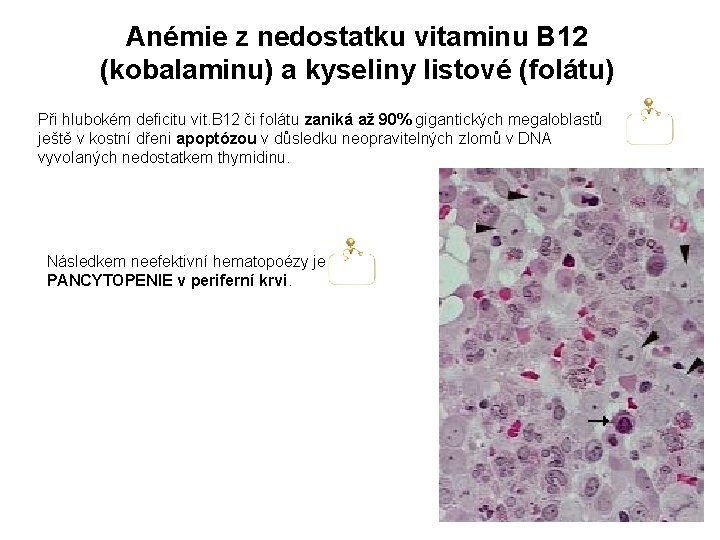
Anémie z nedostatku vitaminu B 12 (kobalaminu) a kyseliny listové (folátu) Při hlubokém deficitu vit. B 12 či folátu zaniká až 90% gigantických megaloblastů ještě v kostní dřeni apoptózou v důsledku neopravitelných zlomů v DNA vyvolaných nedostatkem thymidinu. Následkem neefektivní hematopoézy je PANCYTOPENIE v periferní krvi.

Typické nálezy v KO u megaloblastových anémií Typické nálezy u megaloblastových anémií: 1. Pancytopenie v periferní krvi (makrocytární anémie s retikulocytopenií, trombocytopenie, leukopenie) 2. Hypersegmentované neutrofily v periferní krvi 3. Megaloblastová přestavba kostní dřeně (=hypercelulární kostní dřeň (celularita kostní dřeně se blíží 100%), megaloblasty- zejména gigantické metamyelocyty a tyče)

Klinický obraz 1. Typickým nálezem u pacientů s těžkým deficitem vit. B 12 či folátu je charakteristická barva kůže a sliznic: kombinace bledého odstínu při anémii a žlutavého zabarvení při ikteru vznikajícím následkem extravaskulární hemolýzy (předčasnou smrtí erytroidních progenitorů v kostní řeni). 2. Dalším typickým nálezem je glossitida- červený vyhlazený jazyk bez papil s ulceracemi po stranách jazyka (podobné projevy na jazyku a sliznicích lze vidět u pacientů léčených cytostatiky ze skupiny antimetabolitů kyseliny listové (např. methotrexát). 3. Epitelové dysplazie vyplývají z poruchy syntézy DNA (ta postihuje všechny proliferující buňky. Jedná se zejména o dysplastické změny děložní sliznice a děložního čípku. Z toho plyne snížená fertilita až sterilita. 4. Mírné kognitivní dysfunkce postihují jak pacienty s deficitem vitaminu B 12, tak kyseliny listové. Neuropsychiatrické symptomy se však vyskytují pouze u deficitu vitaminu B 12.

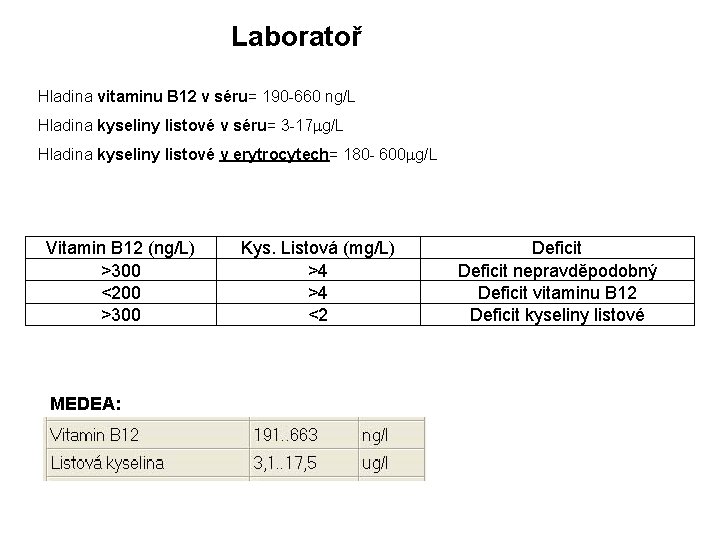
Laboratoř Hladina vitaminu B 12 v séru= 190 -660 ng/L Hladina kyseliny listové v séru= 3 -17 mg/L Hladina kyseliny listové v erytrocytech= 180 - 600 mg/L Vitamin B 12 (ng/L) >300 <200 >300 MEDEA: Kys. Listová (mg/L) >4 >4 <2 Deficit nepravděpodobný Deficit vitaminu B 12 Deficit kyseliny listové

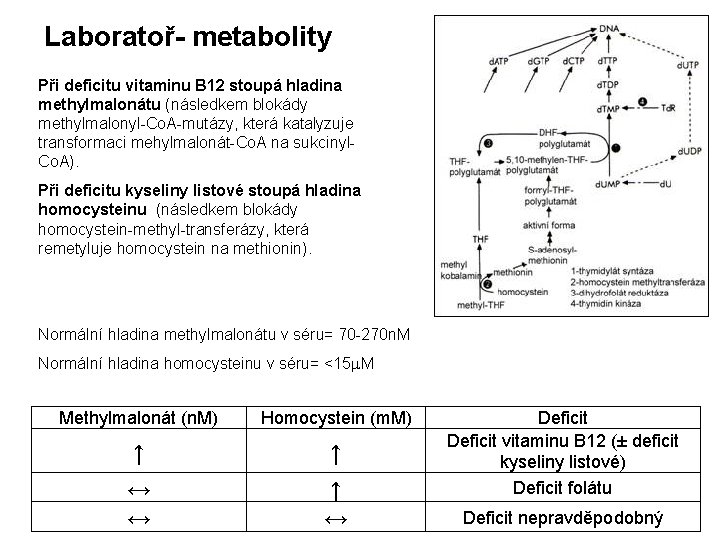
Laboratoř- metabolity Při deficitu vitaminu B 12 stoupá hladina methylmalonátu (následkem blokády methylmalonyl-Co. A-mutázy, která katalyzuje transformaci mehylmalonát-Co. A na sukcinyl. Co. A). Při deficitu kyseliny listové stoupá hladina homocysteinu (následkem blokády homocystein-methyl-transferázy, která remetyluje homocystein na methionin). Normální hladina methylmalonátu v séru= 70 -270 n. M Normální hladina homocysteinu v séru= <15 m. M Methylmalonát (n. M) Homocystein (m. M) ↑ ↑ ↔ ↔ ↑ ↔ Deficit vitaminu B 12 (± deficit kyseliny listové) Deficit folátu Deficit nepravděpodobný

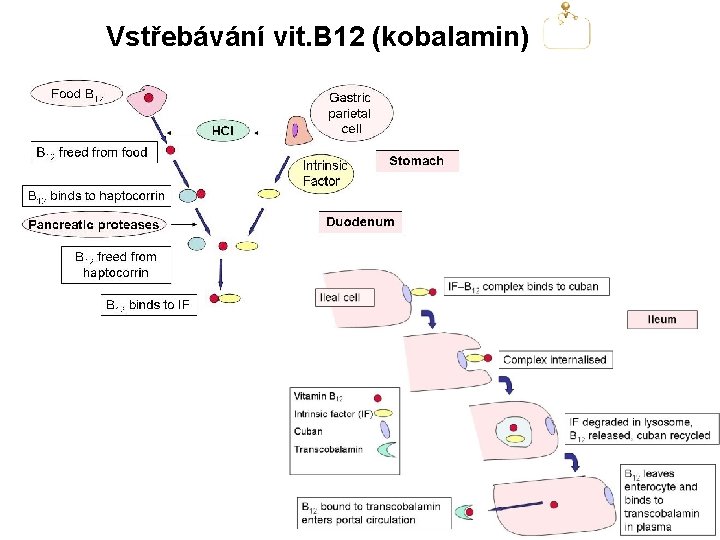
Příčiny vzniku megaloblastových anémií Kobalamin 1. Deficit v potravě (vegetariáni) 2. Porucha vstřebávání- kobalamin má nejsložitější vstřebávací systém ze všech známých látek a. Deficit či mutace transportních proteinů (haptocorin, vnitřní faktor, transcobalamin II) b. Malabsorpce (coeliakie, amyloidóza) c. Resekce žaludku či terminálního ilea, ileitis, m. Crohn, lymfomová infiltrace d. Syndrom stázy (syndrom slepé kličky, divertikulóza, sklerodermie) e. Škulovec široký (Diphylobotrium latum) 3. Perniciózní anémie 4. Léky (metformin, cholestryramin, neomycin) Folát 1. Deficit v potravě (rozvojové země, alkoholici, těhotné a kojící ženy) 2. Zvýšená potřeba (těhotenství, laktace, zvýšená erytropoéza, psoriasis) 3. Porucha vstřebávání- vzácně a. Malabsorpce (coeliakie) b. Resekce duodena 4. Antimetabolity kyseliny listové (methotrexát, pemetrexed) 5. Další léky: pyrimethamin, trimethoprim (oba léky inhibují bakteriální dihydrofolátreduktázu), sulfasalazin, alkohol

Perniciózní (zhoubná) anémie Perniciózní anémie je relativně časté onemocnění (incidence= 25/100. 000). Autoimunitní (protilátkami-zprostředkovaná) destrukce parietálních buněk žaludeční sliznice vede k atrofické gastritidě, k deficitu produkce vnitřního faktoru a kyseliny chlorovodíkové a tím i vstřebávání kobalaminu z potravy. Až u 90% pacientů lze prokázat autoprotilátku proti vnitřnímu faktoru, která brání vazbě kobalaminu na vnitřní faktor. U některých pacientů lze detekovat autoprotilátku, která brání vazbě komplexu „vnitřní faktor-kobalamin“ na receptory v terminálním ileu.

Diferenciální diagnóza deficitu vit. B 12 a folátu Těžký deficit folátu je v našich zeměpisných šířkách na rozdíl od deficitu vit. B 12 poměrně vzácný. Lze se s ním setkat ve větší míře pouze u alkoholiků či pacientů s malabsorpcí. Pro deficit kobalaminu je typická neurologická symptomatologie, která se u izolovaného deficitu folátu nevyskytuje. Její patofyziologie není zcela jasná. Mezi charakteristické nálezy patří demyelinizace zadních míšních provazců hrudních segmentů míchy (pozitivní Rombergův příznak), axonální degenerace, parestezie až neuropatická bolest, zvýšený svalový tonus až progresivní spasticita, zvýrazněné hlubkové svalové reflexy, ztrátu schopnosti vnímat vysoké tóny ladičky (256 Hz), výjimečně až psychotické stavy.

Terapie Substituce: -kyselina listová -vitamin B 12 Retikulocytární krize: nastartování krvetvorby se projeví 3 -5 dní po zahájení substituce extrémní retikulocytózou v periferní krvi (10 -30%) Pakliže není odpověd do 10 dní, je nutné vyšetřit kostní dřeň k vyloučení jiné příčiny pancytopenie (zejména akutní myeloidní leukémie).

2. A. DALŠÍ MAKROCYTÁRNÍ ANÉMIE

Makrocytární anémie- diferenciální diagnóza 1. Jaterní choroby spojené s cholestázou 2. Hypotyreóza 3. Hemolytické anémie s retikulocytózou 4. MDS 5. AML 6. Alkoholismus 7. Léky interferující se syntézou DNA (cytostatika) nebo se vstřebáváním a metabolismem vit. B 12 či kyseliny listové (viz. předešlé snímky)

ANÉMIE II. - PREZENTACE V BODECH 1. Mikrocytární anémie A. Metabolismus železa B. Přetížení železem: hereditární hemochromatóza a sekundární hemosideróza C. Sideropenická anémie a chronická ztráta krve D. Anémie chronických onemocnění E. Další mikrocytární anémie 2. Megaloblastové a další makrocytární anémie A. Megaloblastové anémie B. Další makrocytární anémie 3. Autoimmunní hemolytické anémie (AIHA): získané, Coombs-pozitivní 4. Mikroangiopatické hemolytické anémie (MAHA): získané, Coombs-negativní

3. AUTOIMUNNÍ HEMOLYTICKÉ ANÉMIE (AIHA): ZÍSKANÉ, COOMBSPOZITIVNÍ (WAIHA, CAD, PCH)

Imunní hemolytické anémie jsou charakterizované protilátkami-mediovanou destrukcí erytrocytů intravaskulárně a/nebo extravaskulárně (ve slezině, játrech, event. i v kostní dřeni). Imunní hemolytické anémie lze dělit na: 1. Autoimunní 2. Aloimunní hemolýza je vyvolána aloprotilátkou (=protilátka proti cizímu antigenu), je spojena s pozitivitou nepřímého Coombsova testu (podle okolností i pozitivitou přímého Coombsova testu) a je doménou transfuzologie (inkompatibilní krevní transfuze) a gynekologie / porodnictví (hemolytické onemocnění novorozence)- viz. samostatná přednáška. Autoimunní hemolýza je vyvolána autoprotilátkou (=protilátka proti vlastnímu antigenu), je spojena s pozitivitou přímého Coombsova testu (podle charakteru autoprotilátky i pozitivitou nepřímého Coombsova testu) a bude probrána v následujících snímcích.

Přímý a nepřímý Coombsův test Přímý Coombsův test detekuje přítomnost autoprotilátky nebo C 3 složky komplementu na membráně vlastních erytrocytů. V přítomnosti laboratorních a/nebo klinických známek hemolýzy je pozitivní přímý Coombsův test korelátem autoimunně zprostředkované hemolýzy. Nepřímý Coombsův test detekuje přítomnost aloprotilátky na membráně cizích erytrocytů (dárce). V přítomnosti laboratorních a/nebo klinických známek hemolýzy je pozitivní nepřímý Coombsův test korelátem aloimunně zprostředkované hemolýzy.

Autoimunní hemolytické anémie (AIHA) Autoimunitní hemolytické anémie se dělí do třech hlavních skupin: 1. WAIHA (Warm AIHA)= AIHA s tepelnými protilátkami (obvykle třídy Ig. G)= cca 85% pacientů 2. CAD (Cold agglutinin disease)= AIHA s chladovými protilátkami (třídy Ig. M)= cca 15% pacientů 3. PCH (Paroxysmal cold hemoglobinuria)= paroxysmální chladová hemoglobinurie (vyvolaná bifázickou Ig. G, tzv. Donath-Landsteinerovou protilátkou, která se v chladu váže na erytrocyty a v teple vyvolává hemolýzu)= vzácné onemocnění PROTILÁTKA (ISOTYP) PŘÍMÝ COOMBSŮV TEST SPECIFICITA AUTOPROTILÁTKY HEMOLÝZA TYP AUTOIMUNITNÍ HEMOLYTICKÉ ANÉMIE WAIHA CAD Ig. G, vzácněji Ig. A, Ig. M či Ig. M smíšené PCH Ig. G* Ig. G a/nebo C 3 C 3 Variabilní, primárně antigeny Rh systému i/I antigeny P antigen Primárně extravaskulární, vzácně intravaskulární Primárně extravaskulární Primárně intravaskulární Virová onemocnění, mykoplasma, nádorová onemocnění Terciální stádium syfylis, infekce parvovirem B 19 B-lymfoproliferace (CLL, ASOCIACE S NEMOCEMI lymfomy), systémové choroby pojiva *Bifázická Ig. G, tzv. Donath-Landsteinerová protilátka

Autoimunní hemolytické anémie (AIHA) AIHA je akutní onemocnění, nezřídka s fulminantním průběhem ohrožujícím pacienta na životě. Akutní hemolýza vede k těžké tkáňové hypoxii, selhání ledvin a cirkulačnímu selhání, čímž se podobá akutní ztrátě krve např. při poranění. DIAGNÓZA= KLINICKÉ A LABORATORNÍ ZNÁMKY HEMOLÝZY (zvýšený bilirubin (ikterus), zvýšené LDH, urobilinogen v moči) + POZITIVNÍ PŘÍMÝ COOMBSŮV TEST V krevním obraze nacházíme obraz hemolytické anémie s retikulocytózou (makrocytóza s polychromatofilií) a četnými (mikro)sférocyty.

AIHA- rozdílné choroby= rozdílné patofyziologie AIHA vzniká následkem produkce autoprotilátky namířené proti membránovým antigenům vlastních erytrocytů. Autoprotilátky produkují patologické lymfocytární klony proliferující často ve slezině. Autoprotilátky se vážou na erytrocyty buď v chladu (chladové autoprotilátky- nejčastěji Ig. M) nebo při 37 st. C (tepelné autoprotilátky- nejčastěji Ig. G).

AIHA- obecné patofyziologické mechanismy Autoprotilátka se váže na membránu erytrocytů a způsobuje: 1. Intravaskulární hemolýzu (zejména Ig. M autoprotilátky- mají totiž oproti Ig. G mnohem větší schopnost aktivovat komplement a způsobovat tak přímou lýzu erytrocytu přímo v cirkulaci) 2. Extravaskulární hemolýzu (většina Ig. G autoprotilátek- vazbou na Fc receptory slezinných a jaterních makrofágů) 3. Extravaskulární remodelaci erytrocytů (dochází k vazbě na Fc receptory slezinných a jaterních makrofágů vykousávání částí erytrocytární membrány snížení povrchu erytrocytu vznikají mikrosférocyty).

AIHA- patofyziologie Patofyziologie vyplývá z izotypu autoprotilátky (Ig. G vs Ig. M) a z její reakce (tepelná vs chladová) 1. Tepelné autoprotilátky Ig. G způsobují extravaskulární hemolýzu (vazba Ig. G nevede k masivní aktivaci komplementové kaskády, ale vazba erytrocytů s navázanými Ig. G autoprotilátkami na Fc receptory slezinných a jaterních makrofágů vede k jejich extravaskulární destrukci a remodelaci). 2. Tepelné autoprotilátky Ig. M způsobují fulminantní intravaskulární hemolýzu (vazba Ig. M způsobí masivní aktivaci komplementové kaskády a lýzu erytrocytů v cirkulaci). 3. Chladové autoprotilátky Ig. M způsobují extravaskulární hemolýzu. Po expozici chladu (např. na akrálních částech těla v zimě) dochází k vazbě autoprotilátky Ig. M na erytrocyt, což vede k aktivaci komplementové kaskády. V teplejších částech těla dojde k disociaci Ig. M protilátky od erytrocytu, aktivace komplementové kaskády se přeruší, ale některé meziprodukty aktivace komplementu zůstávají přichycené na erytrocytu. Vazbou erytrocytu s navázaným komplementem na komplementové receptory slezinných a jaterních makrofágů dochází k extravaskulární destrukci erytrocytů.

Autoimunní hemolytické anémie (AIHA) Autoimunní hemolytická anémie je často prvním projevem lymfoproliferativních onemocnění (lymfomy, chronická lymfatická leukémie) či imunodeficitů = sekundární AIHA. Všechny pacienty s AIHA je proto nutné řádně dovyšetřit (minimálně rtg plic + ultrazvuk břicha: k vyloučení event. lymfadenomegalie).

Principy terapie AIHA 1. Imunosupresivní terapie (kortikoidy, anti-CD 20 monoklonální protilátka rituximab, cytostatika aj. ) 2. Splenektomie (odstranění hlavního místa destrukce erytrocytů + odstranění zdroje produkce patologického B-lymfocytárního klonu) 3. Substituce: v případě fulminantně probíhající AIHA je transfuze nezbytná k záchraně života pacienta a nesmí se s ní váhat, byť transfundovaná krev může být více či méně hemolyzována pacientovými autoprotilátkami. Musíme si uvědomit, že ani pacientova vlastní krev není kompatibilní (neboť autoprotilátkyjsou namířeny proti vlastním erytrocytům).

ANÉMIE II. - PREZENTACE V BODECH 1. Mikrocytární anémie A. Metabolismus železa B. Přetížení železem: hereditární hemochromatóza a sekundární hemosideróza C. Sideropenická anémie a chronická ztráta krve D. Anémie chronických onemocnění E. Další mikrocytární anémie 2. Megaloblastové a další makrocytární anémie A. Megaloblastové anémie B. Další makrocytární anémie 3. Autoimmunní hemolytické anémie (AIHA): získané, Coombs-pozitivní 4. Mikroangiopatické hemolytické anémie (MAHA): získané, Coombs-negativní

4. MIKROANGIOPATICKÉ HEMOLYTICKÉ ANÉMIE (MAHA): ZÍSKANÉ, COOMBS-NEGATIVNÍ

MAHA Mikroangiopatické hemolytické anémie jsou charakterizovány intravaskulární destrukcí erytrocytů, přičemž příčina destrukce není imunitního původu. Coombsovy testy jsou negativní. Pro mikroangiopatické hemolytické anémie je charakteristická přítomnost rozbitých erytrocytů = SCHISTOCYTŮ.

Příčiny MAHA 1. MAHA se schistocyty je charakteristickým rysem trombotické trombocytopenické purpury (TTP). 2. MAHA se schistocyty typicky provází trombotickou fázi diseminované intravaskulární koagulace (DIC), kdy se erytrocyty rozbíjejí o fibrinové sraženiny vznikající v mikrocirkulaci. 3. Existuje řada dalších příčin vedoucích k neimunitní destrukci erytrocytů, včetně: -parazitémie (malárie) -fyzikálních příčin (hypertermie, destrukce na umělých chlopních) -chemických příčin (hypofosfatémie, některé jedy) -maligní hypertenze -vaskulitidy a další

TTP je onemocnění charakterizované sníženou aktivitou depolymerázy von Willebrandova faktoru. TTP lze rozdělit na: 1. Vrozenou TTP (mutace genu pro depolymerázu) 2. Získaná TTP (autoprotilátka proti depolymeráze)

TTP- patofyziologie Vozená mutace genu kódujícího depolymerázu von Willebrandova faktoru (v. Wf) nebo získaná autoprotilátka proti depolymeráze Snížené štěpení multimerů v. Wf produkovaných endoteliemi Zvýšená adheze trombocytů na nenaštěpené multimery v. Wf Trombocytopenie Trombotizace mikrocirkulace s aktivací sekundární hemostázy a vytvoření fibrinových sítí Hypoperfuze orgánů Rozbíjení erytrocytů o fibrinové nálety Elevace LDH Tkáňová hypoxie Orgánové příznaky (neurologické symptomy, renální selhání)

TTP- průběh TTP typicky postihuje mladé ženy ve věku 30 -40 let. Neléčená TTP končí až v 90% případech úmrtím !!! Léčená TTP končí naopak v naprosté většině případů vyléčením. JE NAPROSTO NEZBYTNÉ NA TOTO ONEMOCNĚNÍ MYSLET V RÁMCI DIFERENCIÁLNÍ DIAGNÓZY TROMBOCYTOPENIÍ A MIKROANGIOPATICKÝCH ANÉMIÍ S PŘÍTOMNOSTÍ SCHISTOCYTŮ.

TTP- příznaky TTP se projevuje: 1. Trombocytopenií 2. Přítomností SCHISTOCYTŮ na nátěru periferní krve 3. Mikroangiopatickou hemolýzou (MAHA) zvýšená hladina LDH 4. Horečkami 5. Příznaky ze snížené perfuze orgánů (=hypoxie) na podkladě trombotizace mikrocirkulace 1. = neurologické příznaky (zmatenost až komatózní stav) 2. = renální selhání 3. = zvýšená hladina LDH

TTP- principy terapie Metodou volby u TTP je plasmaferéza. Plasmaferéza vede k: 1. Odstranění autoprotilátky proti depolymeráze v. Wf z plazmy pacienta 2. Odstranění nenaštěpených multimerů v. Wf z plazmy pacienta Podpůrná terapie= 1. Imunosuprese (kortikoidy) Blokáda tvorby patologického klonu produkujícího autoprotilátku 2. Splenektomie (odstranění místa předpokládané tvorby patologického lymfocytárního klonu)

KONEC PREZENTACE