HEMATOLOGIE ANMIE III POLYCYTMIE STAV PATOLOGICK FYZIOLOGIE 1






















































































- Slides: 105

HEMATOLOGIE ANÉMIE III. , POLYCYTÉMIE ÚSTAV PATOLOGICKÉ FYZIOLOGIE 1. LF UK V PRAZE http: //patf. lf 1. cuni. cz OTÁZKY A PŘIPOMÍNKY K VÝUCE HEMATOLOGIE: MUDr. PAVEL KLENER, Ph. D. , pavel. klener@lf 1. cuni. cz

ANÉMIE III. - PREZENTACE V BODECH 1. Chronické hemolytické anémie: vrozené, Coombs-negativní A. Vrozené poruchy erytrocytární membrány (sférocytóza, eliptocytóza atd. ) B. Enzymopatie (deficit G 6 PD, deficit PK aj. ) C. Thalassémie (thalassémie alfa, beta) D. Další hemoglobinopatie (nestabilní Hb, zvýšená afinita k O 2, methemoglobinémie aj. ) 2. Anémie spojené s útlumem erytropoézy a dyserytropoetické anémie (DBA, PRCA, nádorová infiltrace, CDA aj. ) 3. Polycytémie

1. CHRONICKÉ HEMOLYTICKÉ ANÉMIE: VROZENÉ, COOMBSNEGATIVNÍ

1. A. VROZENÉ PORUCHY ERYTROCYTÁRNÍ MEMBRÁNY

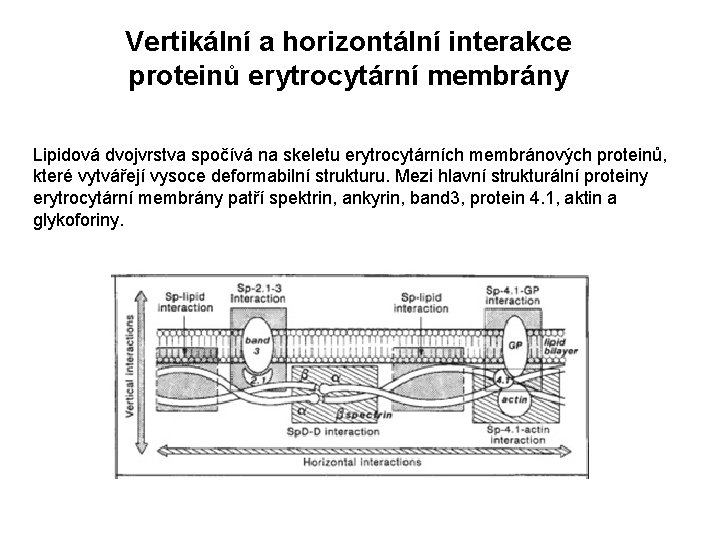
Vertikální a horizontální interakce proteinů erytrocytární membrány Lipidová dvojvrstva spočívá na skeletu erytrocytárních membránových proteinů, které vytvářejí vysoce deformabilní strukturu. Mezi hlavní strukturální proteiny erytrocytární membrány patří spektrin, ankyrin, band 3, protein 4. 1, aktin a glykoforiny.

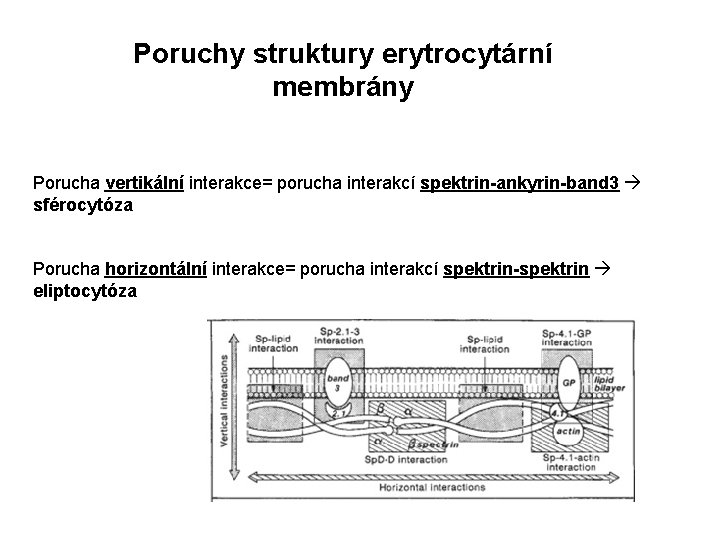
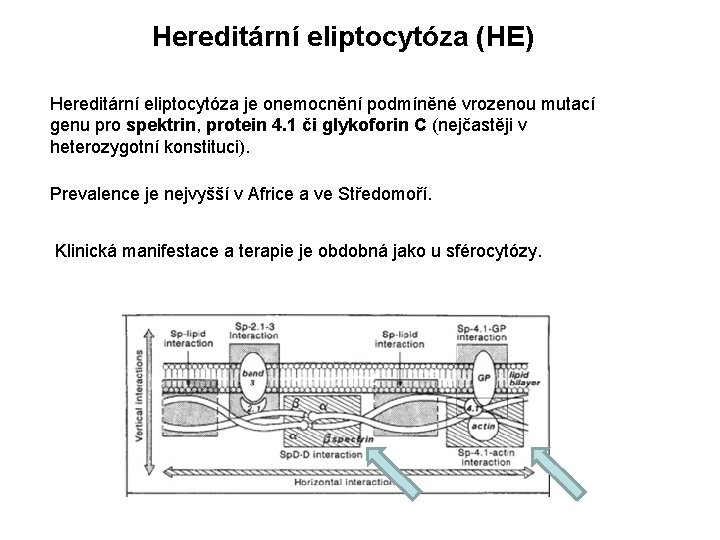
Poruchy struktury erytrocytární membrány Porucha vertikální interakce= porucha interakcí spektrin-ankyrin-band 3 sférocytóza Porucha horizontální interakce= porucha interakcí spektrin-spektrin eliptocytóza

Hereditární sférocytóza (HS) HS je jedna z nejčastějších vrozených hemolytických anémií v Evropě. Prevalence HS= 1 / 2. 000 osob. HS je onemocnění podmíněné vrozenou mutací genu pro spektrin, ankyrin či band 3 (nejčastěji v heterozygotní konstituci).

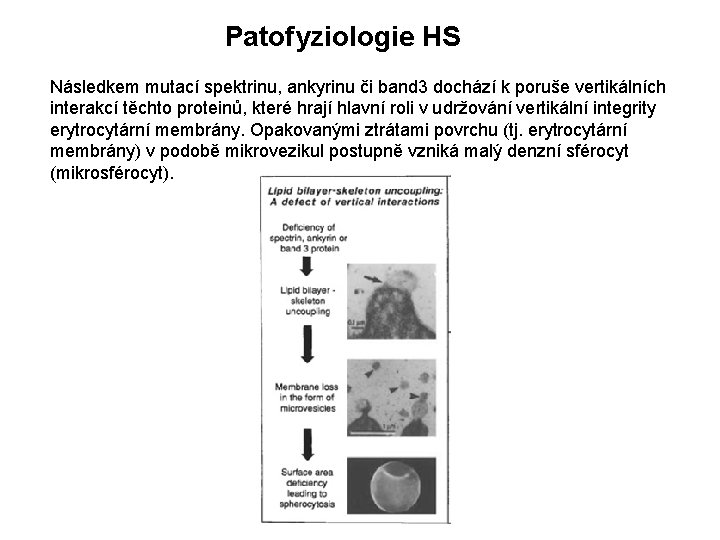
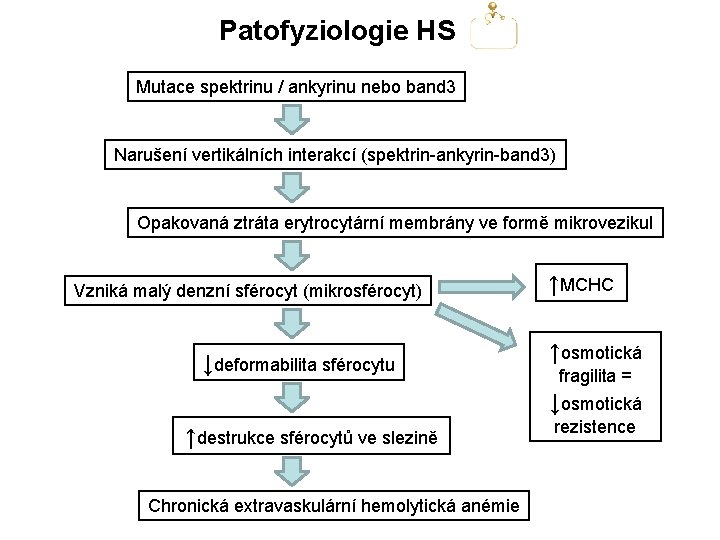
Patofyziologie HS Následkem mutací spektrinu, ankyrinu či band 3 dochází k poruše vertikálních interakcí těchto proteinů, které hrají hlavní roli v udržování vertikální integrity erytrocytární membrány. Opakovanými ztrátami povrchu (tj. erytrocytární membrány) v podobě mikrovezikul postupně vzniká malý denzní sférocyt (mikrosférocyt).

Patofyziologie HS Mutace spektrinu / ankyrinu nebo band 3 Narušení vertikálních interakcí (spektrin-ankyrin-band 3) Opakovaná ztráta erytrocytární membrány ve formě mikrovezikul Vzniká malý denzní sférocyt (mikrosférocyt) ↓deformabilita sférocytu ↑MCHC ↑osmotická fragilita = ↓osmotická ↑destrukce sférocytů ve slezině Chronická extravaskulární hemolytická anémie rezistence

Patofyziologie HS V patofyziologii HS hrají hlavní roli 2 faktory: 1. Defekt proteinů udržujících integritu erytrocytární membrány 2. Funkční slezina Funkčí slezina hraje v patofyziologii HS dominantní roli, neboť likviduje rigidní mikrosférocyty. Proto splenektomie u většiny pacientů s lehčí formou nemoci vede k vymizení či výraznému zmírnění známek chronické hemolýzy. Prostup erytrocytů skrze fenestrace slezinných sinusů.

Patofyziologie HS Další roli v patofyziologii HS hraje patrně zvýšený únik draslíku extracelulárně, čímž dochází k dehydrataci sférocytu. Dehydratace nadále snižuje deformabilitu mikrosférocytu.

Patofyziologie HS Průměrná doba, kterou stráví normální diskocyt ve slezině je cca 30 -40 sekund. Sférocyt stráví ve slezině 10 -100 minut a pokud není ve slezině zlikvidován, může být dále narušena jeho deformabilita (= splenic conditioning). Splenic conditioning se projeví v testu osmotické fragility jako tzv. ocas hemolýzy (= tailed curve). Ocas hemolýzy mizí po splenektomii. Test osmotické fragility erytrocytů

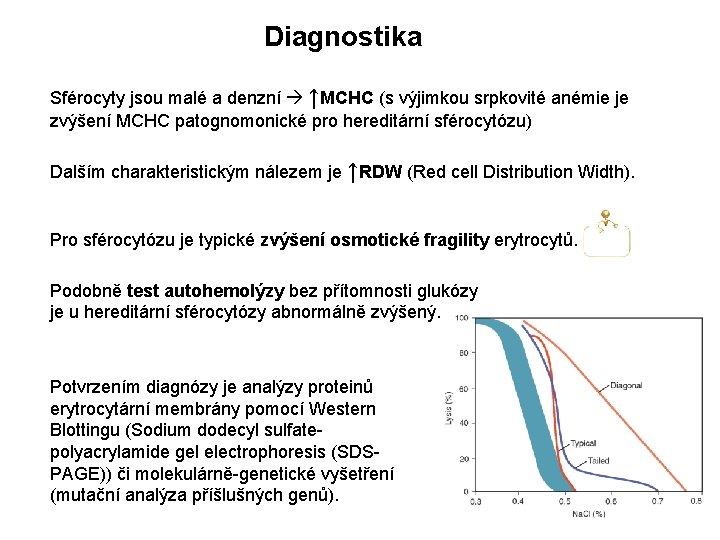
Diagnostika Sférocyty jsou malé a denzní ↑MCHC (s výjimkou srpkovité anémie je zvýšení MCHC patognomonické pro hereditární sférocytózu) Dalším charakteristickým nálezem je ↑RDW (Red cell Distribution Width). Pro sférocytózu je typické zvýšení osmotické fragility erytrocytů. Podobně test autohemolýzy bez přítomnosti glukózy je u hereditární sférocytózy abnormálně zvýšený. Potvrzením diagnózy je analýzy proteinů erytrocytární membrány pomocí Western Blottingu (Sodium dodecyl sulfatepolyacrylamide gel electrophoresis (SDSPAGE)) či molekulárně-genetické vyšetření (mutační analýza příšlušných genů).

Klinický obraz Typický pacient s HS (=heterozygot) je relativně asymptomatický. Dominuje mírná anémie, ikterus a splenomegalie. V KO normální či mírně zvýšené retikulocyty.

Komplikace Jsou totožné s komplikacemi jiných chronických hemolytických anémií. 1. Bilirubinové žlučníkové kameny (až u 50% pacientů) 2. Hemolytická krize (relativně vzácně, zejm. v souvislosti s infekcemi- zhoršení anémie v průběhu infekce) 3. Megaloblastová krize 4. Aplastická krize 5. Infekční komplikace po splenektomii 6. Dna 7. Ulcerace dolních končetin z poruch mikrocirkulace

Terapie Metodou volby je splenektomie = odstranění hlavního místa destrukce mikrosférocytů.

Patofyziologické konsekvence Sférocytóza se přechodně zlepšuje (včetně vymizení známek chronické hemolýzy a laboratorní úpravy testů osmotické fragility) u pacientů se současnou obstrukcí vývodných žlučových cest (s obstrukčním ikterem). PROČ? ? ? U obstrukčního ikteru dochází totiž ke zvýšení hladiny fosfolipidů a cholesterolu v důsledku změny spektra plazmatických apolipoproteinů. Zvýšená integrace fosfolipidů a cholesterolu do erytrocytární membrány vede u pacientů bez sférocytózy k absolutnímu zvýšení plochy erytrocytární membrány, čímž vznikají terčovité erytrocyty (target cells). U pacientů se sférocytózou dochází také ke zvýšení plochy erytrocytární membrány, čímž z mikrosférocytů vznikají (morfologicky téměř normální) diskocyty.

Hereditární eliptocytóza (HE) Hereditární eliptocytóza je onemocnění podmíněné vrozenou mutací genu pro spektrin, protein 4. 1 či glykoforin C (nejčastěji v heterozygotní konstituci). Prevalence je nejvyšší v Africe a ve Středomoří. Klinická manifestace a terapie je obdobná jako u sférocytózy.

Získané poruchy struktury erytrocytární membrány

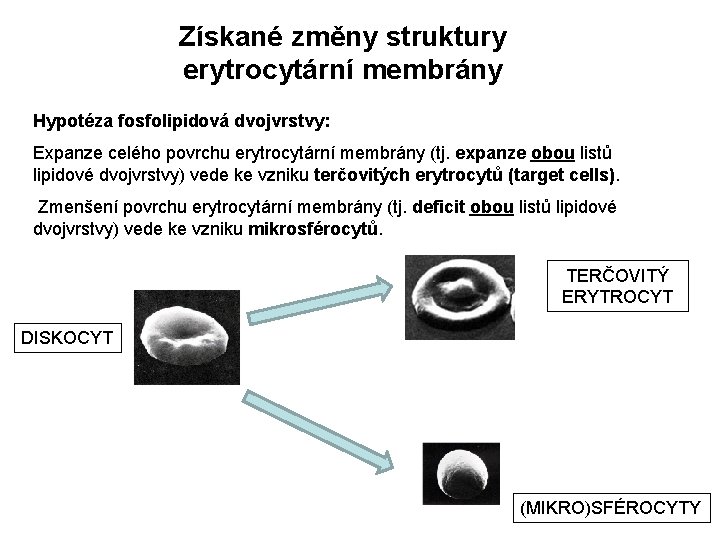
Získané změny struktury erytrocytární membrány Hypotéza fosfolipidová dvojvrstvy: Expanze celého povrchu erytrocytární membrány (tj. expanze obou listů lipidové dvojvrstvy) vede ke vzniku terčovitých erytrocytů (target cells). Zmenšení povrchu erytrocytární membrány (tj. deficit obou listů lipidové dvojvrstvy) vede ke vzniku mikrosférocytů. TERČOVITÝ ERYTROCYT DISKOCYT (MIKRO)SFÉROCYTY

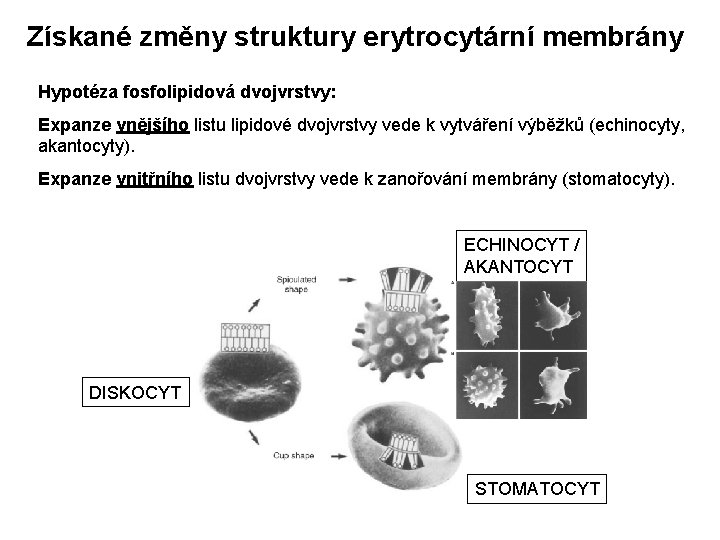
Získané změny struktury erytrocytární membrány Hypotéza fosfolipidová dvojvrstvy: Expanze vnějšího listu lipidové dvojvrstvy vede k vytváření výběžků (echinocyty, akantocyty). Expanze vnitřního listu dvojvrstvy vede k zanořování membrány (stomatocyty). ECHINOCYT / AKANTOCYT DISKOCYT STOMATOCYT

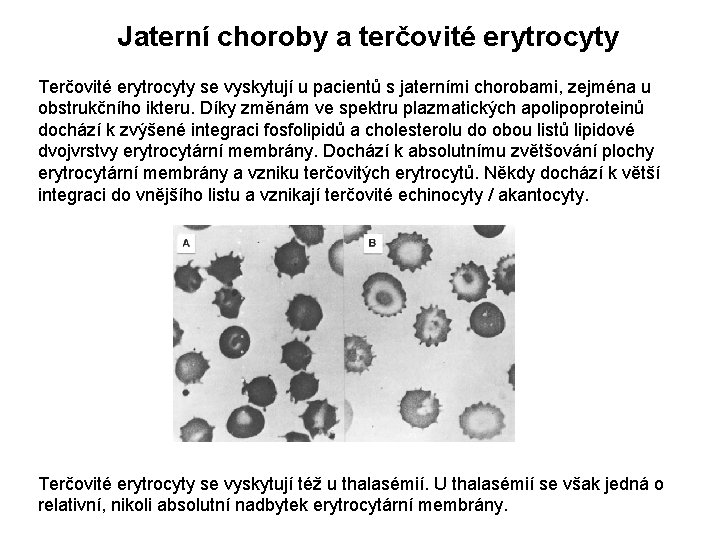
Jaterní choroby a terčovité erytrocyty Terčovité erytrocyty se vyskytují u pacientů s jaterními chorobami, zejména u obstrukčního ikteru. Díky změnám ve spektru plazmatických apolipoproteinů dochází k zvýšené integraci fosfolipidů a cholesterolu do obou listů lipidové dvojvrstvy erytrocytární membrány. Dochází k absolutnímu zvětšování plochy erytrocytární membrány a vzniku terčovitých erytrocytů. Někdy dochází k větší integraci do vnějšího listu a vznikají terčovité echinocyty / akantocyty. Terčovité erytrocyty se vyskytují též u thalasémií. U thalasémií se však jedná o relativní, nikoli absolutní nadbytek erytrocytární membrány.

ANÉMIE III. - PREZENTACE V BODECH 1. Chronické hemolytické anémie: vrozené, Coombs-negativní A. Vrozené poruchy erytrocytární membrány (sférocytóza, eliptocytóza atd. ) B. Enzymopatie (deficit G 6 PD, deficit PK aj. ) C. Thalassémie (thalassémie alfa, beta) D. Další hemoglobinopatie (nestabilní Hb, zvýšená afinita k O 2, methemoglobinémie aj. ) 2. Anémie spojené s útlumem erytropoézy a dyserytropoetické anémie (DBA, PRCA, nádorová infiltrace, CDA aj. ) 3. Polycytémie

1. B. ENZYMOPATIE

Enzymatické vybavení erytrocytu 1. Glykolýza ATP NADH 2. Pentózový zkrat NADPH 3. Rapaport-Lueberingův zkrat 2, 3 -BPG 1. ATP stabilita erytrocytu 2. NADH redukce met-Hb na Hb 3. NADPH redukce glutathionu (GS-SG 2 x GSH) stabilita erytrocytu 4. 2, 3 -BPG posun disociační křivky Hb doleva

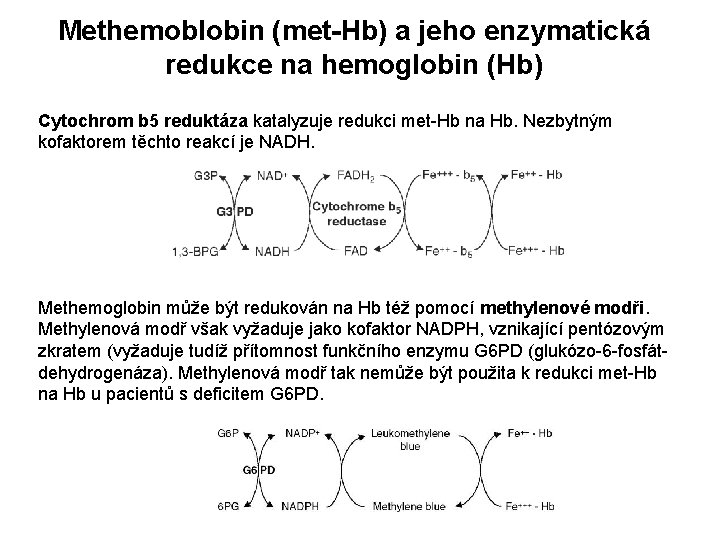
Methemoblobin (met-Hb) a jeho enzymatická redukce na hemoglobin (Hb) Cytochrom b 5 reduktáza katalyzuje redukci met-Hb na Hb. Nezbytným kofaktorem těchto reakcí je NADH. Methemoglobin může být redukován na Hb též pomocí methylenové modři. Methylenová modř však vyžaduje jako kofaktor NADPH, vznikající pentózovým zkratem (vyžaduje tudíž přítomnost funkčního enzymu G 6 PD (glukózo-6 -fosfátdehydrogenáza). Methylenová modř tak nemůže být použita k redukci met-Hb na Hb u pacientů s deficitem G 6 PD.

Obecné charakteristiky erytrocytárních enzymopatií 1. Obraz chronické hemolytické anémie bez specifických morfologických odchylek erytrocytů (deficit PK) 2. Akutní hemolytické krize po expozici oxidativním látkám a přítomnost inkluzí v erytrocytech (Heinzova tělíska) na nátěru periferní krve (deficit G 6 PD) 3. Bazofilní tečkování (deficit pyrimidin-5′ nucleotidázy)

Erytrocytární enzymopatie: rozdělení 1. Enzymopatie interferující s produkcí NADPH (deficit G 6 PD) 2. Enzymopatie interferující s produkcí ATP (deficit PK) 3. Další enzymopatie (deficit pyrimidin-5′ nucleotidázy)

Vrozený deficit glukózo-6 -fosfátdehydrogenázy (G 6 PD)= enzymopatie interferující s produkcí NADPH Erytrocyty obsahují vysokou koncentraci glutathion (cca 2 m. M). Glutathion reparuje buněčné struktury erytrocytu poškozené oxidativním stresem. Při tom sám přechází z redukovaného do oxidovaného stav. K opětovné redukci glutathionu je zapotřebí vysoká koncentrace NADPH. Ta je vytvářena pentózovým zkratem. Při něm není glukóza-6 fosfát přeměněna na fruktózu-6 -fosfát, ale na 6 -fosfo-glukonát enzymem G 6 PD (glukózo-6 fosfát-dehydrogenázou). Deficit G 6 PD je spojen s nízkou produkcí NADPH, sníženou kapacitou redukovat glutathion a zvýšenou náchylností k oxidativnímu stresu.

Klinický obraz deficitu G 6 PD Vrozený deficit G 6 PD je charakterizovaný intermitentními akutními hemolytickými krizemi po požití oxidativních látek (léky, boby). Akutní hemolytická krize obvykle odezní i v případě, že trvá expozice látkám indukujícím oxidativní stres. Je to dáno tím, že během akutní hemolýzy dojde k destrukci starších erytrocytů, které mají nízkou aktivitu G 6 PD. Mladší erytrocyty mají vyšší aktivitu G 6 PD a jsou vůči oxidativnímu stresu obvykle dobře odolné. Erytrocyty pacientů s deficitem G 6 PD obvykle obsahují inkluze (Heinzova tělíska). Terapie není obvykle nutná. Stačí vyhýbat se expozici látkám vyvolávajícím oxidativní stres.

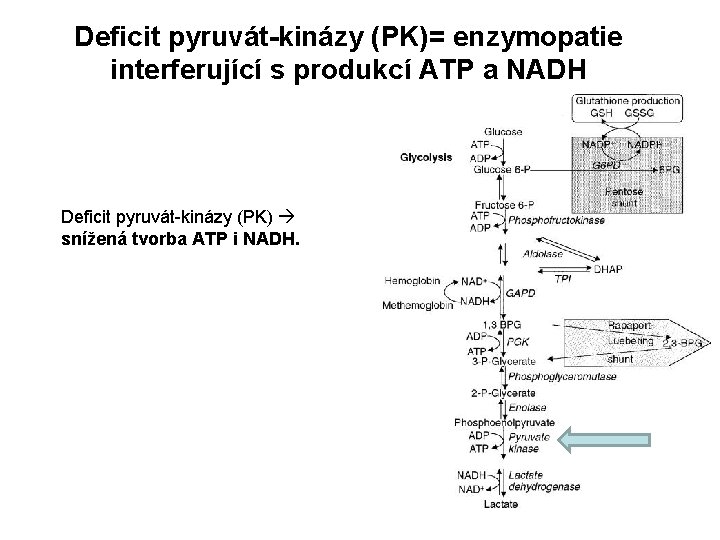
Deficit pyruvát-kinázy (PK)= enzymopatie interferující s produkcí ATP a NADH Deficit pyruvát-kinázy (PK) snížená tvorba ATP i NADH.

Deficit PK- patofyziologie Mechanismus hemolýzy u deficitu PK není objasněn. Nelze ho vysvětlit pouze sníženou hladinou ATP. Patrně dochází také ke sníženému přežívání erytroidních progenitorů v kostní dřeni.

Deficit PK- klinický obraz, diagnostika, terapie Erytrocyty pacientů s deficitem PK nemají žadnou specifickou morfologickou abnormalitu. Neexistuje žádný rutinně provádění screeningový test na deficit PK. Pro deficit PK platí: 1. Vysoká penetrance hemolytického fenotypu. 2. Velká variabilita klinických projevů (od mírné hemolýzy po hydrops fetalis). Klinický obraz odpovídá tíži hemolýzy. U pacientů s těžkou hemolytickou anémií lze zvážit provedení splenektomie.

ANÉMIE III. - PREZENTACE V BODECH 1. Chronické hemolytické anémie: vrozené, Coombs-negativní A. Vrozené poruchy erytrocytární membrány (sférocytóza, eliptocytóza atd. ) B. Enzymopatie (deficit G 6 PD, deficit PK aj. ) C. Thalassémie (thalassémie alfa, beta) D. Další hemoglobinopatie (nestabilní Hb, zvýšená afinita k O 2, methemoglobinémie aj. ) 2. Anémie spojené s útlumem erytropoézy a dyserytropoetické anémie (DBA, PRCA, nádorová infiltrace, CDA aj. ) 3. Polycytémie

1. C. THALASÉMIE

Thalasémie Vrozené poruchy krvetvorby způsobené mutacemi genů kódujících globinové řetězce hemboglobinu (Hb) snížená či chybějící produkce jednoho či více globinových řetězců. Globinový řetězec alfa= 2 geny na chromozomu 16= 4 alely Globinový řetězec beta= 1 gen na chromozomu 11= 2 alely Defekty produkce globinových řetězců gama, epsilon či zéta (= fetální hemoglobiny) jsou letální in utero. Absence či snížení produkce funkčních tetramerů hemoglobinu A (Hb. A= a 2 b 2) má za následek vytváření mirkocytárních hypochromních erytrocytů. Relativní nadbytek erytrocytární membrány následkem nízké koncentrace Hb dává vznik terčovitým erytrocytům (target cells).

Nerovná syntéza alfa a beta řetězců Následkem nerovné syntézy alfa a beta globinových řetězců u thalasémií vznikají špatně rozpustné, funkčně méněcenné, patologické Hb tetramery či nerozpustné precipitáty globinových řetězců. Nadbytečná syntéza nemutovaných globinových řetězců je do značné míry odpovědná za řadu symptomů u thalasémií (viz. dále patofyziologie). Mezi nejčastější patologické Hb tetramery patří: Hb. Bart= g 4 Hb. H= b 4 Tetramer a 4 je nerozpustný a vytváří zcela nefunkční precipitáty.

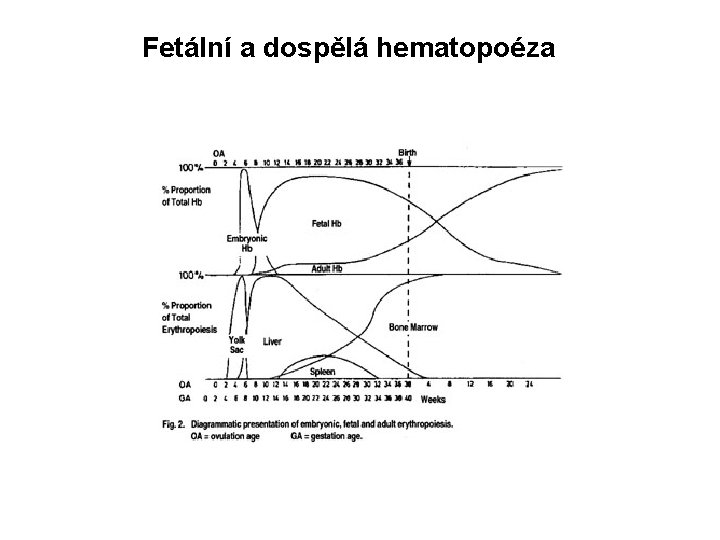
Fundamentální rozdíl v manifestaci alfa- a beta-thalasémie Vzhledem k tomu, že prenatálně dominuje produkce fetálního hemoglobinu- Hb. F (a 2 g 2), která je kompletně nahrazena dospělým typem hemoglobinu-Hb. A (a 2 b 2) během prvních dvou let života, dochází prenatálně a při narození ke klinické manifestaci thalasémie pouze u dětí s alfa-thalasémií. Beta-thalasémie se manifestují až cca od 4 -6 měsíce postnatálně, neboť v tomto období obvykle rostoucí produkce Hb. A převýší klesající produkci Hb. F (viz. obrázek na dalším snímku).

Fetální a dospělá hematopoéza

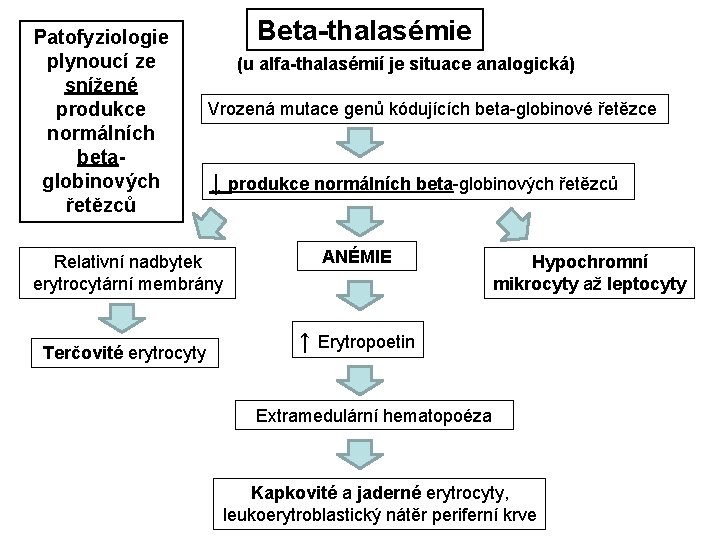
Patofyziologie plynoucí ze snížené produkce normálních betaglobinových řetězců Beta-thalasémie (u alfa-thalasémií je situace analogická) Vrozená mutace genů kódujících beta-globinové řetězce ↓ produkce normálních beta-globinových řetězců Relativní nadbytek erytrocytární membrány Terčovité erytrocyty ANÉMIE Hypochromní mikrocyty až leptocyty ↑ Erytropoetin Extramedulární hematopoéza Kapkovité a jaderné erytrocyty, leukoerytroblastický nátěr periferní krve

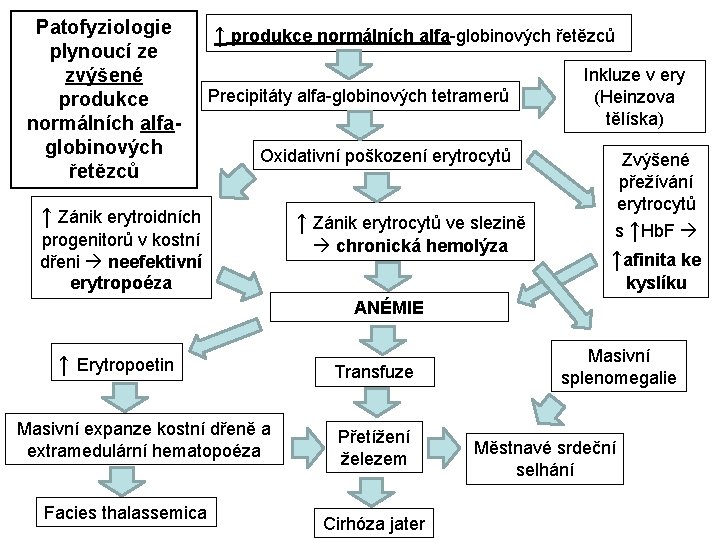
Patofyziologie plynoucí ze zvýšené produkce normálních alfaglobinových řetězců ↑ produkce normálních alfa-globinových řetězců Precipitáty alfa-globinových tetramerů Oxidativní poškození erytrocytů ↑ Zánik erytroidních progenitorů v kostní dřeni neefektivní erytropoéza ↑ Zánik erytrocytů ve slezině chronická hemolýza Inkluze v ery (Heinzova tělíska) Zvýšené přežívání erytrocytů s ↑Hb. F ↑afinita ke kyslíku ANÉMIE ↑ Erytropoetin Masivní expanze kostní dřeně a extramedulární hematopoéza Facies thalassemica Transfuze Přetížení železem Cirhóza jater Masivní splenomegalie Městnavé srdeční selhání

Klinické formy onemocnění alfa- a beta-thalasémií Vzhledem k odlišnému počtu genů kódujících alfa-globinové řetězce (2 geny= 4 alely) a beta-globinové řetězce (1 gen= 2 alely) existuje odlišný počet klinických forem onemocnění u alfa - a beta-thalasémie.

Alfa-thalasémie 4 stupně alfa-thalasémie (2 klinicky závažné formy- podtržené): a 0/a 0/a 0= Hb. Bart hydrops fetalis (syntéza alfa-globinových řetězců zcela chybí) a 0/a 0/a. WT= choroba hemoglobinu H (Hb. H disease, zachováno 20 -30% syntézy) a 0/a. WT/a. WT= rys alfa-thalasémie (alpha-thalassémia trait) a 0/a. WT/a. WT= tiché nosičství alfa-thalasémie (alpha-thalassemia silent carrier) a 0 = delece či mutace genu pro alfa-globinový řetězec a. WT= wild-type (nemutovaná) alela genu pro alfa-globinový řetězec

Beta-thalasémie 3 stupně beta-thalasémie (2 klinicky závažné formy): 1. b 0/b 0= beta-thalassemia major (syntéza beta-globinových řetězců zcela chybí) 2. b 0/b+ nebo b+/b+= beta-thalassemia intermedia (zachováno 530% syntézy) 3. b 0/b. WT nebo b+/b. WT= beta-thalassemia minor / rys betathalasémie (zachováno 90 -95% syntézy beta-globinových řetězců) b 0/b+ = delece či mutace genu pro beta-globinový řetězec b. WT= wild-type (nemutovaná) alela genu pro beta-globinový řetězec

Beta-thalassemia major Beta-thalasémie se začíná klinicky manifestovat od 4 -6 měsíce života, kdy dochází k pozvolnému rozvoji anémie, žloutenky a vzedmutí bříška dítěte při progredující hepatosplenomegalii. Nastává retardace růstu a deformování obličejových plochých kostí do podoby facies thalassemica. Neléčení pacienti umírají po 10 -20 letech živoření na městnavé srdeční selhání, přetížení železem a tromboembolické komplikace. Krevní obraz: Hb<70 g/L MCV= 50 -70 f. L MCH= 12 -20 pg ↑ Retikulocyty ↑ Hb. F ↑Hb. A 2 (=a 2 d 2) Laboratoř: ↑ LDH ↑ bilirubin ↓ haptoglobin Morfologie erytrocytů: je výrazně abnormální. Nacházíme extrémní poikilocytózu a hlubokou mikrocytózu s hypochromazií, leptocyty, četné terčovité, jaderné a kapkovité erytrocyty, inkluze a bazofilní tečkování aj.

Beta-thalassemia intermedia Odlišení beta-thalassemia major a intermedia je do značné míry závislé na klinickém průběhu onemocnění. Beta-thalassemia intermedia je onemocnění s intermediálním stupněm obtíží (oproti beta-thalasémii major, kde je stupeň klinických obtíží nejvýraznější). Krevní obraz: Hb>70 g/L MCV<70 f. L MCH<20 f. L ↑ Retikulocyty ↑ Hb. F ↑Hb. A 2 (=a 2 d 2) Laboratoř: ↑ LDH ↑ bilirubin ↓ haptoglobin Morfologie erytrocytů: je výrazně abnormální. Nacházíme poikilocytózu a výraznou mikrocytózu s hypochromazii, leptocyty, četné terčovité, jaderné a kapkovité erytrocyty, inkluze a bazofilní tečkování aj.

Beta-thalassemia minor / rys beta-thalasémie Beta-thalasémia minor (rys beta-thalasémie) je klinická němé onemocnění, které se projevuje prakticky pouze laboratorními odchylkami. Syntéza betaglobinových řetězců je totiž snížená jen lehce (o 5 -10% v porovnání se zdravou populací). Krevní obraz: Hb>70 g/L MCV<80 f. L MCH<27 pg ↔ Retikulocyty ↑ Hb. F ↑Hb. A 2 (=a 2 d 2) Laboratoř: ↔ LDH ↔ bilirubin ↔ haptoglobin Morfologie erytrocytů: je abnormální. Nacházíme poikilocytózu a mírnou mikrocytózu s hypochromazii, ojedinělými terčovitými erytrocyty, ojedinělé inkluze a bazofilní tečkování aj.

Beta-thalasémie: komplikace 1. Tromboembolické komplikace (všechny chronické hemolytické anémie patří mezi významné trombofilní stavy) 2. Přetížení železem (beta-thalasémie patří mezi tzv. iron-loading anémie) 3. Městnavé srdeční selhání (z hyperkinetické cirkulace při současné masivní hepatosplenomegalii) 4. Žlučníkové kameny (bilirubinové, z chronické hemolýzy) 5. Útlak orgánů při extramedulární hematopoéze (např. paraplegie) 6. Ulcerace dolních končetin (z okluze mikrocirkulace). 7. Facies thalassemica (z excesivní hematopoézy v obličejových kostech).

Beta-thalasémie: principy terapie 1. Náhrada krvetvorby (= alogenní transplantace kostní dřeně) 2. Substituční terapie (= transfuzní podpora zmírnění anémie útlum neefektivní erytropoézy zmírnění symptomů choroby) 3. Terapie přetížení železem (= chelatační terapie, např. desferioxamin) 4. Modifikace choroby (= hydroxyurea zvýšení exprese Hb. F, snížení extramedulární hematopoézy) 5. Symptomatická terapie (= splenektomie = odstranění hlavního místa zániku erytrocytů zvýšení hladiny Hb o 10 -30 g/L) 6. Kauzální terapie (= genová terapie, vnesení wild-type alely betaglobinového genu do hematopoetické kmenové buňky)- experimentální přístup

Alfa-thalasémie 4 stupně alfa-thalasémie (2 klinicky závažné formy): 1. a 0/a 0/a 0= Hb. Bart hydrops fetalis (syntéza alfa-globinových řetězců zcela chybí) 2. a 0/a 0/a. WT= choroba hemoglobinu H (Hb. H disease, zachováno 20 -30% syntézy) 3. a 0/a. WT/a. WT= rys alfa-thalasémie (alpha-thalassémia trait) 4. a 0/a. WT/a. WT= tiché nosičství alfa-thalasémie (alphathalassemia silent carrier)

Hb. Bart hydrops fetalis syndrom Hydrops fetalis je nejtěžší stupeň alfa-thalasémie vyvolaný chyběním všech genů pro alfa-globin a tudíž s nulovou produkcí alfa-globinových řetězců. Až 90% hemoglobinu je tvořeno Hb. Bart (g 4) tvořený nadbytečnými gamaglobinovými řetězci s vysokou afinitou ke kyslíku s disociační křivkou podobnou myoglobinu. Ještě intrauterinně dochází k rozvoji těžké hypoxie plodu s progredující hepatosplenomegalií na podkladě masivní extramedulární (fetální) hematopoézy stimulované erytropoetinem. K úmrtí plodu dochází obvykle intrauterinně, případně krátce po porodu. Krevní obraz: Celkový Hb=30 -80 g/L Laboratoř: MCV= 130 -140 f. L MCH= 22 -40 pg Retikulocytóza až 60% Hb. A= 0 Hb. A 2= 0 Hb. Bart (g 4)=90% Hb. F= 0 Hb. H= 0 ↑ LDH ↑ bilirubin ↓ haptoglobin

Choroba Hb. H je druhá klinická významná alfa-thalasémie. U Hb. H choroby je částečně zachovalá syntéza alfa-globinových řetězců (jeden funkční gen zajistí produkci na úrovni cca 20 -30% normy). Tíže anémie odpovídá zhruba beta-thalasémia intermedia, ale Hb. H choroba má poměrně variabilní klinický průběh (u části pacientů velmi mírný, u jiných se manifestuje jako hydrops fetalis). Na rozdíl od beta-thalasémie se manifestuje již intrauterinně, resp. hned po narození. Hb. H (b 4) je rozpustnější než precipitáty nadbytečných alfa-globinových řetězců u beta-thalasémií, proto je Hb. H spojena s menší mírou inefektivní hematopoézy. Krevní obraz: Celkový Hb=100 g/L Laboratoř: MCV= 55 -60 f. L MCH= 17 -19 pg Retikulocytóza 3 -6% Hb. A= 60 -90% Hb. A 2<2% Hb. Bart (g 4)= 2 -5% Hb. F<1% Hb. H (b 4)= 10 -40% ↑ LDH ↑ bilirubin ↓ haptoglobin

Rys alfa-thalasémie a tichý nosič alfathalasémie (=mutace 2 či 1 genu) = klinicky němá onemocnění, která se projevují prakticky pouze laboratorními odchylkami. Syntéza alfa-globinových řetězců je totiž snížená jen lehce. Krevní obraz: Celkový Hb je normální nebo na dolní hranici normy Laboratoř: LDH v normě Bilirubin v normě Haptoglobin v normě MCV= 70 -85 f. L MCH= 22 -28 pg Retikulocyty v normě Hb. A= 96 -98% Hb. A 2<3% Hb. Bart=0 Hb. F<1% Hb. H= 0

Alfa-thalasémie: komplikace a principy terapie Jsou prakticky totožné jako u beta-thalasémií.

Alfa-thalasémie: diferenciální diagnóza Klinicky významné formy alfa-thalasémií se v porovnání s betathalasémií major/intermedia manifestují ještě intrauterinně, resp. hned po narození. Klinické symptomy beta-thalasémií se manifestují od 4 -6 měsíce postnatálně. Klinicky nevýznamné formy alfa-thalasémií mají v porovnání s betathalasémií minor zvýšený Hb. A 2 (>3%) a obvykle mají zvýšený Hb. F.

ANÉMIE III. - PREZENTACE V BODECH 1. Chronické hemolytické anémie: vrozené, Coombs-negativní A. Vrozené poruchy erytrocytární membrány (sférocytóza, eliptocytóza atd. ) B. Enzymopatie (deficit G 6 PD, deficit PK aj. ) C. Thalassémie (thalassémie alfa, beta) D. Další hemoglobinopatie (nestabilní Hb, zvýšená afinita k O 2, methemoglobinémie aj. ) 2. Anémie spojené s útlumem erytropoézy a dyserytropoetické anémie (DBA, PRCA, nádorová infiltrace, CDA aj. ) 3. Polycytémie

1. D. DALŠÍ HEMOGLOBINOPATIE

Hemoglobinopatie jsou vrozená onemocnění způsobená mutací genů kódujících beta- a alfa-globinové řetězce Hb (75%= mutace betaglobinových genů). Rozdělení: 1. Nestabilní hemoglobiny (snížená rozpustnost, např. Hb. S= srpkovitá anémie) 2. Hb se zvýšenou afinitou ke kyslíku (např. Hb-Olomouc, carboxy. Hb, Hb. F) 3. Methemoglobiny (např. Hb. M (Milwaukee), toxické methemoglobiny)

Hemoglobinopatie 1: nestabilní hemoglobiny

Hemoglobinopatie 1: nestabilní hemoglobiny Nestabilní hemoglobiny zahrnují skupinu onemocnění s vrozenou mutací globinových genů způsobujících sníženou solubilitu Hb. Snížená solubilita patologických hemoglobinů vede ke vzniku nerozpustného precipitátu, který se projeví morfologicky jako inkluze v erytrocytu (=tzv. Heinzovo tělísko). Rozdělení: 1. Choroba Hb. SS= srpkovitá anémie 2. Choroba Hb. C 3. Další nestabilní Hb (Hb. D-Punjab, Hb. O-Arab, Hb. E aj. ) 4. Thalasémie (probírají se zvlášť)

Srpkovitá anémie (choroba Hb. SS) Hb. S vzniká na podkladě vrozené bodové mutace genu pro beta-globinový řetězec Hb (HBB). Dochází k mutaci HBB v oblasti 6. kodonu GAG GTG, což způsobí záměnu glu val (=6. aminokyselina beta-globinového řetězce) Heterozygoti- Hb. AS (= rys srpkovité anémie) tvoří cca 40% Hb. S a 60% Hb. A, což obvykle nezpůsobuje výraznější klinické symptomy. Srpkovité erytrocyty (sickle cells) se u heterzygotů nevyskytují. Homozygoti- Hb. SS (= srpkovitá anémie) tvoří >40% Hb. S a dochází u nich k přeměně normocytů v srpkovité erytrocyty. Cca 8% africké populace jsou nosiči alely b. S, 3% alely b. C, 1, 5% alely pro beta-thalassémii (b 0/b+). Nosičství alely pro srpkovitou anémii snižuje parazitémii Plasmodium Falciparum a snižuje úmrtnost na malárii. Mechanismus není zcela objasněn.

Srpkovitá anémie a další srpkovité choroby Alela b. S kódující Hb. S se může kombinovat i s jinými patologickými alelami beta-globinu než s b. S, např. s b. C kódující Hb. C (vzniká choroba Hb. SC) nebo s b 0 kódující beta-thalassémii (vzniká Hb. Sbeta-thalasémie). Tyto choroby se v anglosaské literatuře označují jako srpkovitá choroba (sickle cell disease, např. b. S/b 0, b. S/b. C aj. ) na rozdíl od srpkovité anémie (b. S/b. S)

Srpkovitá anémie Homozygoti- Hb. SS (= srpkovitá anémie) tvoří >40% Hb. S a dochází u nich k přeměně normocytů v srpkovité erytrocyty. Deoxy-Hb. S má výrazně sníženou solubilitu a po deoxygenaci polymerizuje do podoby viskózního, semi-solidního gelu. Vzniká nevratně zesrpkovatělý erytrocyt (irreversibly sickled cell), který má tendenci působit proagregačně a prokoagulačně. Dochází k ucpání mikrocirkulace a vzniku extrémně bolestivých vazookluzivních krizí. Dále dochází k aktivaci koagulace a zvýšenému riziku vzniku trombóz.

Poruchy morfologie a funkce erytrocytů Erytrocyty s Hb. S mají zvýšenou rigiditu buněčné membrány, což vede ke zvýšení viskozity krve. Současná dehydratace či infekce u pacienta se srpkovitou anémií může tudíž snadno precipitovat vznik vazookluzivní krize. Erytrocyty u srpkovité anémie mají narušenou výměnu iontů s vnějším prostředím, což má za následek snížený obsah vody a vysokou koncentraci hemoglobinu v cytoplasmě (MCHC). Až 40% erytrocytů je extrémně denzních (>380 g/L Hb). Hyperviskozita cytoplazmy erytrocytů se významně podílí na jejich zvýšené rigiditě. Ta je pak podkladem zvýšené viskozity krve. Při srpkovatění erytrocytů dochází k externalizaci fosfatidylserinu z vnitřní na vnější stranu buněčné membrány dochází k aktivaci koagulace. Denaturace Hb v cytoplazmě erytrocytů katalyzuje oxidativní poškození buněčných struktur, zejména membrány zvýšení fragility + snížení deformability erytrocytů + zvýšená opsonizace autoprotilátkami.

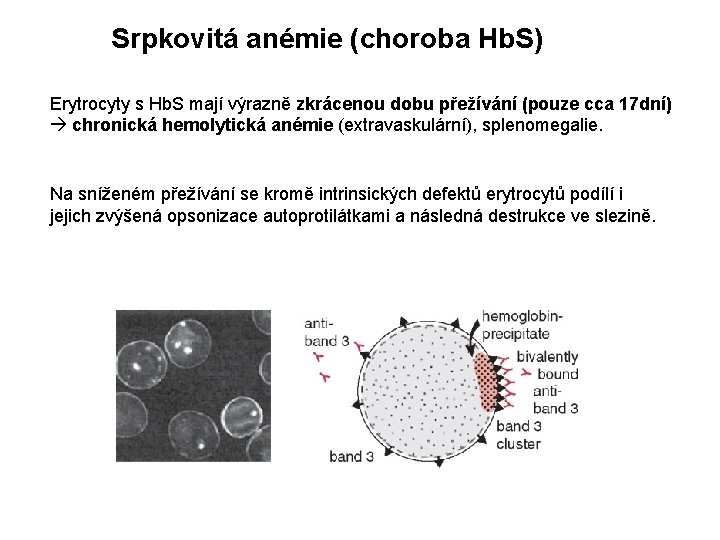
Srpkovitá anémie (choroba Hb. S) Erytrocyty s Hb. S mají výrazně zkrácenou dobu přežívání (pouze cca 17 dní) chronická hemolytická anémie (extravaskulární), splenomegalie. Na sníženém přežívání se kromě intrinsických defektů erytrocytů podílí i jejich zvýšená opsonizace autoprotilátkami a následná destrukce ve slezině.

Klinický obraz Srpkovitá anémie je charakterizována chronickou hemolytickou anémií (extravaskulární) přerušovanou atakami bolestivých vazookluzivních krizí. Mezi vazookluzivní krize patří: -akutní syndrom hrudníku (acute chest syndrome) -osteonekróza -sekvestrace sleziny až autosplenektomie -daktylitida syndrom ruka-noha (hand-foot syndrome) -renální insuficience -retinopatie -priapismus -ulcerace dolních končetin

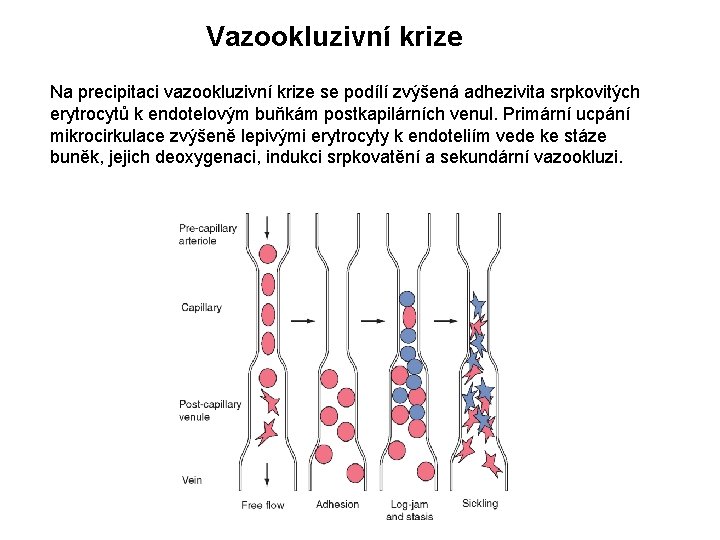
Vazookluzivní krize Na precipitaci vazookluzivní krize se podílí zvýšená adhezivita srpkovitých erytrocytů k endotelovým buňkám postkapilárních venul. Primární ucpání mikrocirkulace zvýšeně lepivými erytrocyty k endoteliím vede ke stáze buněk, jejich deoxygenaci, indukci srpkovatění a sekundární vazookluzi.

Komplikace srpkovité anémie 1. Vazookluzivní krize 2. Tromboembolické komplikace (zejména trombóza mozkových cév). Jedná se obvykle o uzávěr velkých cév (10% pacientů je mladších 20 let !!! devastující následky). Relativní riziko vzniku iktu je u pacientů se srpkovitou anémií 400 x vyšší než ve zdravé populaci. 3. Funkční hyposplenismus (až funkční autosplenektomie= zánik funkčního parenchymu sleziny v důsledku opakovaných vazookluzivních atak) infekce (pneumonie), Howell-Jollyho tělíska v erytrocytech 4. Sekvestrační krize (sekvestrace krve ve slezině, v játrech kolaps cirkulace 5. Aplastická krize (obvykle na podkladě infekce parvovirem B 19) 6. Megaloblastová krize (následkem sekundárního deficitu folátu, event. vit. B 12 při erythroidní hyperplazii) 7. Dna (z hypermetabolismu), žlučníkové kameny (při chronické hemolýze) 8. Aloimunizace (následkem chronické transfuzní podpory) riziko vzniku hemolytických potransfuzních reakcí

Principy terapie 1. Modifikace choroby (hydroxyurea zvýšení exprese Hb. F) 2. Analgoterapie bolestivých vazookluzivních atak (opiáty) 3. Snížení viskozity krve (=hydratace) 4. Tromboprofylaxe / antikoagulace 5. Substituce (transfuzní podpora, event. výměnná erytrocytaferéza) 6. Suplementace folátu, vit. B 12 7. Terapie přetížení železem (tj. chelátory) 8. Splenektomie (=zmírnění anémie) 9. Náhrada krvetvorby (alogenní transplantace kostní dřeně) 10. Kauzální terapie (= genová terapie- oprava HBB)- experimentálně

ANÉMIE III. - PREZENTACE V BODECH 1. Chronické hemolytické anémie: vrozené, Coombs-negativní A. Vrozené poruchy erytrocytární membrány (sférocytóza, eliptocytóza atd. ) B. Enzymopatie (deficit G 6 PD, deficit PK aj. ) C. Thalassémie (thalassémie alfa, beta) D. Další hemoglobinopatie (nestabilní Hb, zvýšená afinita k O 2, methemoglobinémie aj. ) 2. Anémie spojené s útlumem erytropoézy a dyserytropoetické anémie (DBA, PRCA, nádorová infiltrace, CDA aj. ) 3. Polycytémie

Hemoglobinopatie 2: hemoglobiny se zvýšenou afinitou ke kyslíku (s nízkým p 50) a toxické Hb

Hemoglobinopatie 2: hemoglobiny se zvýšenou afinitou ke kyslíku (s nízkým p 50) a toxické Hb 1. Vrozené mutace Hb= zvýšená afinita Hb k O 2 (např. Hb-Olomouc) 2. Toxické Hb= kompetice jiného plynu než O 2 při vazbě na nemutovaný Hb. A (např. otrava CO karboxy-Hb, otrava CO 2 karbamino-Hb) Zvýšená afinita ke kyslíku následkem vrozené mutace (např. Hb-Olomouc) má za následek sníženou dodávku kyslíku do tkání a vznik hypoxie. Tíže symptomů závisí na koncentraci patologického hemoglobinu. Koncentrace do 30% obvykle nevyvolávají větší klinický efekt. Koncentrace nad 50% jsou obvykle spojeny s postupnou ztrátou vědomí a asfyxií.

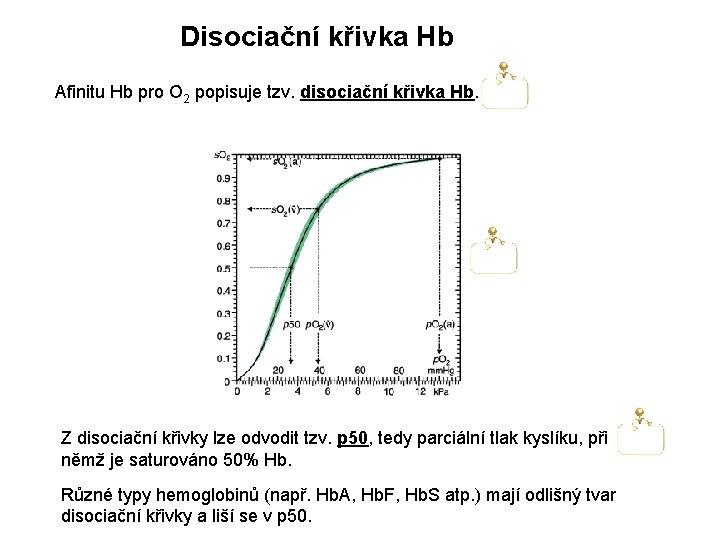
Disociační křivka Hb Afinitu Hb pro O 2 popisuje tzv. disociační křivka Hb. Z disociační křivky lze odvodit tzv. p 50, tedy parciální tlak kyslíku, při němž je saturováno 50% Hb. Různé typy hemoglobinů (např. Hb. A, Hb. F, Hb. S atp. ) mají odlišný tvar disociační křivky a liší se v p 50.

Otrava CO CO má 250 x vyšší afinitu k Hb (karboxy-Hb / karbonyl-Hb) než O 2. K otravě dochází při nedokonalém spalování a špatné ventilaci (kouřové plyny, koupelny s karmou, garáže) Klinický obraz: <10% karboxy-Hb: asymptomatické 10 -20% karboxy-Hb: bolesti hlavy 20 -30% karboxy-Hb: silné bolesti hlavy, nauzea, zvracení 30 -40% karboxy-Hb: poruchy vízu, prekoma až koma 40 -60% karboxy-Hb: koma až hluboké koma >60% karboxy-Hb: exitus CAVE: saturace O 2 zavádějící, sliznice růžové i při těžké hypoxii (není cyanóza), CO je plyn bez barvy a zápachu Terapie: 1. Evakuace pacienta 2. 100% O 2, lépe hyperbarická oxygenoterapie

Otrava CO 2 se váže na Hb fyziologický, neboť cca 10% CO 2 je transportováno z tkání do plic v podobě karbamino-sloučenin CO 2 a Hb (Hb. NH 2 + CO 2 Hb. NHCOO - + H+). Ke zvyšování koncentrace CO 2 v prostředí může docházet v špatně ventilovaných uzavřených prostorách, kde probíhá rozklad organických látek (např. jeskyně, vinné sklepy, odpadní jámy, štoly, sila). Normální koncentrace CO 2 ve vzduchu je 0, 03%. Koncentrace CO 2 <5% způsobují únavu, bolesti hlavy, rozmazané vidění, závratě, zrychlené dýchání a pocity tíže na prsou. Koncetrace <5% nejsou patrně přímo toxické, ale uvedené symptomy jsou nejspíše způsobené relativním snížením koncentrace O 2 ve vzduchu a z toho plynoucí nižší vazbou kyslíku na Hb. Koncentrace CO 2 >5% jsou již přímo toxické a způsobují smrt asfyxií.

ANÉMIE III. - PREZENTACE V BODECH 1. Chronické hemolytické anémie: vrozené, Coombs-negativní A. Vrozené poruchy erytrocytární membrány (sférocytóza, eliptocytóza atd. ) B. Enzymopatie (deficit G 6 PD, deficit PK aj. ) C. Thalassémie (thalassémie alfa, beta) D. Další hemoglobinopatie (nestabilní Hb, zvýšená afinita k O 2, methemoglobinémie aj. ) 2. Anémie spojené s útlumem erytropoézy a dyserytropoetické anémie (DBA, PRCA, nádorová infiltrace, CDA aj. ) 3. Polycytémie

Hemoglobinopatie 3: methemoglobinémie

Methemoblobin (met-Hb) a jeho enzymatická redukce na hemoglobin (Hb) Cytochrom b 5 reduktáza katalyzuje redukci met-Hb na Hb. Nezbytným kofaktorem těchto reakcí je NADH. Methemoglobin může být redukován na Hb též pomocí methylenové modři. Methylenová modř však vyžaduje jako kofaktor NADPH, vznikající pentózovým zkratem (vyžaduje tudíž přítomnost funkčního enzymu G 6 PD (glukózo-6 -fosfátdehydrogenáza). Methylenová modř tak nemůže být použita k redukci met-Hb na Hb u pacientů s deficitem G 6 PD.

Hemoglobinopatie 3: methemoglobinémie Methemoglobinémie lze dělít do dvou velkých skupin: 1. Vrozené 2. Získané (toxické), např. nitráty, benzokain Vrozené methemoglobinémie lze dále dělit na: 1. Mutace genu pro Hb, např. Hb. M (Milwaukee) 2. Mutace enzymatické dráhy podílející se na redukci methemoglobinu, např. defekt cytochrom-b 5 -reduktázy Tíže symptomů u methemoglobinémie závisí na koncentraci methemoglobinu. Koncentrace do 30% má obvykle pouze kosmetický efekt (podobný cyanóze). Koncentrace nad 50% jsou obvykle spojeny s rychlou ztrátou vědomí a asfyxií.

Methemoglobinémie: diagnóza a terapie Cyanóza nejasné etiologie při normálním p. O 2 a normální hladině celkového Hb podezření na methemoglobinémii. Terapie: -1% roztok methylenové modři 1 -2 mg/kg i. v. (=cca 10 m. L 1% methylenové modři i. v. na dospělého člověka) -Kyselina ascorbová (u pacientů s deficitem G 6 PD)

ANÉMIE III. - PREZENTACE V BODECH 1. Chronické hemolytické anémie: vrozené, Coombs-negativní A. Vrozené poruchy erytrocytární membrány (sférocytóza, eliptocytóza atd. ) B. Enzymopatie (deficit G 6 PD, deficit PK aj. ) C. Thalassémie (thalassémie alfa, beta) D. Další hemoglobinopatie (srpkovitá anémie, methemoglobinémie aj. ) 2. Anémie spojené s útlumem erytropoézy a dyserytropoetické anémie (DBA, PRCA, nádorová infiltrace, CDA aj. ) 3. Polycytémie

2. ANÉMIE SPOJENÉ S ÚTLUMEM KRVETVORBY A DYSERYTROPOETICKÉ ANÉMIE

APLASTICKÉ ANÉMIE (AA)

Aplastické anémie (AA) Aplastické anémie jsou anémie charakterizované útlumem krvetvorby (jedná se tudíž spíše o aplastické pancytopenie, protože postižena je celá krvetvorba). Aplastické anémie lze rozdělit na: 1. Vrozené AA 2. Získané AA Získaná AA se dělí do dvou velkých skupin: 1. Idiopatická / idiosynkratická AA 2. Sekundární AA

Získaná AA Získaná aplastická anémie je charakterizovaná získaným selháním krvetvorby s aplázií či těžkou hypoplázií kostní dřeně a pancytopenií v periferním krevním obraze. Diagnostická kritéria těžké aplastické anémie: Počet retikulocytů <20 x 109/L Počet trombocytů <20 x 109/L Počet neutrofilních segmentů <0, 5 x 109/L Buněčnost kostní dřeně <30%

Získaná idiopatická / idiosynkratická AA V patofyziologii získané idiopatické / idiosynkratické AA hraje patrně hlavní roli imunitně zprostředkovaná destrukce krvetvorných progenitorů kostní dřeně patologickým klonem T-lymfocytů. Příčina je neznámá. Získaná idiopatická AA je diagnóza per exclusionem a pro stanovení této diagnózy je třeba vyloučit sekundární příčiny selhání krvetvorby včetně: 1. AA asociované s virovým onemocnění (hepatitida, mononukleóza) 2. AA po expozici léky, chemickými sloučeninami či radiací 3. Paroxysmální noční hemoglobinurii 3. Hypoproliferační MDS 4. Hypocelulární formy akutních leukémií 5. Některé lymfoproliferativní choroby (lymfomy) 5. Fibrózu kostní dřeně při myeloproliferativním onemocnění 6. Infiltraci kostní dřeně maligním onemocněním 7. Vrozené formy aplastických anémií (viz. dále)

Získaná idiopatická / idiosynkratická AA Má typickou bifázickou incidenci. Postihuje mladé lidi (10 -25 let) a starší osoby (>60 let). Jedná se o vzácné onemocnění (incidence= 2 per 1 milion). AA se projevuje nejčastěji kožním a slizničním krvácením při trombocytopenii, vzácněji infekcemi. Lymfadenopatie či splenomegalie je extrémně vzácná. AA může přejít v akutní myeloidní leukémii či paroxysmální noční hemoglobinurii. Principem terapie získané idiopatické AA je u starších pacientů (>40 let) imunosuprese (ATG= antithymocytární globulin, CSA= cyklosporin A), u mladších pacientů (<40 let) se dává přednost alogenní transplantaci kostní dřeně.

Vrozené AA= vrozené syndromy selhání krvetvorby Vrozené AA= vrozené syndromy selhání kostní dřeně (inherited bone marrow failure syndromes- IHMFS). Mezi vrozené AA patří: 1. Fanconiho anémie (FA) 2. Dyskeratosis congenita (DC) 3. Schwachmann-Diamondův syndrom (SDS)

Vrozené AA= vrozené syndromy selhání krvetvorby Obecné principy: 1. Vrozené syndromy selhání krvetvorby jsou geneticky podmíněné choroby způsobené vrozenými mutacemi genů udržujících stabilitu chromozomů (FA) či délku telomér (DC, SDS). 2. Selhání kostní dřeně je obvykle pouze jedním ze symptomů těchto onemocnění, která bývají provázena řadou vývojových poruch (zejména skeletálních), malým vzrůstem a kožně-slizničními anomáliemi. 3. Známky selhání krvetvorby se typicky manifestují až v postnatálním období, obvykle v první dekádě, někdy však až v druhé či třetí dekádě života. 4. Vrozené syndromy selhání krvetvorby jsou spojené se zvýšeným (někdy extrémně vysokým) rizikem vzniku sekundárních malignit (leukémie, solidní tumory) v porovnání se zdravou populací. Principy terapie: 1. Stimulace krvetvorby (androgeny, rekombinantní růstové faktory) 2. Náhrada krvetvorby (alogenní transplantace kostní dřeně) 3. Imunosuprese (kortikoidy)- spíše doplňkový význam

Fanconiho anémie FA je vrozená porucha charakterizovaná mutací genů (FANCA, FANCC, BRCA 2 aj. ) podílejících se na udržování integrity chromozomů u FA dochází k extrémně zvýšené lomivosti chromozomů. Klinický obraz: 1. Vývojové poruchy 2. Časné selhání krvetvorby (rozvoj AA mezi 3. -14. rokem života) 3. Extrémní riziko vzniku sekundárních malignit Z vývojových poruch je pro FA typická absence palců, absence radií, krátký vzrůst, hyperpigmentace kůže (café-au-lait), hypogonadismus, mikrocefalie (facies Fanconica) Riziko vzniku sekundárních malignit je ve srovnání se zdravou populací extrémně zvýšené: 4000 x vyšší riziko vzniku karcinomu genitálního traktu u žen, 800 x vyšší riziko vzniku AML, 700 x vyšší riziko vzniku karcinomu hlavy a krku. Principy terapie: náhrada krvetvorby (alogenní transplantace kostní dřeně), stimulace krvetvorby (androgeny)

Dyskeratosis congenita (DC) DC je vrozená porucha charakterizovaná mutací genů (TERT, TERC, DKC 1 aj. ) podílejících se na údržbě délky telomér. Klinický obraz: 1. Hyperpigmentace, slizniční leukoplakie, dystrofie nehtů 2. Selhání krvetvorby (AA) 3. Zvýšené riziko vzniku sekundárních malignit Porucha údržby telomér se projevuje jejich extrémním zkrácením (pod 1 percentil zdravé populace). Zkrácení telomér má patrně za následek postupný zánik kompartmentu kmenových krvetvorných buněk. Progredující selhání krvetvorby se typicky manifestuje v druhé dekádě života. Pacienti bez léčby umírají kolem věku 20 let. Principy terapie: náhrada krvetvorby (alogenní transplantace kostní dřeně), stimulace krvetvorby (androgeny)

Schwachman-Diamondův syndrom (SDS) SDS je vrozená porucha charakterizovaná mutací genů (např. SBDS), což vede (podobně jako u DC) k abnormálnímu zkracování telomér. Klinický obraz: 1. Insuficience exokrinní funkce pankreatu 2. Selhání krvetvorby (nejčastěji neutropenie, trombocytopenie, event. AA) 3. Vývojové poruchy (krátký vzrůst, skeletální abnormality) 4. Z neutropenie plynoucí extrémně špatná ústní hygiena (záněty, defekty, kazy, gingivitidy apod. ) 5. Zvýšené riziko vzniku akutní myeloidní leukémie Pacienti bez léčby se dožívají 30 -40 let. Principy terapie: alogenní transplantace kostní dřeně, stimulace granulopoézy (rekombinantní růstové faktory, např. G-CSF= granulocyte-colony stimulating factor).

ČISTÁ APLÁZIE ČERVENÉ ŘADY (PRCA, DBA)

Izolované (čisté) aplázie červené řady= PRCA (pure red cell aplasia) PRCA jsou anémie charakterizované útlumem erytropoézy bez postižení ostatních linií hematopoézy. CAVE: termín aplastická anémie (který by logicky odpovídal výše uvedenému popisu je vyhrazen pro stavy komplexního selhání krvetvorby- tedy pro aplastické pancytopenie). PRCA lze rozdělit na: 1. Vrozená= DBA (Diamond-Blackfanova anémie) 2. Získané PRCA se dělí do dvou velkých skupin: 1. Primární / idiopatické 2. Sekundární

Získané PRCA V patofyziologii získané primární / idiopatické PRCA hraje patrně hlavní roli imunitně zprostředkovaná destrukce krvetvorných progenitorů kostní dřeně patologickým klonem T-lymfocytů. Příčina je neznámá. Získaná primární / idiopatická PRCA je diagnóza per exclusionem a pro stanovení této diagnózy je třeba vyloučit sekundární příčiny selhání krvetvorby včetně: 1. PRCA asociované s virovým onemocnění (zejména parvovirus B 19, EBV, hepatititdy) 2. PRCA po expozici léky či chemickými sloučeninami 3. PRCA v rámci systémových chorob pojiva (SLE, RA, SS) 4. PRCA vyvolané protilátkami proti erytropoetinu téměř výlučně u pacientů léčených rekombinantními erytropoetiny 5. PRCA po ABO-inkompatibilní alogenní transplantaci kostní dřeně 6. PRCA asociovaná s thymomem (patologický T-lymfocytární klon) 7. PRCA asociovaná s hematologickými malignitami (CLL, LGL)

Klinický obraz, diagnostika, principy terapie PRCA Klinickému obrazu dominuje normocytární normochromní anémie s hlubokou retikulocytopenií. Diagnostika= per exclusionem (viz. předchozí snímek) Principy terapie: 1. Vrozená PRCA (=DBA): náhrada krvetvorby (alogenní transplantace kostní dřeně) 2. Získaná sekundární PRCA: terapie vyvolávající příčiny (zastavení podávání léků asociovaných s PRCA, chirurgické odstranění thymomu, léčba malignity, podávání imunoglobulinů u virových infekcí (parvovirus B 19) apod. ) 3. Získaná primární idiopatická PRCA: imunosuprese (kortikoidy)

PAROXYSMÁLNÍ NOČNÍ HEMOGLOBINURIE (PNH)

PNH je získaná klonální porucha krvetvorby projevující se: 1. Hemolytickou anémií 2. Selháním krvetvorby (=sekundární aplastická anémie) 3. Tromboembolickými komplikacemi (PNH= trombofilní stav). Získaná mutace genu PIG-A v hematopoetické kmenové buňce má za následek kompletní chybění membránových proteinů ukotvených pomocí tzv. GPI kotvy (GPI= glycosyl-phosphoinositol). Mezi GPIdependentní proteiny patří mimo jiné molekuly také inhibitory komplementové kaskády (CD 55/DAF= decay accelerating factor a CD 59/MIRL= membrane inhibitor of reactive lysis). Defekt GPIdependentních molekul lze detekovat na všech krevních buňkách (kromě erytrocytů též např. monocyty či granulocyty) Následkem defektní inhibice komplementové kaskády dochází k intravaskulární hemolýze. Volný hemoglobin z rozpadlých erytrocytů na sebe váže oxid dusný, což vyvolá spazmy hladkého svalstva (jícnové spasmy) a snížený průtok ledvinami s hrozbou renální insuficience.

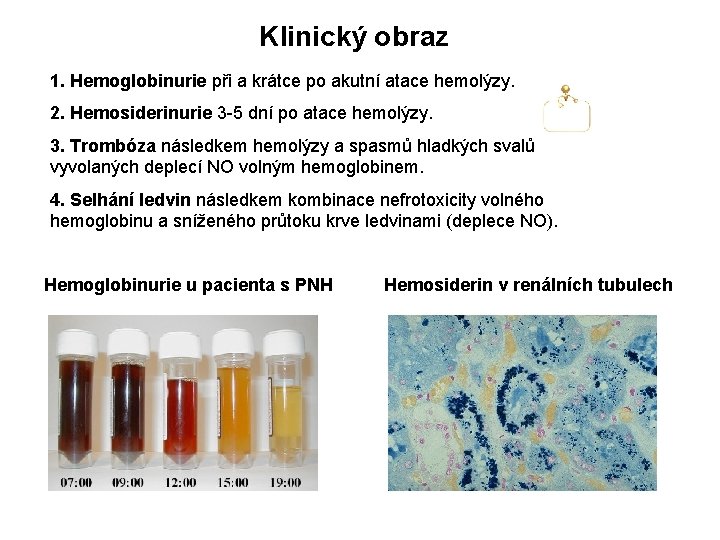
Klinický obraz 1. Hemoglobinurie při a krátce po akutní atace hemolýzy. 2. Hemosiderinurie 3 -5 dní po atace hemolýzy. 3. Trombóza následkem hemolýzy a spasmů hladkých svalů vyvolaných deplecí NO volným hemoglobinem. 4. Selhání ledvin následkem kombinace nefrotoxicity volného hemoglobinu a sníženého průtoku krve ledvinami (deplece NO). Hemoglobinurie u pacienta s PNH Hemosiderin v renálních tubulech

PNH Laboratorní nálezy: 1. Anémie normocytární normochromní 2. Plazmatické železo snížené následkem krevních ztrát při hemoglobinurii 3. Haptoglobin snížený či neměřitelný následkem hemolýzy 4. Počet retikulocytů ZVÝŠENÝ (krvetvorba v kostní dřeni je zvýšená) 5. Přímý Coombsův test NEGATIVNÍ (hemolýza není vyvolaná autoprotilátkou) 6. Bilirubin a LDH zvýšené následkem hemolýzy Počet erytrocytů s defektem GPI-dependentních proteinů musí být obvykle >15%, abychom mohli uzavřít dg. PNH klony <15% zřídkakdy způsobují klinické symptomy a vyžadují terapii.

PNH a selhání krvetvorby Aplastická anémie se u pacientů s PNH velmi pravděpodobně vyvíjí na podkladě T-lymfocyty-mediované imunitně podmíněné destrukce hematopoetických progenitorů s mutací genu PIG-A. U časti pacientů se získanou idiopatickou aplastickou anémií (AA) lze detekovat malý PNH klon (obvykle <10%). PNH AA Na PNH je třeba myslet v rámci diferenciální diagnózy u pacientů se získaným syndromem selhání krvetvorby (= získanou aplastickou anémií= získanou pancytopenií).

PNH a trombóza Trombóza představuje nejčastější příčinu smrti u pacientů s PNH. Další příčiny úmrtí: -selhání krvetvorby -renální insuficience -přechod do MDS/AML (vzácně) Přežití pacientů s PNH je extrémně variabilní (medián 10 -15 let).

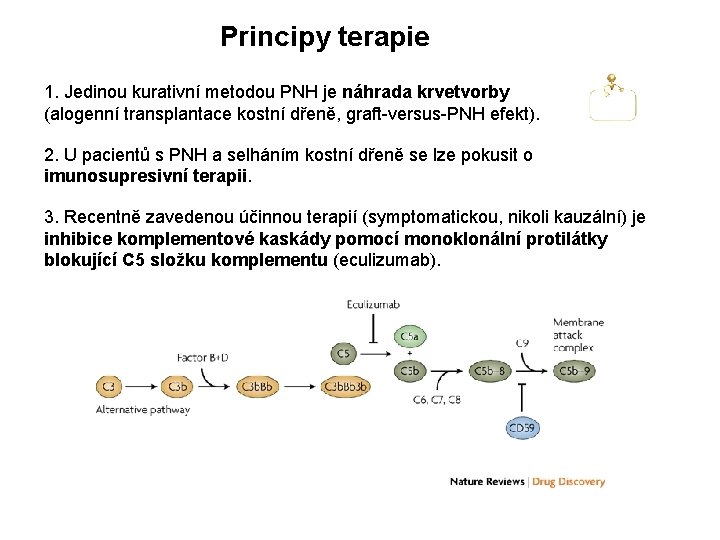
Principy terapie 1. Jedinou kurativní metodou PNH je náhrada krvetvorby (alogenní transplantace kostní dřeně, graft-versus-PNH efekt). 2. U pacientů s PNH a selháním kostní dřeně se lze pokusit o imunosupresivní terapii. 3. Recentně zavedenou účinnou terapií (symptomatickou, nikoli kauzální) je inhibice komplementové kaskády pomocí monoklonální protilátky blokující C 5 složku komplementu (eculizumab).

KONGENITÁLNÍ DYSERYTROPOETICKÉ ANÉMIE (CDA)

Vrozené poruchy erytropoézy: kongenitální dyserytropoetické anémie (CDA) CDA=
 Obhu
Obhu Anmie
Anmie Anmie
Anmie Centre henri becquerel hématologie
Centre henri becquerel hématologie Hematologie groningen
Hematologie groningen Toxische korreling symptomen
Toxische korreling symptomen Hamlet act iii scene ii
Hamlet act iii scene ii Rovnovážný stav soustavy
Rovnovážný stav soustavy Prilastek
Prilastek Degenerované orbitaly
Degenerované orbitaly Stav zalel
Stav zalel Okamžitý stav ovzdušia
Okamžitý stav ovzdušia šídlo
šídlo Stav sav
Stav sav Stav ssu
Stav ssu Spetni stav
Spetni stav Excitovaný stav fosforu
Excitovaný stav fosforu Stav_sav
Stav_sav Excitovany stav
Excitovany stav Criterios de roma iii
Criterios de roma iii Iii iv y vi par craneal
Iii iv y vi par craneal Nsds iii
Nsds iii Exercícios present perfect 9 ano com gabarito doc
Exercícios present perfect 9 ano com gabarito doc Bazel iii
Bazel iii Wppsi punteggi
Wppsi punteggi Androgyne 3
Androgyne 3 Allinanchor:pwc.de
Allinanchor:pwc.de Sejarah tingkatan 2 bab 7
Sejarah tingkatan 2 bab 7 Tubuli recti
Tubuli recti Hamlet act iii scene i
Hamlet act iii scene i Pentaaqua thiocyanato iron(iii)
Pentaaqua thiocyanato iron(iii) Conditionals type 3
Conditionals type 3 George nichols iii
George nichols iii John d. rockefeller iii
John d. rockefeller iii Alpine space programme
Alpine space programme Chwyt credego
Chwyt credego Hbcu title iii administrators
Hbcu title iii administrators Iron(iii) chloride (aq) + cesium phosphate (aq)
Iron(iii) chloride (aq) + cesium phosphate (aq) Rotula tipo 2 wiberg
Rotula tipo 2 wiberg Group iii elements
Group iii elements Nickel (iii) carbonate formula
Nickel (iii) carbonate formula Cadses
Cadses Pentium iii
Pentium iii Quotes about romeo killing tybalt
Quotes about romeo killing tybalt Iii domingo de cuaresma ciclo c
Iii domingo de cuaresma ciclo c Smartlegal polygon
Smartlegal polygon Thora seal 3
Thora seal 3 Innocenzo iii
Innocenzo iii Como achar a veia femoral
Como achar a veia femoral Microaggressions
Microaggressions Title iii requirements
Title iii requirements Climax of hamlet act 3
Climax of hamlet act 3 Telpas speaking rubric
Telpas speaking rubric Divina commedia inferno parafrasi
Divina commedia inferno parafrasi Erf form for teachers deped
Erf form for teachers deped English level iii
English level iii Motywy biblijne w malarstwie
Motywy biblijne w malarstwie Dario iii
Dario iii Certificate in pathology collection
Certificate in pathology collection Miocosi
Miocosi Emil nolde natura morta con maschere
Emil nolde natura morta con maschere Neustria austrasia e borgogna
Neustria austrasia e borgogna Hcps iii
Hcps iii Mater matris particolarità
Mater matris particolarità King george iii
King george iii Itis vittorio emanuele iii
Itis vittorio emanuele iii Mrp rendszer
Mrp rendszer Wppsi iii instrucciones
Wppsi iii instrucciones Triammine triaquachromium (iii) chloride
Triammine triaquachromium (iii) chloride Norma k 3
Norma k 3 Triamminetrichlorocobalt(iii)
Triamminetrichlorocobalt(iii) Ies carlos iii aguadulce
Ies carlos iii aguadulce Mbti step ii
Mbti step ii George washington and john adams venn diagram
George washington and john adams venn diagram Ensayos fase iii clinicaltrials.gov
Ensayos fase iii clinicaltrials.gov Mrp mrp2 erp
Mrp mrp2 erp Act 3 summary crucible
Act 3 summary crucible Nic
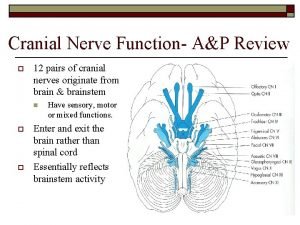
Nic Smiling cranial nerve
Smiling cranial nerve John d. rockefeller iii
John d. rockefeller iii Solvency 2 pillar 1
Solvency 2 pillar 1 Red side row barrettes
Red side row barrettes Plano de hodge
Plano de hodge Tekstura crtezi
Tekstura crtezi Iii domenica di avvento anno c
Iii domenica di avvento anno c System mrp 1
System mrp 1 7 ano iii bimestre aula 1
7 ano iii bimestre aula 1 Jan iii sobieski lew lechistanu
Jan iii sobieski lew lechistanu What is a class iii laser
What is a class iii laser George washington vs king george iii
George washington vs king george iii Credit point system iii
Credit point system iii Wavewatch iii tutorial
Wavewatch iii tutorial Hamlet; act iv; scene v; place.
Hamlet; act iv; scene v; place. Msc rini iii
Msc rini iii Pope innocent iii on the misery of the human condition
Pope innocent iii on the misery of the human condition Icao annex10
Icao annex10 Danforth in the crucible
Danforth in the crucible Dyrektywa seveso
Dyrektywa seveso Weathercoder
Weathercoder Pnafm iii
Pnafm iii Ramses ii and moses
Ramses ii and moses Dip monitoreo fetal
Dip monitoreo fetal Powstanie kościuszkowskie prezentacja
Powstanie kościuszkowskie prezentacja Qualification title
Qualification title Va handbook 5017 part iii appendix a
Va handbook 5017 part iii appendix a Pnafm iii
Pnafm iii