gsek reakcimechanizmusainak fejlesztse Turnyi Tams turanyichem elte hu














- Slides: 25

Égések reakciómechanizmusainak fejlesztése Turányi Tamás turanyi@chem. elte. hu ELTE Kémiai Intézet Reakciókinetikai Laboratórium 2012. november 29.

Részletes reakciómechanizmusok (Majdnem) minden kémiai reakció sok reakciólépésen keresztül zajlik le: köztitermékek keletkeznek és tovább reagálnak. A kémiai folyamatok részletes reakciómechanizmusokkal írhatók le. • Égések, robbanások modellezése • erőművek, kazánok, motorok • hatásfok optimalizálása • szennyezőanyag-kibocsátás csökkentése • Légkörkémiai folyamatok modellezése • légszennyezés előrejelzése • kibocsátási korlátok megállapítása • Vegyi üzemek, gyártási folyamatok modellezése • hatásfok és környezetvédelem optimalizálása • Biokémiai kinetikai folyamatok modellezése • Metabolizmus hálózatok • Molekuláris jelterjedés • Sejtciklus modellezése • gyógyszerfejlesztés új alapokon

Részletes reakciómechanizmusok: sok reakciólépés és sok paraméter hidrogén égése földgáz égése benzin égése Diesel-olaj égése 30 reakciólépés 3000 reakciólépés 15000 reakciólépés Egy vázlatos 11 -lépéses hidrogén égési mechanizmus: 1 2 3 4 5 6 7 8 9 10 11 k (T, p) H 2 + O 2 . H +. HO 2. OH + H 2 . H + H 2 O. H + O 2 . OH + O O + H 2 . OH +. H. H + O 2 + M . HO 2 + M. H fal : O fal. OH fal. HO 2 + H 2 . H + H 2 O 2 2. HO 2 H 2 O 2 + O 2 H 2 O 2 2. OH k 1(T, p) k 2(T, p) k 3(T, p) k 4(T, p) k 5(T, p) k 6(T, p) k 7(T, p) k 8(T, p) k 9(T, p) k 10(T, p) k 11(T, p) hőmérsékletfüggés megadása: 3 -paraméteres Arrhenius-egyenlet nyomásfüggés megadása: további akár 7 paraméter További paraméterek anyagonként: termodinamikai adatok, diffúzió, viszkozitás

Pontos reakciómechanizmusok kifejlesztése Közvetlen (direkt) reakciókinetikai mérések: • minden reakciólépést külön kipreparálnak • egy-egy elemi reakciólépés sebességi paramétereinek meghatározása Közvetett (indirekt) mérések: az eredményük csak részletes mechanizmus szimulációjával reprodukálható • lángsebesség mérése • gyulladási idő mérése • koncentrációk változása reaktorokban Mechanizmusfejlesztés hagyományos módon: A közvetlen mérések eredménye alapján állítják össze a részletes mechanizmust. A mechanizmus „igazolása” a közvetett mérések eredményével

A hagyományos mechanizmusfejlesztés problémái 1. A direkt mérések hibája nagy. A meghatározott sebességi együtthatók bizonytalansága legalább 30 -50%. 2. Az összeállított részletes mechanizmus nem reprodukálja az indirekt mérési adatokat. egyes sebességi együtthatókat önkényesen hangolnak. 3. A paraméterek bizonytalansága nem ismert, a bizonytalanságukra csak önkényes becslések vannak.

ELTE Reakciókinetikai Laboratóriumában kifejlesztett új optimalizációs módszer fő tulajdonságai 1. A közvetlen és a közvetett méréseket egyidejűleg veszi figyelembe. 2. Minden sebességi paraméter bizonytalansági tartományát meghatározzuk Nagy, T. ; Turányi, T. Uncertainty of Arrhenius parameters Int. J. Chem. Kinet. , 43, 359 -378 (2011) 3. A fontos reakciók minden Arrhenius parameterét (A, n, E) + egyéb sebességi paramétereket illesztjük. Turányi T, Nagy T, Zsély I. Gy, Cserháti M, Varga T, Szabó B, Sedyó I, Kiss P, Zempléni A, Curran H J: Determination of rate parameters based on both direct and indirect measurements. Int. J. Chem. Kinet. , 44, 284– 302(2012)

Paraméterek optimalizálása és hibabecslése Optimalizálás = az alábbi Q célfüggvény értékének minimalizálása yk mért/számított sebességi együttható mért/számított indirekt mérési eredmény VAGY A becsült paraméterek kovariancia mátrixának számítása: 7

„Numerikus házifeladat” több százszor nagyobb méretben „numerikus házifeladat” 3 paraméter illesztése 1 mérésből származó 15 adatpontra méréssorozat kiértékelése 8 -10 paraméter illesztése 30 -40 mérésből származó 4000 adatpontra Pl. lökéshullám-cső mérések feldolgozása mechanizmus fejlesztése 30 -50 paraméter illesztése 250 mérésből származó 4000 adatpontra Pl. hidrogén és CO égési mechanizmusa 8

Hidrogén égése "A hidrogén oxidációja a legalaposabban tanulmányozott oxidációs folyamat, melynek mechanizmusa részleteiben is ismertnek mondható. " A. B. Nalbandjan V. V. Vojevodszkij A hidrogén oxidációjának és égésének mechanizmusa Akadémiai Kiadó, Budapest, 1953 eredeti: Izd. Akad. Nauk. , Moszkva, Leningrád, 1949 Néhány évente új reakciómechanizmus: Ó Conaire et al. (Galway, 2004) Konnov (Lund, 2008) Hong et al. (Stanford, 2011) Burke et al. (Princeton, 2012) Miért fontos? "A jövő üzemanyaga" ("hidrogéngazdaság") ma is használt üzemanyag (hordozórakéták) ipari biztonság (H 2 fejlődés nukleáris erőműben, Fukusima) szénhidrogének égésének központi reakciói

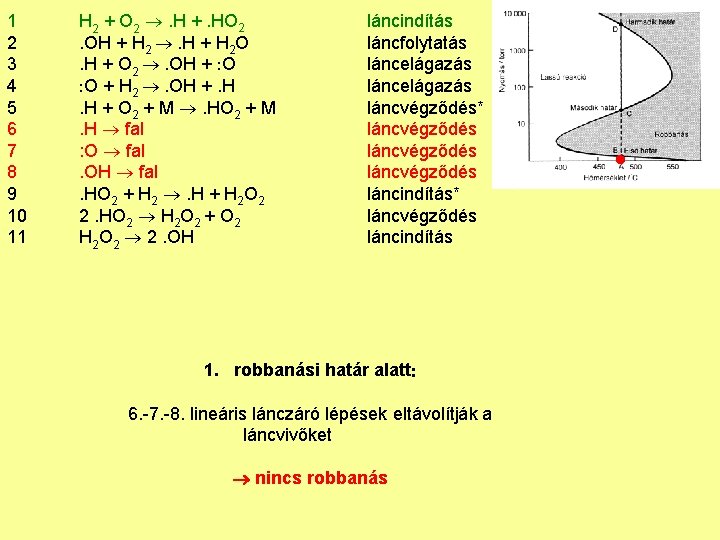
1 2 3 4 5 6 7 8 9 10 11 H 2 + O 2 . H +. HO 2. OH + H 2 . H + H 2 O. H + O 2 . OH + O O + H 2 . OH +. H. H + O 2 + M . HO 2 + M. H fal : O fal. OH fal. HO 2 + H 2 . H + H 2 O 2 2. HO 2 H 2 O 2 + O 2 H 2 O 2 2. OH láncindítás láncfolytatás láncelágazás láncvégződés* láncvégződés láncindítás* láncvégződés láncindítás 1. robbanási határ alatt 6. -7. -8. lineáris lánczáró lépések eltávolítják a láncvivőket nincs robbanás

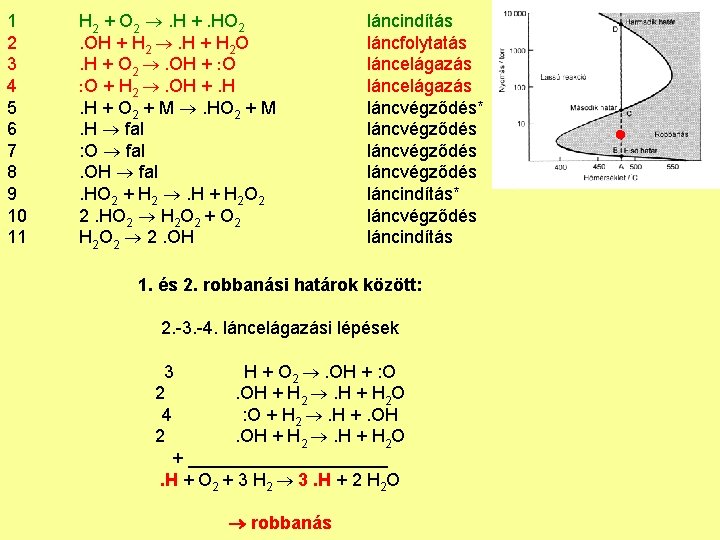
1 2 3 4 5 6 7 8 9 10 11 H 2 + O 2 . H +. HO 2. OH + H 2 . H + H 2 O. H + O 2 . OH + O O + H 2 . OH +. H. H + O 2 + M . HO 2 + M. H fal : O fal. OH fal. HO 2 + H 2 . H + H 2 O 2 2. HO 2 H 2 O 2 + O 2 H 2 O 2 2. OH láncindítás láncfolytatás láncelágazás láncvégződés* láncvégződés láncindítás* láncvégződés láncindítás 1. és 2. robbanási határok között: 2. -3. -4. láncelágazási lépések 3 H + O 2 . OH + : O 2. OH + H 2 . H + H 2 O 4 : O + H 2 . H +. OH 2. OH + H 2 . H + H 2 O + __________. H + O 2 + 3 H 2 3. H + 2 H 2 O robbanás

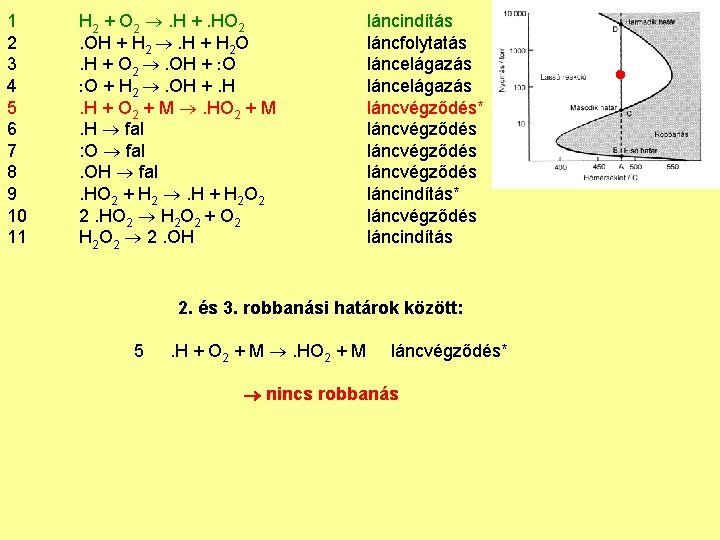
1 2 3 4 5 6 7 8 9 10 11 H 2 + O 2 . H +. HO 2. OH + H 2 . H + H 2 O. H + O 2 . OH + O O + H 2 . OH +. H. H + O 2 + M . HO 2 + M. H fal : O fal. OH fal. HO 2 + H 2 . H + H 2 O 2 2. HO 2 H 2 O 2 + O 2 H 2 O 2 2. OH láncindítás láncfolytatás láncelágazás láncvégződés* láncvégződés láncindítás* láncvégződés láncindítás 2. és 3. robbanási határok között: 5 . H + O 2 + M . HO 2 + M láncvégződés* nincs robbanás

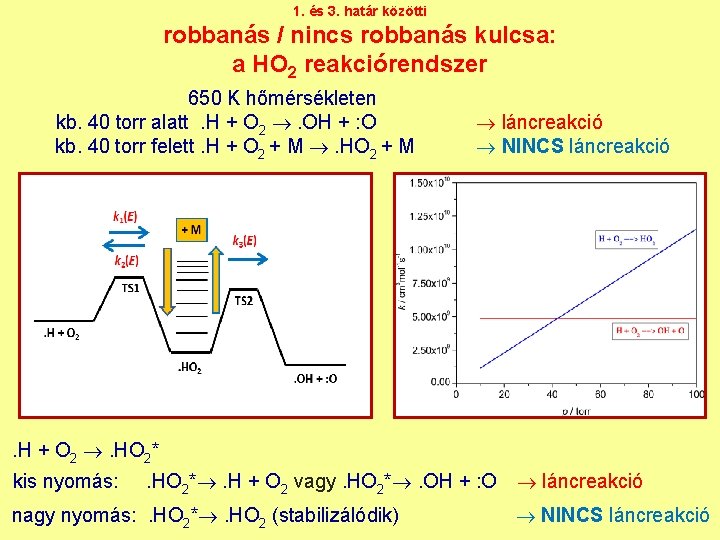
1. és 3. határ közötti robbanás / nincs robbanás kulcsa: a HO 2 reakciórendszer 650 K hőmérsékleten kb. 40 torr alatt. H + O 2 . OH + : O kb. 40 torr felett. H + O 2 + M . HO 2 + M láncreakció NINCS láncreakció . H + O 2 . HO 2* kis nyomás: . HO 2* . H + O 2 vagy. HO 2* . OH + : O nagy nyomás: . HO 2* . HO 2 (stabilizálódik) láncreakció NINCS láncreakció

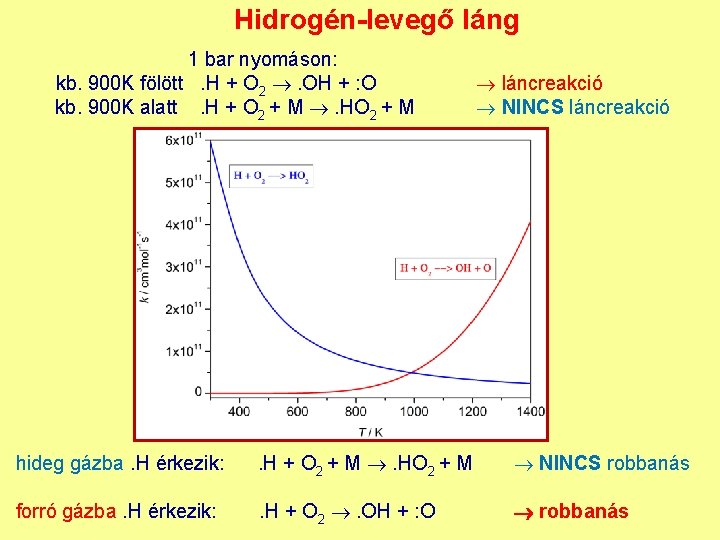
Hidrogén-levegő láng 1 bar nyomáson: kb. 900 K fölött. H + O 2 . OH + : O kb. 900 K alatt. H + O 2 + M . HO 2 + M láncreakció NINCS láncreakció hideg gázba. H érkezik: . H + O 2 + M . HO 2 + M NINCS robbanás forró gázba. H érkezik: . H + O 2 . OH + : O robbanás

láng terjedése hideg gázba. H érkezik: forró gázba. H érkezik: . H + O 2 + M . HO 2 + M. H + O 2 . OH + : O NINCS robbanás

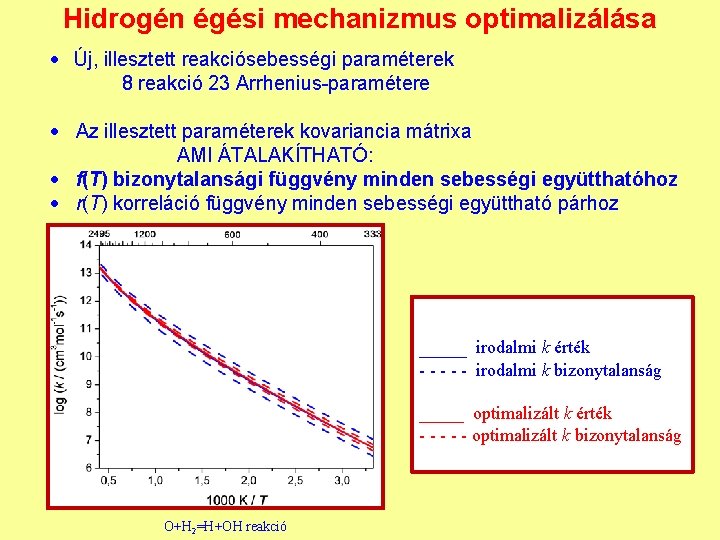
Hidrogén égési mechanizmus optimalizálása Új, illesztett reakciósebességi paraméterek 8 reakció 23 Arrhenius-paramétere Az illesztett paraméterek kovariancia mátrixa AMI ÁTALAKÍTHATÓ: f(T) bizonytalansági függvény minden sebességi együtthatóhoz r(T) korreláció függvény minden sebességi együttható párhoz ____ irodalmi k érték - - - irodalmi k bizonytalanság _____ optimalizált k érték - - - optimalizált k bizonytalanság O+H 2=H+OH reakció

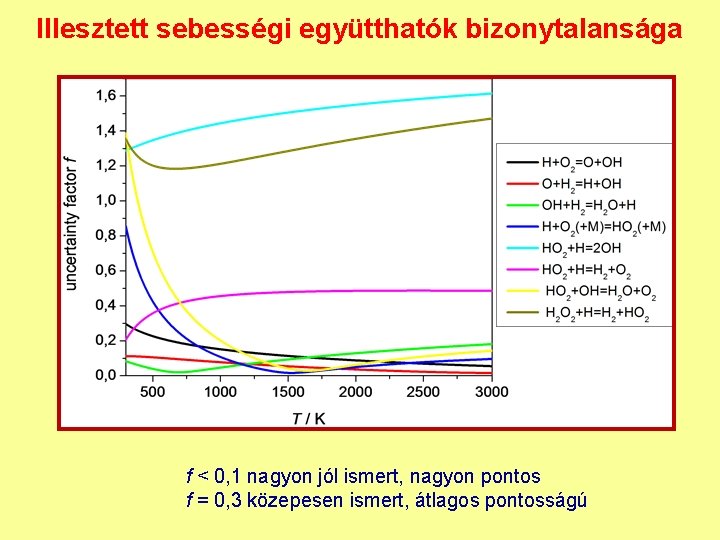
Illesztett sebességi együtthatók bizonytalansága f < 0, 1 nagyon jól ismert, nagyon pontos f = 0, 3 közepesen ismert, átlagos pontosságú

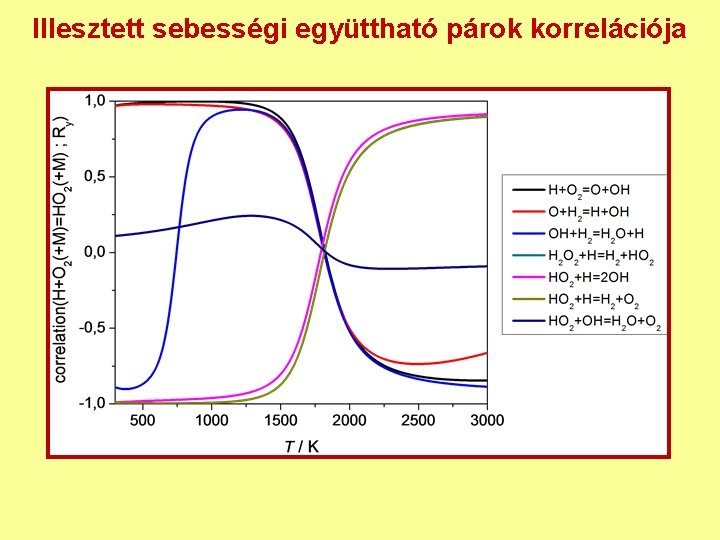
Illesztett sebességi együttható párok korrelációja

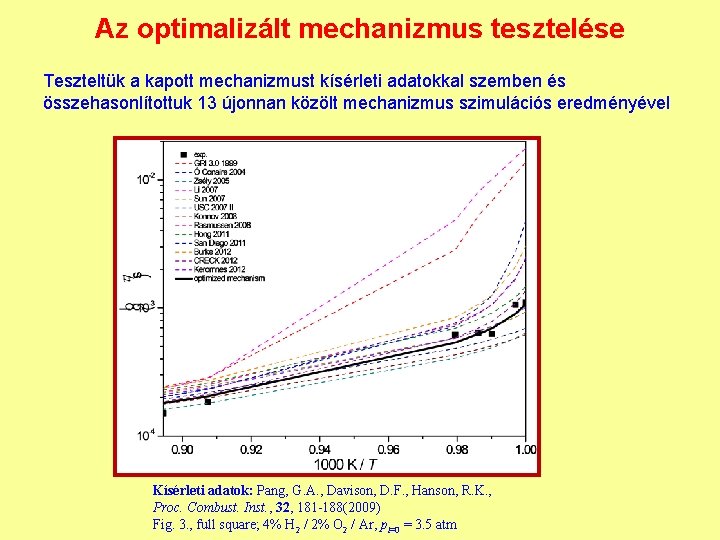
Az optimalizált mechanizmus tesztelése Teszteltük a kapott mechanizmust kísérleti adatokkal szemben és összehasonlítottuk 13 újonnan közölt mechanizmus szimulációs eredményével Kísérleti adatok: Pang, G. A. , Davison, D. F. , Hanson, R. K. , Proc. Combust. Inst. , 32, 181 -188(2009) Fig. 3. , full square; 4% H 2 / 2% O 2 / Ar, pt=0 = 3. 5 atm

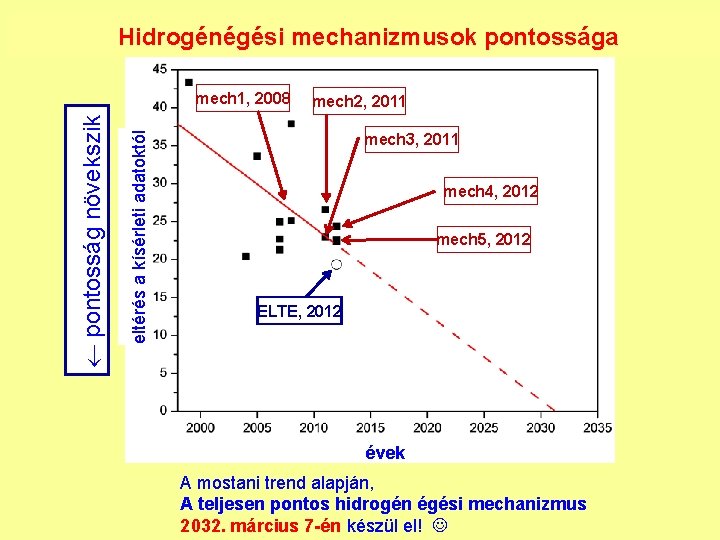
Hidrogénégési mechanizmusok pontossága eltérés a kísérleti adatoktól pontosság növekszik mech 1, 2008 mech 2, 2011 mech 3, 2011 mech 4, 2012 mech 5, 2012 ELTE, 2012 évek A mostani trend alapján, A teljesen pontos hidrogén égési mechanizmus 2032. március 7 -én készül el!

Metanol égése Mi lesz, ha elfogy a kőolaj? - nem fog elfogyni, csak egyre drágább lesz (exponenciálisan növekszik majd az ára) - továbbra is lesz igény egyéni/családi autózásra - bioüzemanyag: jelenleg konkurrál az élelmiszertermeléssel - az egyik alternatíva: földgázból/szénből/CO 2 -ből nagyüzemileg előállított metanol tankolása Oláh György: Kőolaj és földgáz után: A metanolgazdaság Better kiadó, Budapest, 2007 A metanol az egyik alapvető üzemanyag, de nincsen az égésének leírására jó reakciómechanizmus „mechanizmus kis nyomásokhoz” „mechanizmus nagy nyomásokhoz”

TDK témák 1. Metanol égési mechanizmus fejlesztése a) A mostani mechanizmusok mindegyike leírja a kísérleti adatok egy-egy részét. Olyan mechanizmust készíteni, amely minden kísérleti adatot jól leír. b) Állítás: a mérési adatokkal való (nem) egyezésből kimutatható, hogy mely sebességi együtthatók rosszak. Működik-e ez az ötlet? 2. Szimulációs eredmények bizonytalansága Eddig: Mostmár: Önkényes becslés a sebességi együtthatók bizonytalanságára, mindegyikre külön Számítjuk a sebességi paraméterek bizonytalanságát és azok korrelációját Hogyan csökken a szimulációs eredmények bizonytalansága, ha pontosan ismerjük a legfontosabb paraméterek bizonytalanságát?

TDK témák 2. 3. Hidrogén-orgona Hidrogénláng üvegcsőben búgó hangot ad (Jalsovszky István XIX. századi kísérletei) kísérletezés: - működik-e földgáz lánggal is? - hogyan függ a hangmagasság a körülményektől? számítások: modellel reprodukálni a jelenséget - csőreaktor-modell elegendő-e? - orgonasíp-modell módosítása, mechanikai gerjesztés helyett kémiai gerjesztés?

Specik: két egymást követő szombaton 8: 00 -16: 00 A lángok kémiája és fizikája minden tanév tavaszi félévében kb. 60 résztvevő, főleg 1. és 2. éves BSc-sek égéskémia és gázkinetikai mérési módszerek erősen mesés http: //garfield. chem. elte. hu/Turanyi/oktatas/langok_speci. html Reakciómechanizmusok vizsgálata minden tanév őszi félévében kb. 6 résztvevő, főleg MSc-sek és Doktori Iskolások dinamikai modellek vizsgálata, mechanizmusredukció sok matek (bár inkább kvalitatív/verbális matek) kellenek hozzá biztos matek alapok http: //garfield. chem. elte. hu/Turanyi/oktatas/reakciomech_speci. html

expozíció: 0, 2 mp expozíció : 2, 5 mp Köszönöm a figyelmet !
 Tams mc 2
Tams mc 2 What is tams
What is tams Kapiláris
Kapiláris Texasassessment management system
Texasassessment management system Napa prolonk
Napa prolonk Tams spend a day
Tams spend a day Elte ttk szakdolgozat
Elte ttk szakdolgozat A modern fizika születése
A modern fizika születése Algoritmusok és adatszerkezetek elte
Algoritmusok és adatszerkezetek elte Fajlagos töltés
Fajlagos töltés Qter elte tanév rendje
Qter elte tanév rendje Horváth ákos elte
Horváth ákos elte Elte merkur
Elte merkur Ppk elte
Ppk elte Branyi elte
Branyi elte Illés zoltán elte
Illés zoltán elte Gyógypedagógus képzés diplomásoknak
Gyógypedagógus képzés diplomásoknak Elte ik térkép
Elte ik térkép Elte btk romanisztikai intézet
Elte btk romanisztikai intézet Menedzsment és vállalkozásgazdaságtan bme
Menedzsment és vállalkozásgazdaságtan bme Elte ik hkr
Elte ik hkr Raátz judit elte
Raátz judit elte Elte gti
Elte gti Információs forradalom
Információs forradalom Vbk moodle
Vbk moodle Tier 1 isp
Tier 1 isp

















































