Grunnstoffene og periodesystemet Grunnstoff og det periodiske systemet



















- Slides: 24

Grunnstoffene og periodesystemet

Grunnstoff og det periodiske systemet Mål: • Kunne forklare hva et grunnstoff er, og kunne gi minst 3 eksempler. • Kunne forklare forskjellen på et grunnstoff og en kjemisk forbindelse. • Kunne klassifisere grunnstoffer i metaller, halvmetaller og ikke-metaller. • Kunne bruke det periodiske system til å si noe om et grunnstoffs egenskaper og reaksjoner.

Grunnstoff Et stoff er enten et grunnstoff eller en kjemisk forbindelse • Et grunnstoff består av bare • Grunnstoffet klor èn atomtype. – Brukes om både kloratomer – Mer enn 100 grunnstoffer – Ordnet på ulik måte • Kjemiske formelen – Viser om et stoff er et grunnstoff – Grunnstoff = ett atomsymbol, eks. H eller Cl 2 – Kjemisk forbindelse = to eller flere atomsymboler, eks. C 6 H 12 O 6 (druesukker) (Cl) og klormolekyler (Cl 2) og klorgass • Grunnstoffer i naturen – Eks. kobber, gull, titan, svovel kjent siden forhistorisk tid – Radium kjent i ca. 100 år – Mulig fremstille nye stoffer på kunstig måte = FUSJON – Alle grunnstoffer etter uran (nr. 92) er kunstige. – 90 av grunnstoffene finnes i periodesystemet.

Grunnstoffenes plass i periodesystemet • Alle atomsymbolene finner vi i periodesystemet. – Husk å skille mellom stor og liten bokstav – Alltid stor forbokstav • Bestemt plass – hvorfor? – Klassifisere grunnstoffene – Mendelejev, periodesystemets far (1869) • Hva avgjør plasseringen? – Antall protoner i atomkjernen = atomnummeret – Grunnstoffets kjemiske egenskaper – Eks. felles egenskaper, reagerer likt med vann andre stoffer (Li og Na) – Se på periodesystemet i boka deres. Gjør oppg. 1 -8 s. 28

Klassifisering av grunnstoffer • Metaller – De fleste grunnstoffer er metaller – Til venstre(etter «trappa» ) og midt i periodesystemet • Halv-metaller • Ikke-metaller – Til høyre i periodesystemet – Kun 22 ikke-metaller pr. i dag • Faste stoffer, væsker eller gasser – Noen felles egenskaper med både metallene og ikkemetallene – Sammenlign figur s. 13 og omslaget i boka. – Hvilke stoffer er halvmetaller? Gjør oppg. 9 -11 s. 20 • – Ved romtemperatur og vanlig trykk – De fleste grunnstoffer er faste stoffer – Væske: kvikksølv (Hg: metall) og brom (Br: ikke-metall) – Elleve grunnstoffer er gasser – de fleste ikke-metall Finn ut hvilke stoffer som er gasser (se s. 13)

Klassifisering av grunnstoffer Metall Ikke-metall Kobber Sink Titan Faste stoffer (unntak kvikksølv) De fleste er gasser Gode ledere av elektrisk strøm Svært dårlige ledere av elektrisk strøm (unntak grafitt) Leder varme godt Isolerer godt Skinnende overflate Ikke skinnende overflate Kan bankes flat og trekkes ut i tynne tråder Sprøtt og blir knust hvis det er fast stoff Klinger, spesiell lyd Ingen klang Høy tetthet Lav tetthet Høyt smeltepunkt Lavt smeltepunkt De fleste reagerer og det danne H 2 -gass med sur løsning Reagerer ikke med sur løsning Klorgass Oksygengass Svovel

Skallmodellen og atomer Mål • Kunne forklare hvordan skallmodellen er en fremstilling av et atom. • Kunne forklare forskjellen på proton og elektron, og hvor disse finnes i et atom. • Kunne forklare hva et ion er, og hvordan ioner kan ha forskjellig ladning.

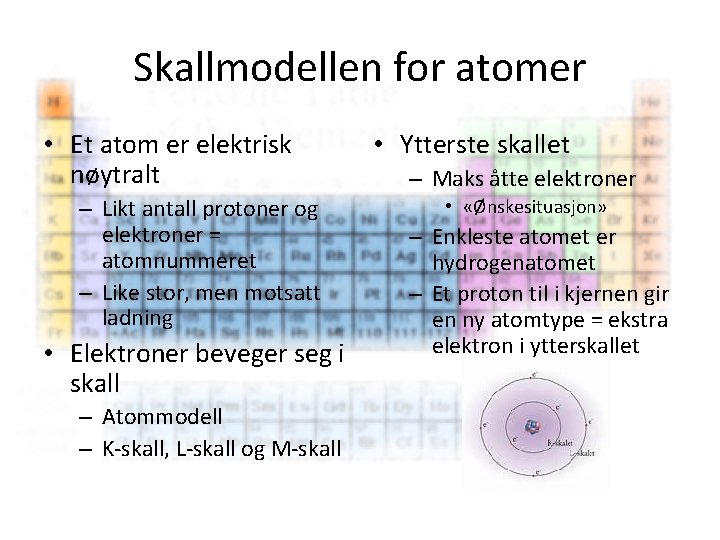
Skallmodellen for atomer • Et atom er elektrisk nøytralt – Likt antall protoner og elektroner = atomnummeret – Like stor, men motsatt ladning • Elektroner beveger seg i skall – Atommodell – K-skall, L-skall og M-skall • Ytterste skallet – Maks åtte elektroner • «Ønskesituasjon» – Enkleste atomet er hydrogenatomet – Et proton til i kjernen gir en ny atomtype = ekstra elektron i ytterskallet

Skallmodellen for atomer • Regler for plassering av elektroner i skall: – Elektronskallet nærmest kjernen (K-skallet) fylles først og inneholder bare to elektroner. – Elektronskall nr. 2 (Lskallet) kan ha åtte elektroner. – Aldri mer enn åtte elektroner i det ytterste skallet. Oppg. 12 -15 s. 29 • Atomets åtteregel: • Skaffer seg åtte ytterelektroner på tre forskjellige måter: – Gi bort elektroner – Motta elektroner – Dele elektroner med andre atomer. • Gjelder ikke hydrogenatomet og heliumatomet.

Periodesystemets oppbygning Mål • Kunne forklare hvordan det periodiske systemet er bygd opp ved hjelp av periode og gruppe. • Kunne fortelle om et grunnstoffs oppbygning ved hjelp av det periodiske system. • Kjenne til at noen hovedgrupper har egne navn, og vite navnet på 4 av disse.

Perioder og grupper i periodesystemet • Perioder – Vannrette radene – Sju perioder – Nr. på perioden er likt antall skall i atomet – Jo flere elektronskall det er i et atom, jo lettere avgis det elektroner i det ytterste skallet ved kjemiske reaksjoner Oppgave: Vi tegner atomer ved bruk av skallmodellen + oppg. 16 -20 s. 29 • Grupper – Loddrette kolonnene – Gruppe 1, 2 og 13 -18 = hovedgrupper – Atomer i samme gruppe har like mange elektroner i det ytterste skallet – Reagerer ganske likt i kjemiske reaksjoner – Nr. på hovedgruppen = antall elektroner i ytterskallet (siste siffer)

Noen hovedgrupper • Hovedgruppe 1 og 2 – «ALKALI» (basisk) i navnet – Metallene danner basiske løsninger i reaksjon med vann • Hovedgruppe 1: alkalimetallene (- hydrogen) • Avgir lett elektroner pga. ett elektron i ytterste skall • Reagerer kraftig med stoffer som vann • Hovedgruppe 2: jordalkalimetallene • Reagerer langsommere enn alkalimetallene pga. to elektroner i ytterste skall

Noen hovedgrupper • Hovedgruppe 17: Halogener – Betyr «saltdanner» – Sju elektroner i det ytterste skallet – Inngår i kjemiske forbindelser – Eks. : Klor, fluor og jod reagerer lett med andre stoffer • • Koksalt (Na. Cl) Tannkrem (natriumfluorid) Klorin (natriumhypokloritt) Saltsyre (hydrogenklorid) Oppg. 21 -22 s. 30 • Hovedgruppe 18: Edelgasser Oppfyller åtteregelen Unntak: Helium Består av enkeltatomer Reagerer vanligvis ikke med andre stoffer – Danner ikke molekyler eller ioner – –

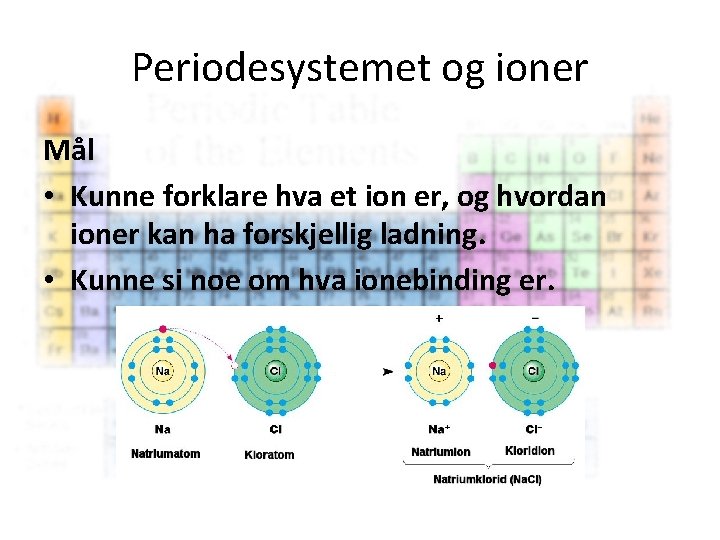
Periodesystemet og ioner Mål • Kunne forklare hva et ion er, og hvordan ioner kan ha forskjellig ladning. • Kunne si noe om hva ionebinding er.

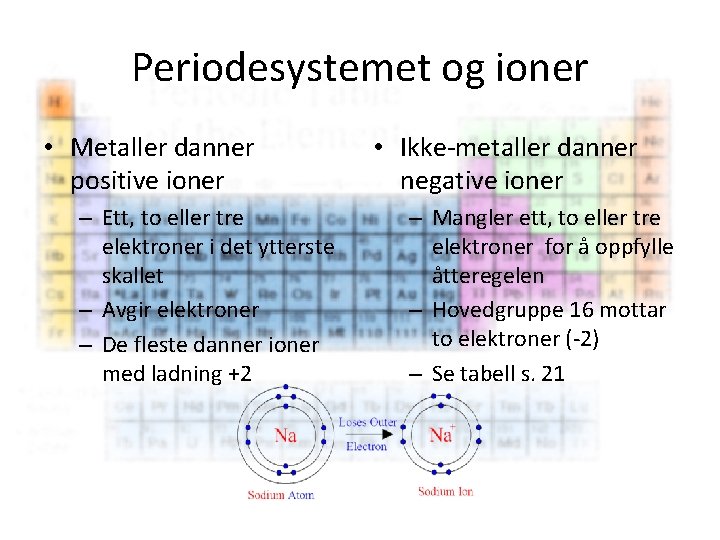
Periodesystemet og ioner • Ion – Et ion (gresk: ἰόν, «en som går» ) er et elektrisk ladd atom – Avgir eller mottar elektroner – Antall elektroner i det ytterste skallet bestemmer hva slags ion som dannes Se s. 20 – Tegn og forklar • Et positivt ladd ion, kation, oppstår når et atom har underskudd på elektroner. • Et negativt ladd ion, anion, oppstår når et atom har overskudd på elektroner.

Periodesystemet og ioner • Metaller danner positive ioner – Ett, to eller tre elektroner i det ytterste skallet – Avgir elektroner – De fleste danner ioner med ladning +2 • Ikke-metaller danner negative ioner – Mangler ett, to eller tre elektroner for å oppfylle åtteregelen – Hovedgruppe 16 mottar to elektroner (-2) – Se tabell s. 21

Periodesystemet og ioner • Ioner med motsatte ladninger tiltrekker hverandre og kan danne ionebindinger. • Det som skjer når to atomer inngår en ionebinding er at det ene atomet tar opp et eller flere elektroner ifra det andre atomet, slik at begge atomene får oppfylt åtteregelen (oktettregelen) • http: //naturfag. info/4 fenomener/fig_ac/koksalt. swf

Periodesystemet og ioner

Mer om metaller Mål • Vite at det er sammenheng mellom oppbygning og egenskaper for metaller. • Kunne forklare hvorfor metaller er gode ledere av elektrisk strøm. • Kunne forklare hvorfor metaller har høy smeltetemperatur. • Vite hvor i det periodiske system metallene er. • Kunne si noe om hva metallbinding er.

Mer om metaller • Like atomer danner et regelmessig mønster – Faste plasser og vibrerer • Kan formes • Leder elektrisk strøm og varme – Metall er bygd opp av positive metallioner (moderatomet) med en «sjø» av elektroner (-) – Gode ledere pga. «elektronsjøen» • Metallbinding – Tiltrekningen mellom de positive og negative ionene • Høyt smeltepunkt – Sterk tiltrekningskraft mellom de positive metallionene og elektronsjøen – Mye varmeenergi slik at ionene beveger seg og forlater sine faste plasser – Ulikt smeltepunkt for ulike metaller

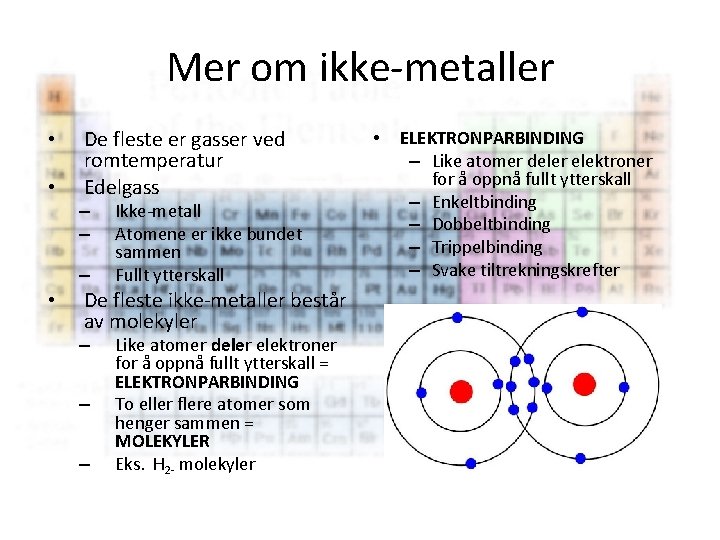
Mer om ikke-metaller Mål • Vite at de fleste grunnstoffene av ikke-metaller er gasser ved romtemperatur og vanlig trykk. • Vite hvor i det periodiske system ikke -metallene finnes. • Kunne forklare hva en edelgass er, hvordan den er bygd opp og egenskaper ved den. • Kunne gi tre eksempler på edelgasser. • Kunne si noe om elektronparbinding.

Mer om ikke-metaller • • De fleste er gasser ved romtemperatur Edelgass – – – • Ikke-metall Atomene er ikke bundet sammen Fullt ytterskall De fleste ikke-metaller består av molekyler – – – Like atomer deler elektroner for å oppnå fullt ytterskall = ELEKTRONPARBINDING To eller flere atomer som henger sammen = MOLEKYLER Eks. H 2 - molekyler • ELEKTRONPARBINDING – Like atomer deler elektroner for å oppnå fullt ytterskall – Enkeltbinding – Dobbeltbinding – Trippelbinding – Svake tiltrekningskrefter

Grunnstoffet karbon • Ulike former – – – Diamant Grafitt Fulleren-60 • Diamant – – – Består av bare karbonatomer Lik avstand mellom catomene Fire enkeltbindinger med naboatomer = nettverk Et av de hardeste stoffene som finnes Dannet i kraterrør i vulkaner Kan også fremstilles av grafitt ved høy temperatur og trykk

Grunnstoffet karbon • Ulike former – Diamant – Grafitt – Fulleren-60 • Grafitt – – – – Et av de bløteste stoffene som finnes Kan brukes som smøremiddel Atomene ligger lagvis som kan forskyves Svak tiltrekningskraft mellom lagene Seks karbonatomer bundet sammen med enkeltbindinger Blyet i blyanter Leder elektrisk strøm pga. frie elektroner mellom lagene
 9 klasse pensum
9 klasse pensum Hvor i det periodiske system står atomer med 5 skaller?
Hvor i det periodiske system står atomer med 5 skaller? Hovedgrupper i det periodiske system
Hovedgrupper i det periodiske system Natrium periodesystemet
Natrium periodesystemet Periodesystemet sang
Periodesystemet sang Grunnstoffenes periodiske system
Grunnstoffenes periodiske system Oxidationstal definition
Oxidationstal definition Det beskrivende kulturbegreb
Det beskrivende kulturbegreb Det finns bara en gud och det är allah
Det finns bara en gud och det är allah Www 1177
Www 1177 Grupp 1 periodiska systemet
Grupp 1 periodiska systemet Grupp periodiska systemet
Grupp periodiska systemet Supanova fettförbränning
Supanova fettförbränning Tillhör borgruppen
Tillhör borgruppen Systemet karlskoga
Systemet karlskoga Ia systemet
Ia systemet Landskapsgrundämne
Landskapsgrundämne Strukturelt perspektiv
Strukturelt perspektiv Kritik mot kognitiva perspektivet
Kritik mot kognitiva perspektivet Organisationsstruktur typer
Organisationsstruktur typer Stjernehimlen amager
Stjernehimlen amager Det moderna genombrottet
Det moderna genombrottet Matrix cofactor
Matrix cofactor Gamle hellas
Gamle hellas Anthony giddens teori
Anthony giddens teori