Experimentalvortrag Reaktionen mit elementarem Natrium AnnaLena Eicke Mittwoch






































- Slides: 41

Experimentalvortrag Reaktionen mit elementarem Natrium Anna-Lena Eicke Mittwoch, 08. 07. 09, 9 Uhr Marburg

Gliederung 1. Natriumvorkommen und Entdeckung Versuch 1 2. Industrielle Herstellung 3. Eigenschaften Demonstration 1, Versuche 2, 3, 4 und 5 4. Wichtige Natriumverbindungen Demonstration 2 5. Verwendung 6. Schulrelevanz 7. Literatur- und Abbildungsverzeichnis 2

1. Natriumvorkommen • Sechst-häufigstes Element in der Erdkruste • Lagerstätte • • Steinsalz: Na. Cl (auch im Meerwasser) Soda: Na 2 CO 3 Chilesalpeter: Na. NO 3 Glaubersalz: Na 2 SO 4 • Natriummineralien • Albit/Natronfeldspat: Na[Al. Si 3 O 8] 3

Entdeckung des elementaren Natriums • 1737 stellte du Monceau fest, dass Kochsalz, Glaubersalz und Soda eine gemeinsame Basis haben • 1806 elektrolysierte Humphrey Davy wasserfreie Schmelzen der Alkalisalze • Namensgebung: „sodium“ wurde mit „Natronium“ übersetzt, woraus schließlich „Natrium“ wurde Abb. 1: Sir Humphrey Davy 4

Versuch 1: Darstellung von Natrium -Elektrolyse von geschmolzenem Natriumhydroxid-

Versuch 1: Synthese von elementarem Natrium -2 +1 Anode: +1 0 0 Kathode: Gesamt: +1 -2 +1 0 +1 -2 0 Das entstehende Natrium wird zum einen durch das entstehende Wasser oxidiert, zum anderen zündet es sich aufgrund der hohen Temperaturen selbst. 6

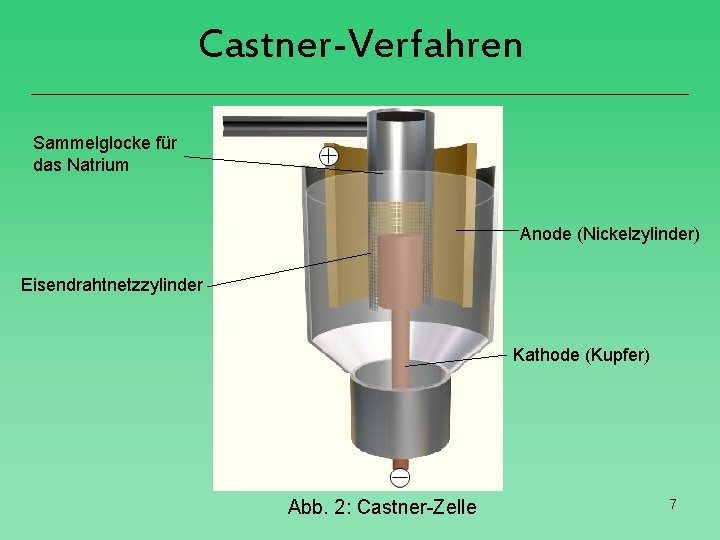
Castner-Verfahren Sammelglocke für das Natrium Anode (Nickelzylinder) Eisendrahtnetzzylinder Kathode (Kupfer) Abb. 2: Castner-Zelle 7

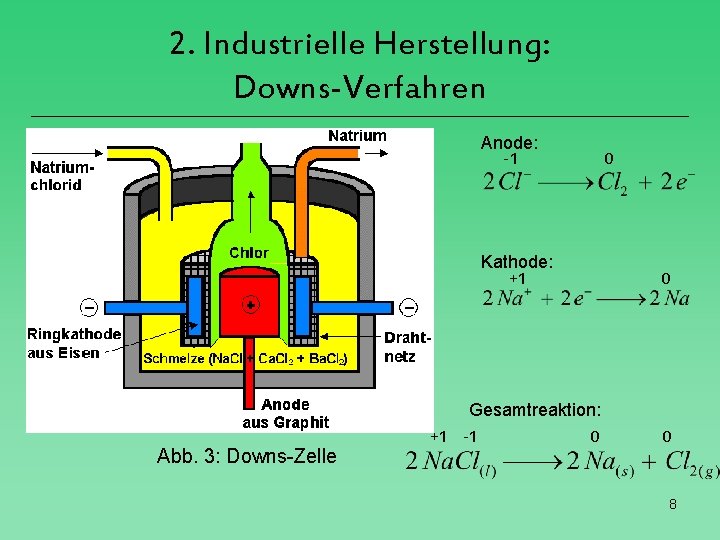
2. Industrielle Herstellung: Downs-Verfahren Anode: -1 Abb. 3: Downs-Zelle 0 Kathode: +1 0 Gesamtreaktion: +1 -1 0 0 8

3. Eigenschaften des Natriums • 1. Hauptgruppe: Alkalimetall relative Atommasse in g/mol Oxidationszahl Dichte in g/cm 3 bei 20 °C Ordnungszahl Elektronegativität Schmelzpunkt in °C 9

Physikalische Eigenschaften • weiches Metall mit geringer Dichte • großer Atomradius • niedrige Schmelz- und Siedepunkte (Smp. 97, 8 °C, Sdp. 881, 3 °C) • elektrisch und thermisch leitfähig 10

Demonstration 1 Natrium schneiden & Autoxidation

Demonstration 1: Natrium schneiden & Autooxidation • frisch geschnittenes Natrium ist blank und silbern • nach kurzer Zeit an (feuchter) Luft, läuft es weiß an: Bildung einer Oxid- bzw. Hydroxidschicht 0 0 0 +1 -2 +1 0 12

Versuch 2 Reaktion von Natrium in Wasser und Ethanol

Versuch 2: Reaktion von Natrium in Wasser und Ethanol Reaktion von Natrium in Wasser 1. 0 +1 -2 +1 0 14

Versuch 2: Reaktion von Natrium in Wasser und Ethanol Reaktion von Natriumhydroxid mit Luminol 2. 15

Versuch 2: Reaktion von Natrium in Wasser und Ethanol Reaktion von Natrium in Wasser 0 +1 -2 +1 0 Reaktion von Natrium in Ethanol -2 +1 0 Natrium wird in Petroleum oder Paraffinöl aufbewahrt, weil diese nur aus Kohlenwasserstoffen bestehen und relativ reaktionsträge sind 16

Versuch 3 Löslichkeit von Natrium in flüssigem Ammoniak

Versuch 3: Löslichkeit von Natrium in flüssigem Ammoniak Abb. 4: Kondensieren von gasförmigen Ammoniak 18

Versuch 3: Löslichkeit von Natrium in flüssigem Ammoniak 0 +1 • Bildung von solvatisierten Metallkationen und Elektronen • die solvatisierten Elektronen sind – in geringer Konzentration für die blaue Farbe – in hoher Konzentration für die metallisch-bronzene Färbung verantwortlich 19

Versuch 3: Löslichkeit von Natrium in flüssigem Ammoniak • mit steigender Natriumkonzentration bilden sich außerdem: – Ionenpaare – Anionen – Dimere 20

Versuch 4 Verbrennung von Natrium

Versuch 4: Verbrennung von Natrium Hauptprodukt ist Natriumperoxid: 0 0 +1 -1 Nebenprodukt ist Natriumoxid 0 0 +1 -2 Abb. 5: Verbrennung von Natrium 22

Natrium-D-Linie • zwei Spektrallinien (589 und 589, 6 nm) • Übergang des äußeren Elektrons aus dem angeregten 3 p-Zustand in den 3 s-Grundzustand • zwei 3 p-Zustände, bedingt durch die Spin-Bahn. Kopplung des Elektronenspins mit dem Bahndrehimpuls: Gesamtdrehimpuls von 1/2 und 3/2 Abb. 6: Spektrallinien von Natrium 23

Versuch 5 Reaktion von Natrium mit Wasserstoffperoxid

Versuch 5: Reaktion von Natrium mit Wasserstoffperoxid 0 +1 -1 +1 0 -1 +1 -2 +1 +1 -2 0 • wegen der geringeren Dichte schwimmt das Natrium auf dem Wasserstoffperoxid Entzündung • Chemolumineszenz beruht wahrscheinlich auf der Bildung von Natrium-Suboxiden 25

4. Wichtige Natriumverbindungen • Natriumchlorid (Demonstration 2) • Natriumhydroxid • Natrium kommt in vielen Verbindungen als Kation vor und beeinflusst die physikalischen Eigenschaften dieser 26

Demonstration 2 Synthese von Natriumchlorid aus den Elementen

Abb. 7: Versuchsaufbau für die Synthese von Natriumchlorid aus den Elementen 28

Video: Synthese von Natriumchlorid aus den Elementen 29

Abb. 8: Versuchsergebnis im Überblick Abb. 9: Versuchsergebnis im Glühröhrchen 30

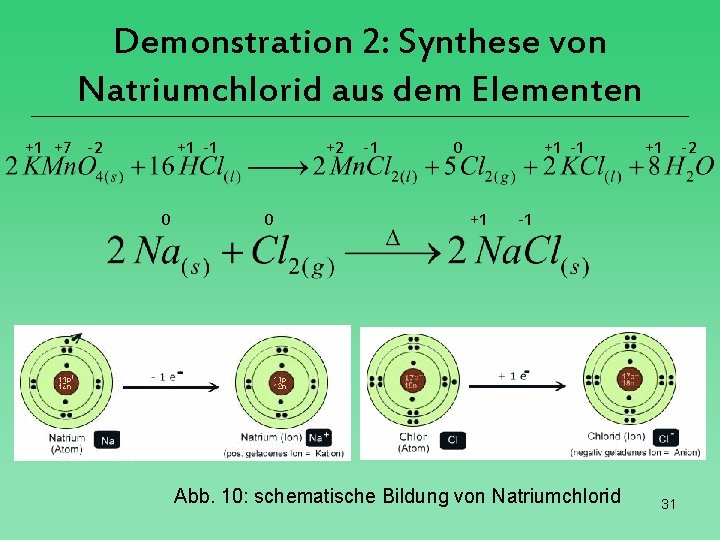
Demonstration 2: Synthese von Natriumchlorid aus dem Elementen +1 +7 -2 +1 -1 0 +2 0 -1 0 +1 -1 +1 +1 -1 Abb. 10: schematische Bildung von Natriumchlorid 31 -2

Physiologische Bedeutung • Körperbestand: 1, 4 g/kg Körpergewicht • Bedarf: < 0, 5 g/Tag • Überversorgung: Ödeme, Bluthochdruck • Hauptfunktion: Aufrechterhaltung des osmotischen Drucks im extrazellulären Raum • Vorkommen: Fleisch und Wurst 32

5. Verwendung Herstellung von Antiklopfmittel • mehr als die Hälfte des erzeugten Natriums wurde 1991 für die Herstellung von Tetraethyl- und Tetramethylblei verbraucht • Verschmelzung von Blei und Natrium zu einer Legierung, die mit Ethyl- bzw. Methylchlorid umgesetzt wird: 33

Herstellung von elektropositiven Metallen • Natrium wird als Reduktionsmittel zur Herstellung von elektropositiven Metalle wie z. B. Titan verwand • Schutzgasatmosphäre, damit Ti. Cl 4 nicht hydrolysiert und Natrium nicht mit dem Luftsauerstoff reagiert • Elektrolyse in einem. Temperaturbereich von 801 °C – 881 °C „Hunter“-Verfahren +4 -1 0 0 +1 -1 34

Natrium-Schwefel-Batterie 0 0 +1 -x Abb. 11: Na/S-Batterie • 50 – 100 dieser Zellen sind in luftdichten Edelstahlbehältern zu sekundären Natrium-Schwefel. Akkummulatoren zusammengefasst • spendet 3 mal mehr Energie pro Gewichtseinheit als ein Bleiakkumulator, muss allerdings erst auf 35 Betriebstemperatur (350 °C) gebracht werden

Natriumdampf-Entladungslampen • in den Lampenkolben wird Natrium eingeschmolzen, welches zu Beginn der Entladung verdampft Ionisation • die bei einem Zusammenstoß von zwei Elektronen auftretende Energie wird in Form von Licht wieder Abb. 12: Natriumdampf-Lampe abgegeben 36

Natrium in der organischen Chemie • Birch-Reduktion von Cyclohexadienen über einen Ein-Elektronen -Übertragungsmechanismus • Zerstörung halogenorganischer Verunreinigungen organisch gebundenes Chlor verbindet sich mit Natrium zu Natriumchlorid, welches abgetrennt werden kann • in Form des Natrium-Drahtes als Trockenmittel 37

6. Schulrelevanz Klasse 8: Alkalimetalle • Kennenlernen der Eigenschaften und Verwendung der Metalle der Elementfamilie • Sicherheitsaspekte begründen und beachten • Chemische Reaktionen durchführen, vergleichen und deuten Klasse 10/12: Redoxreaktionen (Elektrolysen) bzw. Großtechnische Verfahren Abb. 13: Lehrer Hämpel 38

7. Literaturverzeichnis BKK Gesundheit, Nährstoffe – Mineralstoffe – Natrium, http: //www. bkkgesundheit. de/ratgeber/ernaehrung/naehrstoffe/inhalt. lass o? a=naehrstoffe 2 (letzter Zugriff: 22. 6. 09, 11: 07 Uhr) Brandl, H. , Versuche zur Chemolumineszenz mit Alkalimetallen, in Mathematisch-Naturwissenschaftlicher Unterricht 46/3, S. 168 - 172 Gerstner, E. , Skriptum zum Anorganisch-chemischen Praktikum für Lehramtskandidaten, 3. , teilweise neu bearbeitete und erweiterte Auflage, 1993, 1. unveränderter Nachdruck 2003, Marburg 1993/2003 Holleman, A. F. , Wiberg, E. und N. : Lehrbuch der anorganischen Chemie, 102. , stark umgearbeitete und verbesserte Auflage, Walter de Gruyter, Berlin 2007 Mortimer, C. , Basiswissen der Chemie, 8. komplett überarbeitete und erweiterte Auflage, Thieme-Verlag, Stuttgart, 2003 Praxis der Naturwissenschaften – Chemie 6/40, Themenheft Alkalimetalle, Aulis Verlag Deubner & Co KG, Köln, 1991 Riedel, E. , Anorganische Chemie, 6. Auflage, Walter de Gruyter, Berlin 2004 39

Abbildungsverzeichnis Abb. 1: Sir Humphrey Davy, http: //www. kjemi. uio. no/periodesystemet/vis. php? e=Cl&id=471 (letzter Zugriff: 21. 6. 09, 19: 44 Uhr) Abb. 2: Castner-Zelle, http: //www. chemgapedia. de/vsengine/popup/vsc/de/glossar/c/ca/castner_00045 verfahren. glos. ht ml (letzter Zugriff: 21. 6. 09, 19: 48 Uhr) Abb. 3: Downs-Zelle, http: //www. seilnacht. com/referate/elektro 1. htm (letzter Zugriff: 21. 6. 09, 19: 50 Uhr) Abb. 4: Kondensieren von gasförmigen Ammoniak, Anna-Lena Eicke Abb. 5: Verbrennung von Natrium, von Anna-Lena Eicke Abb. 6: Spektrallinien Natrium, http: //www. physikdidaktik. unikarlsruhe. de/software/hydrogenlab/Atomphysik/08_Stunde/Spektralanalyse/Spektrallinien. htm (letzter Zugriff: 21. 6. 09, 19: 52 Uhr) Abb. 7: Versuchsaufbau für die Synthese von Natriumchlorid aus den Elementen, von Anna-Lena Eicke Video: Synthese von Natriumchlorid aus den Elementen, von Anna-Lena Eicke Abb. 8: Versuchsergebnis im Überblick, von Anna-Lena Eicke Abb. 9: Versuchsergebnis im Glühröhrchen, von Anna-Lena Eicke Abb. 10: schematische Bildung von Natriumchlorid, http: //www. schulestudium. de/Chemie/Ionenbindung. html (letzter Zugriff: 21. 6. 09, 19: 54 Uhr) Abb. 11: Natrium-Schwefel-Batterie, Holleman, A. F. , Wiberg, E. und N. : Lehrbuch der anorganischen Chemie, 102. , stark umgearbeitete und verbesserte Auflage, Walter de Gruyter, Berlin 2007 Abb. 12, Natriumdampfentladungslampe, http: //www. chemische-experimente. com/Alkalimetalle. htm, (letzter Zugriff: 22. 6. 09, 11: 14 Uhr) Abb. 13: Lehrer Hämpel, http: //www. e-teachingaustria. at/02_cont/03 content/03_biologie/Haltung/index. htm (letzter Zugriff: 21. 6. 09, 19: 46 Uhr) 40

Vielen Dank für die Aufmerksamkeit! 41
 Winter kommt winter kommt flocken fallen nieder
Winter kommt winter kommt flocken fallen nieder Doppelt reziproke auftragung
Doppelt reziproke auftragung Benzolsulfonsäure mechanismus
Benzolsulfonsäure mechanismus Glühröhrchen
Glühröhrchen Natrium reagiert mit wasser reaktionsgleichung
Natrium reagiert mit wasser reaktionsgleichung Ergänze die sätze am montag und am mittwoch
Ergänze die sätze am montag und am mittwoch Annalena beck
Annalena beck Annalena koehler
Annalena koehler Anmäla arbetsskada lisa
Anmäla arbetsskada lisa Negotiation
Negotiation Celia koehler
Celia koehler Fungsi natrium karbonat
Fungsi natrium karbonat Koreksi hipernatremia
Koreksi hipernatremia Formula persamaan kimia
Formula persamaan kimia Natrium klorida asid atau alkali
Natrium klorida asid atau alkali Nátrium elektronhéjak száma
Nátrium elektronhéjak száma Mravenčan ethylnatý
Mravenčan ethylnatý Sebuah lampu natrium 20w berwarna kuning
Sebuah lampu natrium 20w berwarna kuning Cobalt(2+) ion
Cobalt(2+) ion Selesaikan reaksi berikut etanol + natrium
Selesaikan reaksi berikut etanol + natrium Natrium benzoat
Natrium benzoat Schalenmodell
Schalenmodell Kloramfenikol natrium suksinat
Kloramfenikol natrium suksinat Iwl bayi
Iwl bayi Tindak balas dalam pek sejuk
Tindak balas dalam pek sejuk Nyhl
Nyhl Nilai fungsi kerja sodium
Nilai fungsi kerja sodium Aufbau des natriumchloridkristalls
Aufbau des natriumchloridkristalls Száma az atom minőségét szabja meg
Száma az atom minőségét szabja meg Coca cola mit aroma bringt den opa auf die oma
Coca cola mit aroma bringt den opa auf die oma Modalverben tabelle pdf
Modalverben tabelle pdf Mit app inventor graph
Mit app inventor graph Feuerwehr knoten und stiche anleitung
Feuerwehr knoten und stiche anleitung Vincent chan mit
Vincent chan mit Was ist ein silbenkern
Was ist ein silbenkern Weihnachten in deutschland
Weihnachten in deutschland Bringen akkusativ oder dativ
Bringen akkusativ oder dativ Personalverrechnung beispiele mit lösung 2020
Personalverrechnung beispiele mit lösung 2020 Wie sieht mein traummann aus
Wie sieht mein traummann aus Schubspannung kreisquerschnitt
Schubspannung kreisquerschnitt Joseph ferreira mit
Joseph ferreira mit Glättung und siebung
Glättung und siebung





























































